相关试卷
-
1、部分含Fe或Al的物质的分类与相应化合价关系如图。下列推断不合理的是
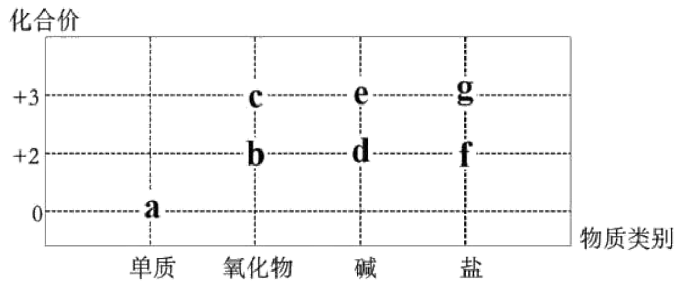 A、a的氯化物可能属于分子晶体 B、常温下,a遇到浓硝酸或者浓硫酸会钝化 C、若的转化中出现了颜色变化,则a在纯氧中点燃会生成b D、的转化可通过化合反应或置换反应来实现
A、a的氯化物可能属于分子晶体 B、常温下,a遇到浓硝酸或者浓硫酸会钝化 C、若的转化中出现了颜色变化,则a在纯氧中点燃会生成b D、的转化可通过化合反应或置换反应来实现 -
2、下列陈述Ⅰ与陈述Ⅱ均正确,但不具备因果关系的是
选项
陈述I
陈述II
A
酸性强弱:
烷基为吸电子基团,使羟基极性减弱,酸性减弱
B
非金属性:O>S
沸点
C
离子半径大小:
熔点:
D
某冠醚与能形成超分子,与则不能
该冠醚可与形成稳定的离子键
A、A B、B C、C D、D -
3、化合物是制备(结构如图所示)的一种原料,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,与原子的核外电子数之和等于原子的价层电子数,基态原子的s能级与p能级填充的电子总数相等。下列说法正确的是
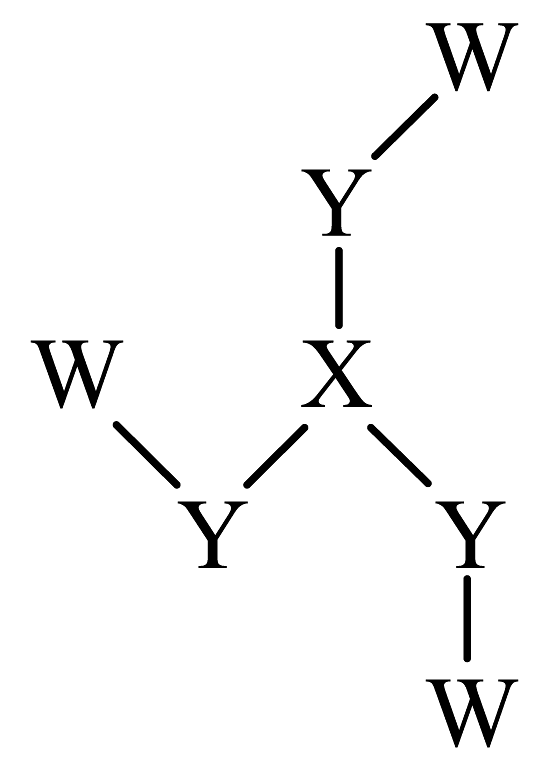 A、元素的电负性: B、中键角: C、中X和Y均满足8电子稳定结构 D、Z的单质可通过电解其氯化物水溶液的方法冶炼
A、元素的电负性: B、中键角: C、中X和Y均满足8电子稳定结构 D、Z的单质可通过电解其氯化物水溶液的方法冶炼 -
4、下图是铜和浓硫酸反应实验及性质探究实验的一体化装置。下列说法不正确的是
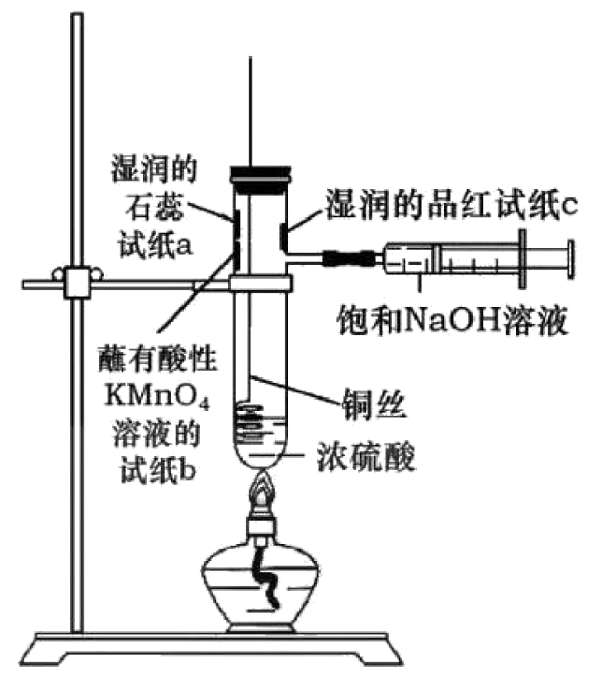 A、a处试纸变红,说明为酸性氧化物 B、c处和b处试纸均褪色,且原因相同 C、该设计的优点之一是能控制反应的发生与停止 D、铜和浓硫酸反应过程中出现灰白色固体,用水稀释后得到蓝色溶液
A、a处试纸变红,说明为酸性氧化物 B、c处和b处试纸均褪色,且原因相同 C、该设计的优点之一是能控制反应的发生与停止 D、铜和浓硫酸反应过程中出现灰白色固体,用水稀释后得到蓝色溶液 -
5、设为阿伏加德罗常数的值。下列说法正确的是A、中含键数目为 B、0.1mol肼中孤电子对数为 C、标准状况下,中含有氯离子的数目为 D、的溶液,含铬微粒总浓度为
-
6、为了保护埋在地下的钢管道,常用下图设计减缓腐蚀。下列说法正确的是
 A、装置中的钢管道作正极,发生电极反应: B、电子由镁块流出,经过潮湿的碱性土壤移动至钢管道 C、若将镁块替换成铜块,可减缓钢管道腐蚀速率 D、该金属保护方法为牺牲阳极保护法
A、装置中的钢管道作正极,发生电极反应: B、电子由镁块流出,经过潮湿的碱性土壤移动至钢管道 C、若将镁块替换成铜块,可减缓钢管道腐蚀速率 D、该金属保护方法为牺牲阳极保护法 -
7、下列描述物质制备和应用的离子方程式不正确的是A、模拟侯氏制碱法制备晶体: B、胃舒平[主要成分为]治疗胃酸过多: C、与水反应用作潜水艇氧气来源: D、海水提溴过程中将溴吹入吸收塔:
-
8、用碳酸钠标定盐酸,实验步骤为①研细、②加热 , 至质量不变、③冷却、④称量、⑤溶解、⑥用待测盐酸滴定。下列实验步骤所对应的操作正确的是
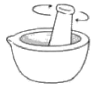
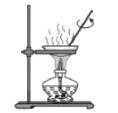
A.步骤①
B.步骤②
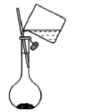
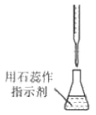
C.步骤⑤
D.步骤⑥
A、A B、B C、C D、D -
9、“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
用石墨作工业机械润滑剂
石墨可以导电
B
“卤水点豆腐”时加入硫酸钙
电解质能够使胶体聚沉
C
兴趣活动:新榨苹果汁提取液可使溶液变为浅绿色
苹果汁中含有还原性物质,能把溶液中的转化为
D
用氯乙烷气雾剂降温麻醉、快速镇痛
氯乙烷易汽化吸收热量
A、A B、B C、C D、D -
10、《洞天奥旨》记载:中药樟脑,气芳香浓烈刺鼻,有通窍、杀虫、止痛、辟秽之功效。下列说法正确的是
 A、樟脑属于芳香酮类化合物 B、樟脑分子中只有一个手性碳原子 C、樟脑分子可与氯气在光照条件下反应 D、樟脑不能使酸性溶液褪色,因此樟脑不能发生氧化反应
A、樟脑属于芳香酮类化合物 B、樟脑分子中只有一个手性碳原子 C、樟脑分子可与氯气在光照条件下反应 D、樟脑不能使酸性溶液褪色,因此樟脑不能发生氧化反应 -
11、化学处处呈现美。下列说法正确的是A、形状美:缺角的晶体能变成完美的立方体块,体现晶体自范性 B、结构美:石炭酸分子中具有单双键交替且呈平面六边形对称的结构 C、颜色美:烟花燃烧时,火焰颜色所呈现的是金属的化学性质 D、溶液美:在淀粉溶液中加入食用加碘盐,溶液变蓝色
-
12、下列化学用语或图示正确的是A、基态Mn原子价层电子轨道表示式:
 B、键形成的轨道重叠示意图:
B、键形成的轨道重叠示意图: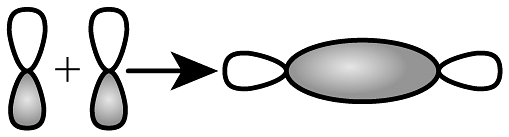 C、二氧化碳的空间填充模型:
C、二氧化碳的空间填充模型: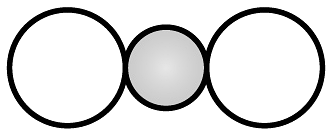 D、的离子结构示意图:
D、的离子结构示意图: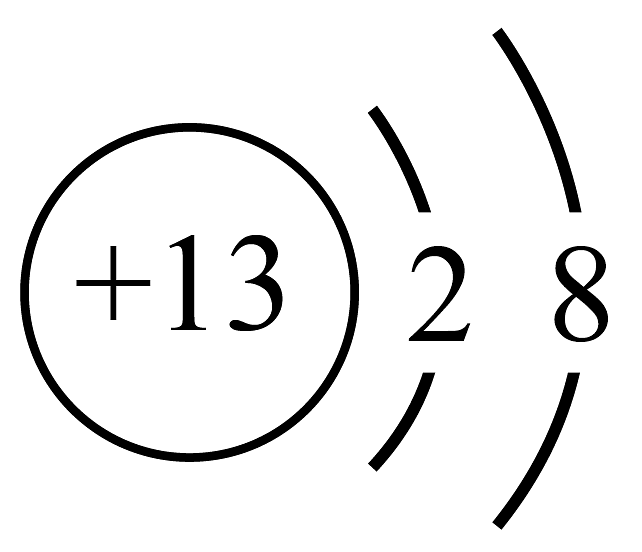
-
13、化学与生产生活、科技密切相关。下列说法正确的是A、“奋斗者号”潜水器含钛合金,其熔点、强度都高于纯钛金属 B、高强度芳纶纤维(聚对苯二甲酰对苯二胺)可通过缩聚反应合成 C、美缝剂-环氧彩砂中的石英砂与金刚砂属于同素异形体 D、利用合成脂肪酸,实现了无机小分子向有机高分子的转变
-
14、化合物是从大豆中分离出来的一种新型异戊烯基异黄酮,具有重要的生物防御活性,其合成路线如下。

已知:
 (R为H或烃基)。(1)、化合物A的化学名称为 , 化合物D中官能团的名称为。(2)、化合物C的结构简式为。(3)、EF的反应类型是 , F中碳原子的杂化轨道的类型为。(4)、的化学方程式为。(5)、在B的同分异构体中,同时满足下列条件的共有种。
(R为H或烃基)。(1)、化合物A的化学名称为 , 化合物D中官能团的名称为。(2)、化合物C的结构简式为。(3)、EF的反应类型是 , F中碳原子的杂化轨道的类型为。(4)、的化学方程式为。(5)、在B的同分异构体中,同时满足下列条件的共有种。①能够发生银镜反应;②与溶液发生显色发应;③苯环上有2个取代基。
(6)、J→K多步反应中包含“去除保护”步骤,依据I→K的原理,I先“去除保护”再“关环”会生成一种含有4个六元环的有机化合物 , 其结构简式是。 -
15、高铁酸钾是一种新型绿色消毒剂,其制备与应用探究如下:
I.合成
步骤①:按图1装置,将溶液加入仪器a中,控制温度低于20℃,搅拌下通入至饱和,再加入固体,充分反应得到强碱性饱和溶液。
步骤②:将盛有固体的烧杯置于冰水浴中,分批加入①中所得溶液,搅拌,反应得到溶液,过滤。
步骤③:在滤液中加入饱和溶液,冰水浴保持 , 过滤得到粗产品。将粗产品纯化得到纯产品。

II.用去除废水中苯酚的探究
对苯酚的去除率随着的变化关系如图2所示。

已知:
1.在较高温度下发生歧化反应生成。
II.在强碱性溶液中比较稳定,其氧化能力随着的增大而减小。
回答下列问题:
(1)、图1中,仪器a的名称是;乙装置的导管口应连接(填丙中标号)。(2)、步骤①中“控制温度低于20℃”的目的是。(3)、步骤②合成的离子方程式为。(4)、步骤③中,物质的溶解性:(填“>”或“<”);粗产品的纯化方法为。(5)、的产率为。(6)、图2中,时,苯酚去除率最高的原因是。 -
16、工业合成氨的反应为 , 原料中的可来源于水煤气,相关反应如下:
a.
b.
回答下列问题:
(1)、已知 , 则。(2)、在一定温度下,在体积固定的密闭容器中加入一定量的和 , 发生反应、 , 下列说法错误的是_______(填标号)。A、平衡时向容器中充入惰性气体,反应的平衡逆向移动 B、混合气体的密度保持不变时,说明反应体系已达到平衡 C、使用催化剂可提高CO平衡转化率 D、高温有利于反应a自发进行(3)、已知合成氨反应在催化剂表面要经历吸附(附着催化剂表面)、断键……成键、脱附(脱离催化剂表面)等过程,和在催化剂上进行断键的过程要(填“吸收”或“放出”)较多的能量,和在催化剂表面合成的反应过程的顺序为⑤→(用图1中序号表示)。 (4)、在℃、压强为的条件下,向一恒压密闭容器中通入的混合气体,体系中气体的含量与时间变化关系如图2所示:
(4)、在℃、压强为的条件下,向一恒压密闭容器中通入的混合气体,体系中气体的含量与时间变化关系如图2所示:①反应达到平衡,试求内氨气的平均反应速率 , 该反应的(用数字表达式表示,为以分压表示的平衡常数,分压总压物质的量分数)。
②若起始条件相同,在恒容容器中发生反应,则达到平衡时的含量符合图中(填“d”“e”“f”或“g”)点。
(5)、以为氮源通过电解法制取氨气装置如图所示。阴极的电极反应式为。
-
17、广西是中国铟(49In)产业的重要基地。某工厂从金属冶炼的废渣(主要含、、及少量不溶于酸的杂质)中回收铟的工艺流程如图所示:

已知:①室温下:;
②若溶液中某离子浓度小于 , 则认为该离子沉淀完全。
回答下列问题:
(1)、铟与铝同主族,基态铟原子的价层电子排布式为。(2)、为提高“酸浸1”的速率,可采取的措施是(任举一例)。(3)、“操作1”的具体操作:加热浓缩、、过滤、洗涤、干燥。(4)、若“酸浸2”后溶液中浓度为 , 用进行“中和”时,需控制的范围为。(5)、“浸渣3”的主要成分为(填化学式)。(6)、“还原”中主要反应的离子方程式为。(7)、磷化铟是半导体领域的重要原料,其晶胞结构类型与金刚石的相似,磷化铟晶体类型是晶体。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图为磷化铟的晶胞示意图,在晶胞坐标系中,a点铟的原子坐标为 , 则b点磷的原子坐标为。
-
18、常温下向的溶液中通入气体,随反应进行(不考虑分解),溶液中代表或)的值随溶液变化存在如图所示关系,下列说法错误的是
 A、线代表随溶液pH的变化线 B、 C、溶液的约为12 D、溶液中存在:
A、线代表随溶液pH的变化线 B、 C、溶液的约为12 D、溶液中存在: -
19、在工业生产上可利用硫与为原料制备。
450℃以上,发生反应I:;
600℃以上,发生反应Ⅱ:2。
一定条件下,分解产生的体积分数、与反应中平衡转化率与温度的关系如图所示。下列说法错误的是
 A、反应Ⅱ的 B、的体积分数保持不变,说明反应处于平衡状态 C、在密闭容器中 , 某温度下若完全分解,当体积分数为时,转化率为 D、反应Ⅱ温度不低于600℃的原因是:低于此温度,浓度小,反应速率慢
A、反应Ⅱ的 B、的体积分数保持不变,说明反应处于平衡状态 C、在密闭容器中 , 某温度下若完全分解,当体积分数为时,转化率为 D、反应Ⅱ温度不低于600℃的原因是:低于此温度,浓度小,反应速率慢 -
20、某新型储氢材料的晶胞结构如图所示,该立方晶胞参数为为阿伏加德罗常数的值,下列说法错误的是
 A、与最近且距离相等的有12个 B、晶胞的化学式为 C、的空间结构为正四面体形 D、晶体的密度为
A、与最近且距离相等的有12个 B、晶胞的化学式为 C、的空间结构为正四面体形 D、晶体的密度为