相关试卷
-
1、从不同的角度对物质进行分类有利于研究物质的组成与性质。
现有以下5种物质:①Cu ②NaCl ③饱和硫酸铁溶液 ④ ⑤干冰
回答下列问题:
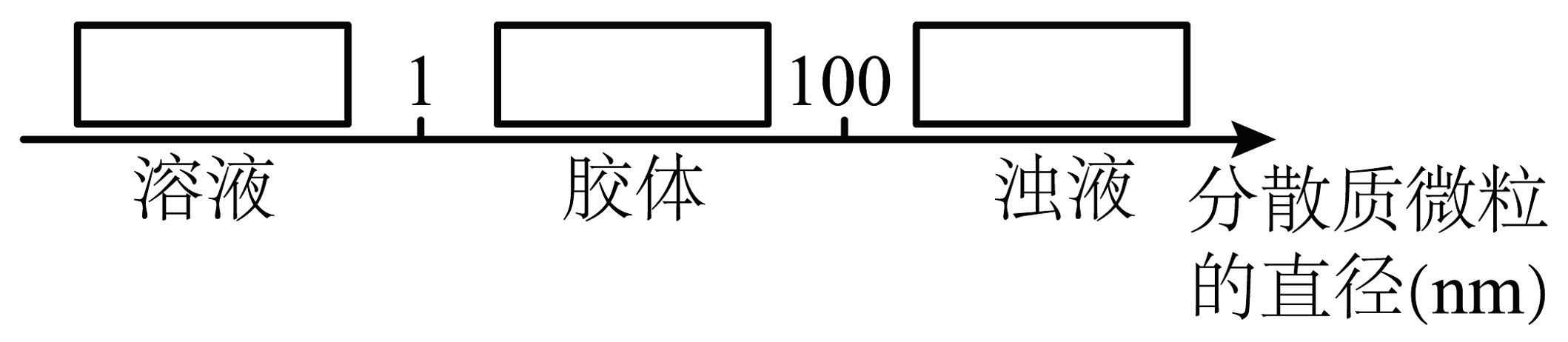
(1)、以上物质能导电的有(填序号)。(2)、以上物质属于电解质的有(填序号)。(3)、分别写出②、④在水中的电离方程式、。(4)、①可溶解在③中,产物中金属元素均为+2价,该反应的离子方程式为。(5)、将少量③分别滴加到下列物质中,得到三种分散系a、b、c。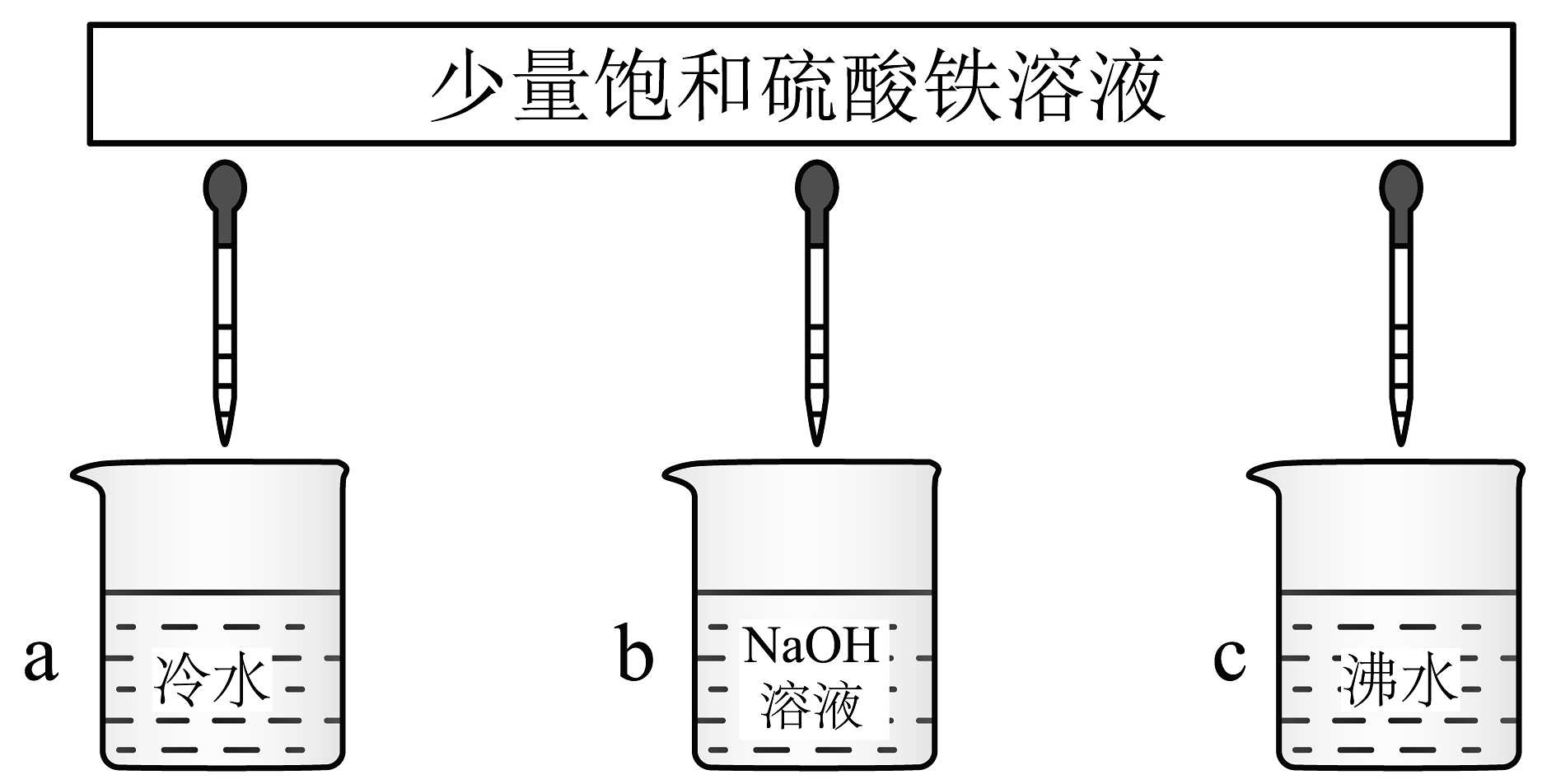
试将a、b、c符号以及对应的分散质具体的化学式填入下列方框中:。
 (6)、将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是;反应片刻后,可观察到有气体产生,其离子方程式是。
(6)、将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是;反应片刻后,可观察到有气体产生,其离子方程式是。 -
2、某体系中发生的一个反应,反应物和生成物共六种微粒:Fe3+、Mn2+、MnO、H2O、Fe2+、H+ , 已知MnO为其中一种反应物,下列说法正确的是A、只有MnO和Fe2+是反应物 B、被还原的元素是Fe C、发生氧化反应的物质是MnO D、氧化剂与还原剂的个数比为1∶5
-
3、在反应3Cl2+6KOH(浓)KClO3+5KCl+3H2O中,氧化剂与还原剂的物质的量之比为A、5∶1 B、4∶1 C、1∶5 D、1∶4
-
4、下列各组微粒中,一定条件下均可以作氧化剂的是A、、、 B、、、 C、、、 D、、、
-
5、下列离子方程式的书写正确的是A、铝与盐酸反应:Al + 6H+= Al3++ 3H2↑ B、CO2通入NaOH溶液中:CO2+ OH-= CO+H2O C、澄清石灰水与盐酸反应:Ca(OH)2+ 2H+= Ca2++ 2H2O D、碳酸钠与氯化钙混合: CO+Ca2+= CaCO3↓
-
6、下列说法正确的是A、熔融NaCl能导电,是因为通电时NaCl发生了电离 B、NaCl固体不导电,因为NaCl固体中无带电微粒 C、NH4NO3电离时产生了NH、NO , 无金属离子,所以NH4NO3不是盐 D、NaHSO4在水溶液中电离生成了Na+、H+、SO三种离子
-
7、实验小组用如下流程探究含氮化合物的转化。为阿伏加德罗常数的值,下列说法正确的是
 A、“反应1”中,每消耗 , 在下得到 B、“反应2”中,每生成0.1molNO,转移电子数为 C、在密闭容器中进行“反应3”,充分反应后体系中有个 D、“反应4”中,为使完全转化成 , 至少需要个
A、“反应1”中,每消耗 , 在下得到 B、“反应2”中,每生成0.1molNO,转移电子数为 C、在密闭容器中进行“反应3”,充分反应后体系中有个 D、“反应4”中,为使完全转化成 , 至少需要个 -
8、已知:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是A、若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)=n(Cl-) B、若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5 C、若产物为NaClO、NaClO3、NaCl,则由吸收后的溶液中n(Cl-)和n(ClO-)可计算吸收的n(Cl2) D、若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
-
9、探究性学习小组发现过氧化氢溶液产品外包装有如下注意事项:
1.外用消毒剂,不得口服,置于儿童不易触及处。
2.本品对金属有腐蚀作用,慎用。
3.避免与碱性及还原性物质混合。
4.对本品主要有效成分过敏者禁用。
5.本品用于空气消毒时,应在无人条件下进行
的性质与浓度密切相关,实验室常用酸性高锰酸钾测定过氧化氢的浓度。测定之前,先用0.1000mol/L溶液准确标定新制高锰酸钾溶液的浓度,然后再用高锰酸钾溶液测定的浓度。
已知:①20.00mL未知浓度的高锰酸钾溶液恰好消耗了25.00mL0.1000mol/L溶液。
②20.00mL某浓度溶液标定过程中消耗高锰酸钾溶液体积为16.00mL。
③常见消毒对象使用溶液浓度如下表所示:
消毒对象
纺织品
餐具
器械
空气
使用浓度(质量分数)
0.25%~0.5%
0.5%~1.0%
1.0%
1.2%~1.8%
④稀溶液密度可近似为。
⑤溶液与酸性高锰酸钾溶液反应离子方程式:。
(1)、请写出酸性高锰酸钾氧化过氧化氢的离子方程式:(酸性条件下高锰酸钾对应的还原产物为)。(2)、上述过氧化氢溶液可以直接使用的消毒对象为:。 -
10、探究性学习小组发现过氧化氢溶液产品外包装有如下注意事项:
1.外用消毒剂,不得口服,置于儿童不易触及处。
2.本品对金属有腐蚀作用,慎用。
3.避免与碱性及还原性物质混合。
4.对本品主要有效成分过敏者禁用。
5.本品用于空气消毒时,应在无人条件下进行
回答与性质相关的问题
(1)、通过材料阅读可以获取过氧化氢可能具有的性质是_______。A、不稳定性 B、氧化性 C、还原性 D、酸性(2)、的性质探究:向酸化的溶液中加入溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊()液,继续加入溶液,红色浑浊液又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法不正确的是_______。A、是分解反应的催化剂 B、既表现氧化性又表现还原性 C、将还原为 D、红色浑浊变为蓝色溶液可表示为: -
11、某种胃药的有效成分为碳酸钙,室温测定其中碳酸钙含量的操作如下(假设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸
请回答下列问题:
(1)、正确的操作顺序是(填序号)。(2)、研碎药品所选择的仪器是_______。A、 B、
B、 C、
C、 D、
D、 (3)、测定过程中发生反应的离子方程式为;。(4)、该测定实验共进行了4次。实验室现有50mL、100mL、250mL3种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为。(5)、利用浓盐酸配制0.10mol/L稀盐酸的过程中,下列操作会引起浓度偏高的是_______。A、用量筒量取浓盐酸时俯视刻度线 B、烧杯和玻璃棒的洗涤液未完全注入容量瓶中 C、定容时俯视容量瓶上的刻度线 D、定容时,添加蒸馏水超过刻度线后,用胶头滴管吸出多余的溶液(6)、某同学4次测定所消耗的NaOH溶液的体积如下:
(3)、测定过程中发生反应的离子方程式为;。(4)、该测定实验共进行了4次。实验室现有50mL、100mL、250mL3种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为。(5)、利用浓盐酸配制0.10mol/L稀盐酸的过程中,下列操作会引起浓度偏高的是_______。A、用量筒量取浓盐酸时俯视刻度线 B、烧杯和玻璃棒的洗涤液未完全注入容量瓶中 C、定容时俯视容量瓶上的刻度线 D、定容时,添加蒸馏水超过刻度线后,用胶头滴管吸出多余的溶液(6)、某同学4次测定所消耗的NaOH溶液的体积如下:测定次数
第1次
第2次
第3次
第4次
13.00
12.95
13.05
13.00
根据该同学的实验数据计算这种药片中碳酸钙的质量分数为。
-
12、下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知B、C、D是非金属单质,且在常温常压下都是气体,D常用于自来水的杀毒、消毒;化合物G的焰色试验呈黄色,化合物F通常状况下成气态。

请回答下列问题:
(1)、D的组成元素在周期表中的位置:;物质C的结构式为:。(2)、写出E与反应的化学方程式:。(3)、标准状况下112mL气体通入1L0.01mol/LG溶液反应,其离子方程式为:。(4)、物质B在一定条件下与物质F发生置换反应,其化学方程式为:。 -
13、符号表征是自然科学学习的重要方式,根据下图(NaCl固体在水中的溶解和形成水合离子示意图)请用化学符号回答相关问题。
 (1)、用电子式表示NaCl的形成过程:。(2)、氯化钠在水溶液中的电离方程式:。(3)、的结构示意图:。(4)、请用符号表示水合钠离子:。(5)、氯化钠是氯碱工业的重要原料,以氧化还原为模型思考氯化钠溶液通电后生成NaOH溶液、和的过程,并用方程式表示反应过程:。
(1)、用电子式表示NaCl的形成过程:。(2)、氯化钠在水溶液中的电离方程式:。(3)、的结构示意图:。(4)、请用符号表示水合钠离子:。(5)、氯化钠是氯碱工业的重要原料,以氧化还原为模型思考氯化钠溶液通电后生成NaOH溶液、和的过程,并用方程式表示反应过程:。 -
14、阅读以下材料,完成下面小题。
有关铁及其化合物的价类二维关系,如下图所示:
 (1)、下列物质转化不能一步实现的是A、 B、 C、 D、(2)、下列说法不正确的是A、氯化铁溶液有酸性,可用于刻蚀电路板 B、铁粉具有还原性,可用作食品抗氧化剂 C、氢氧化铝具有弱碱性,可用于抗酸药物 D、钠钾合金熔点低且熔沸点差距大,可用作核反应堆的传热介质(3)、杜甫诗句中“朱门酒肉臭,路有冻死骨”这里的“朱门”是指涂有的门A、 B、 C、 D、(4)、把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中和的物质的量浓度恰好相等。则已反应的和未反应的的物质的量之比为A、 B、 C、 D、(5)、有铁的氧化物样品,用300mL的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气3.36L,使其中的全部转化为 , 该样品可能的化学式是A、 B、 C、 D、(6)、下列离子方程式中,不正确的是A、铁与稀盐酸反应: B、氧化亚铁与稀盐酸反应: C、氯化铁溶液与铜反应: D、向氯化亚铁溶液中滴加双氧水:(7)、探究性学习小组利用如图所示方案制备沉淀。下列说法不正确的是
(1)、下列物质转化不能一步实现的是A、 B、 C、 D、(2)、下列说法不正确的是A、氯化铁溶液有酸性,可用于刻蚀电路板 B、铁粉具有还原性,可用作食品抗氧化剂 C、氢氧化铝具有弱碱性,可用于抗酸药物 D、钠钾合金熔点低且熔沸点差距大,可用作核反应堆的传热介质(3)、杜甫诗句中“朱门酒肉臭,路有冻死骨”这里的“朱门”是指涂有的门A、 B、 C、 D、(4)、把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中和的物质的量浓度恰好相等。则已反应的和未反应的的物质的量之比为A、 B、 C、 D、(5)、有铁的氧化物样品,用300mL的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气3.36L,使其中的全部转化为 , 该样品可能的化学式是A、 B、 C、 D、(6)、下列离子方程式中,不正确的是A、铁与稀盐酸反应: B、氧化亚铁与稀盐酸反应: C、氯化铁溶液与铜反应: D、向氯化亚铁溶液中滴加双氧水:(7)、探究性学习小组利用如图所示方案制备沉淀。下列说法不正确的是 A、①装置中可能发生反应: B、②装置中苯的作用是隔绝空气中的氧气 C、③装置中长滴管的作用是防止滴入NaOH溶液时将空气中氧气带入溶液 D、④装置开始反应时应关闭止水夹a,一段时间后再打开止水夹a(8)、高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,制备高铁酸钾流程如图所示。下列叙述正确的是
A、①装置中可能发生反应: B、②装置中苯的作用是隔绝空气中的氧气 C、③装置中长滴管的作用是防止滴入NaOH溶液时将空气中氧气带入溶液 D、④装置开始反应时应关闭止水夹a,一段时间后再打开止水夹a(8)、高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,制备高铁酸钾流程如图所示。下列叙述正确的是 A、红热的铁屑与干燥的氯气发生反应Ⅰ时,铁屑过量会生成和的混合物 B、在水溶液中,发生反应Ⅱ的离子方程式为: C、根据制备流程可知,高铁酸盐在水中的溶解度: D、高铁酸盐具有强氧化性可用于杀菌消毒,同时产生胶体具备絮凝净化功能
A、红热的铁屑与干燥的氯气发生反应Ⅰ时,铁屑过量会生成和的混合物 B、在水溶液中,发生反应Ⅱ的离子方程式为: C、根据制备流程可知,高铁酸盐在水中的溶解度: D、高铁酸盐具有强氧化性可用于杀菌消毒,同时产生胶体具备絮凝净化功能 -
15、阅读以下材料,完成下面小题。
纯碱是一种重要的化工原料,早期人们从草木灰中提取碳酸钾,后来又从盐碱地和盐湖等天然资源中获取碳酸钠,但天然碱的产量和纯度,远不能满足化工生产和人们日常生活的需求。的工业制法,历史上经历了3个阶段:
Ⅰ.路布兰法(N。Leblanc):主要原料包括食盐、硫酸、石灰石和煤粉。
Ⅱ.索尔维法(E.Solvay):以食盐、石灰石和氨为原料。简化工艺流程如下图所示。

Ⅲ.侯氏联碱法:该法最大的特点是滤去晶体后的母液含有大量的 , 向其中加入食盐使母液中的结晶出来作为氮肥,并将最后留下含有NaCl的母液循环使用,从而把食盐的利用率从原来的70%提高到98%。
(1)、齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳高温分解形成的灰)混合加水所得液体来洗涤丝帛。下列说法错误的是A、草木灰的主要成分碳酸钾可用作钾肥 B、“蜃”的主要成分属于难溶性的盐 C、“灰”和“蜃”混合加水所得溶液中含有KOH D、“蜃”加水混合后会发生化合反应(2)、路布兰制碱法。其化学反应过程如下:①固体食盐与硫酸反应生成硫酸钠和氯化氢:
②硫酸钠、石灰石和煤粉煅烧生成纯碱和硫化钙:
③硫化钙、二氧化碳和水发应生成碳酸钙和硫化氢:
④硫化氢被氧化生成硫酸,硫酸可以循环使用:
下列有关说法正确的是
A、反应①用饱和食盐水与硫酸反应有利于制备HCl气体 B、反应②中氧化剂与还原剂的物质的量之比为 C、反应③生成的在常温下是气体,属于非电解质 D、反应④用替代生成相同质量的 , 理论上转移电子数不变(3)、利用下图所示装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。下列有关装置和仪器的表述不正确的是 A、装置a的作用是防止外界水蒸气进入C装置 B、装置B的作用是除去中混有的HCl气体 C、装置C中仪器b的作用是控制气体的流速和防止倒吸 D、装置D中止水夹先打开一段时间,再打开(4)、如下图所示模拟索尔维法制备碳酸氢钠。下列有关说法正确的是
A、装置a的作用是防止外界水蒸气进入C装置 B、装置B的作用是除去中混有的HCl气体 C、装置C中仪器b的作用是控制气体的流速和防止倒吸 D、装置D中止水夹先打开一段时间,再打开(4)、如下图所示模拟索尔维法制备碳酸氢钠。下列有关说法正确的是 A、装置A中盛装稀盐酸的仪器为分液漏斗 B、装置B用饱和溶液,除杂效果更好 C、装置C中反应方程式为: D、装置D中氧化钙可以由苛性钠或浓硫酸替代(5)、我国科学家侯德榜以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,对世界制碱工业做出了卓越贡献,工艺流程如下左图所示;图为和NaCl溶解度随温度变化情况。
A、装置A中盛装稀盐酸的仪器为分液漏斗 B、装置B用饱和溶液,除杂效果更好 C、装置C中反应方程式为: D、装置D中氧化钙可以由苛性钠或浓硫酸替代(5)、我国科学家侯德榜以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,对世界制碱工业做出了卓越贡献,工艺流程如下左图所示;图为和NaCl溶解度随温度变化情况。
下列相关说法不正确的是
A、煅烧炉中主要发生反应: B、经过沉淀池获取的母液中几乎不含有 C、循环Ⅰ的主要物质是 D、母液加入食盐细粉后选择低温结晶有利于副产品的获取(6)、制碱原材料饱和食盐水的纯度对产品纯度有很大的影响。从海水中得到的粗盐往往含有可溶性杂质(主要有、、)和不溶性杂质(泥沙)等,必须进行分离和提纯后才能用于制碱,粗盐提纯的部分流程如图所示,下列说法正确的是 A、操作Ⅰ、Ⅱ均需要用到的玻璃仪器有烧杯和玻璃棒 B、a为含的可溶性盐或碱,溶液b为含的可溶性盐,且a与b顺序不能调换 C、室温下,加入适量c的过程中只发生了反应 D、沉淀的成分为:、、、、泥沙等(7)、现加热10.00g的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为9.69g,则原混合固体中碳酸钠的质量分数为A、16.8% B、93.8% C、83.2% D、91.6%
A、操作Ⅰ、Ⅱ均需要用到的玻璃仪器有烧杯和玻璃棒 B、a为含的可溶性盐或碱,溶液b为含的可溶性盐,且a与b顺序不能调换 C、室温下,加入适量c的过程中只发生了反应 D、沉淀的成分为:、、、、泥沙等(7)、现加热10.00g的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为9.69g,则原混合固体中碳酸钠的质量分数为A、16.8% B、93.8% C、83.2% D、91.6% -
16、下列二氧化碳相关化学符号表示不正确的是
分子式
电子式
A.
B.

结构式
分子结构模型
C.
D.
 A、A B、B C、C D、D
A、A B、B C、C D、D -
17、常温下能与NaOH溶液反应,过程中体现的性质是A、不稳定性 B、还原性 C、碱性 D、酸性
-
18、下列与实验有关的图标对应不正确的是


A.护目镜
B.排风


C.热烫
D.洗手
A、A B、B C、C D、D -
19、联合国《化学品分类及标记全球协调制度》(简称GHS)中的标准符号被我国国家标准(GB13690-2009)采用,以方便化学品的贸易与运输。以下GHS标准符号与示意不匹配的是


A.易燃类物质
B.氧化性物质


C.放射性物质
D.腐蚀类物质
A、A B、B C、C D、D -
20、
二甲醚(CH3OCH3)是一种洁净液体燃料,工业上可以通过以下两种工艺合成:
Ⅰ.方法1:以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压强:2.0~10.0 MPa.温度:230-280℃)进行下列反应:
反应i:CO(g)+2H2(g)CH3OH(g) ΔH1=-99 kJ·mol-1
反应ii:2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
反应iii:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
(1)在该条件下,若只发生反应i,各物质的起始浓度分别为c(CO)=1.2 mol·L-1 , c(H2)=2.8 mol·L-1 , 8min后达到化学平衡状态,CO的转化率为50%,则8min内H2的平均反应速率为。
(2)在t℃时。反应ii的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质
CH3OH
CH3OCH3
H2O
c/( mol·L-1)
0.05
2.0
2.0
此时(填“>”“<”或“=”)
(3)催化总反应为:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)
①ΔS0(填“>”“<”或“=”),该反应在条件下自发。
②CO的平衡转化率(CO)与温度T、压强p的关系如图1所示:

若P2<P1 , 请在图1中画出压强p2时CO的平衡转化率的变化趋势。
(4)在催化剂的作用下同时进行三个反应,发现随着起始投料比的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势。解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因。

Ⅱ.方法2:先用CO2加H2合成甲醇,涉及以下主要反应:
反应i.甲醇的合成:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.6kJ·mol-1
反应ii.逆水汽变换:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
再由甲醇脱水合成二甲醚。
在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

(5)下列说法正确的是。
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
E.图乙中三条曲线趋于相等的原因,是因为达到一定温度后,以反应ii为主