相关试卷
-
1、 可用于水的杀菌消毒,遇水发生反应:。下列说法正确的是( )A、反应中各分子的键均为键 B、反应中各分子的VSEPR模型均为四面体形 C、键长小于H—O键长 D、HClO分子中Cl的价电子层有2个孤电子对
-
2、 侯氏制碱法突破西方技术垄断,推动了世界制碱技术的发展,其主要反应为NaCl+。下列有关化学用语或说法正确的是( )A、的电子式:
 B、的空间结构:直线形
C、的晶体类型:离子晶体
D、溶解度:
B、的空间结构:直线形
C、的晶体类型:离子晶体
D、溶解度:
-
3、 东北三省及内蒙古资源丰富,下列资源转化的主要过程不属于化学变化的是( )A、石灰石煅烧 B、磁铁矿炼铁 C、煤的液化 D、石油分馏
-
4、巴洛沙韦酯K(
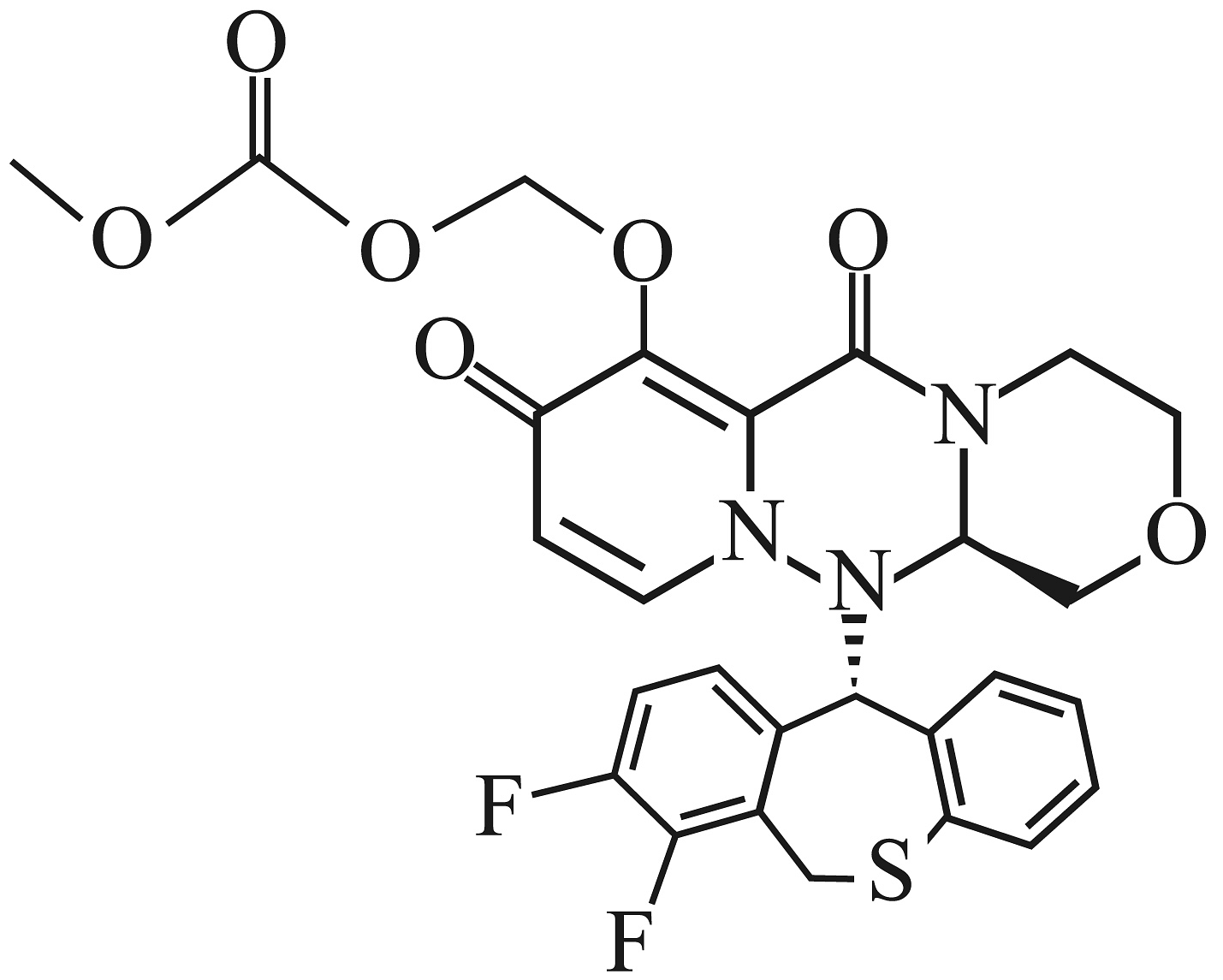 )能抑制流感病毒帽状依赖型核酸内切酶,从而抑制病毒的合成。其部分优化路线如下:
)能抑制流感病毒帽状依赖型核酸内切酶,从而抑制病毒的合成。其部分优化路线如下: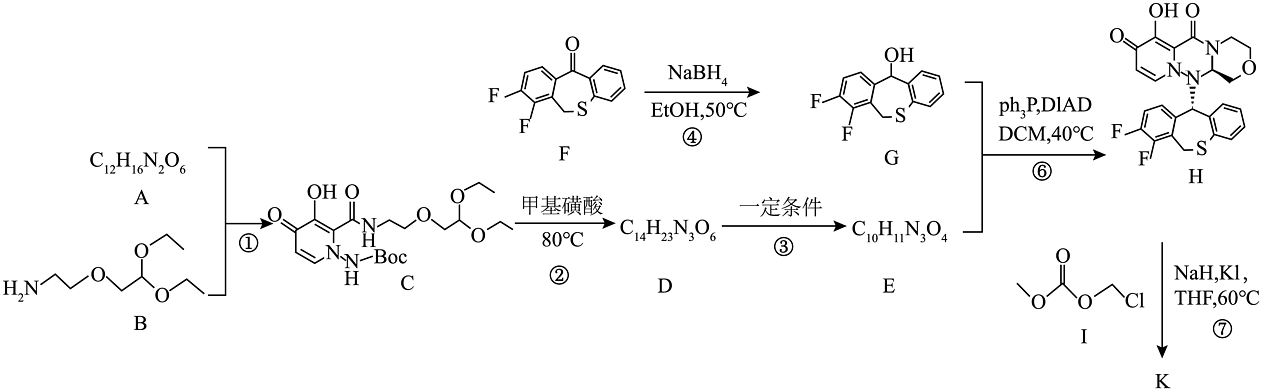
已知:①是叔丁氧羰基的缩写,甲基磺酸条件下容易脱去。
②
 。
。③
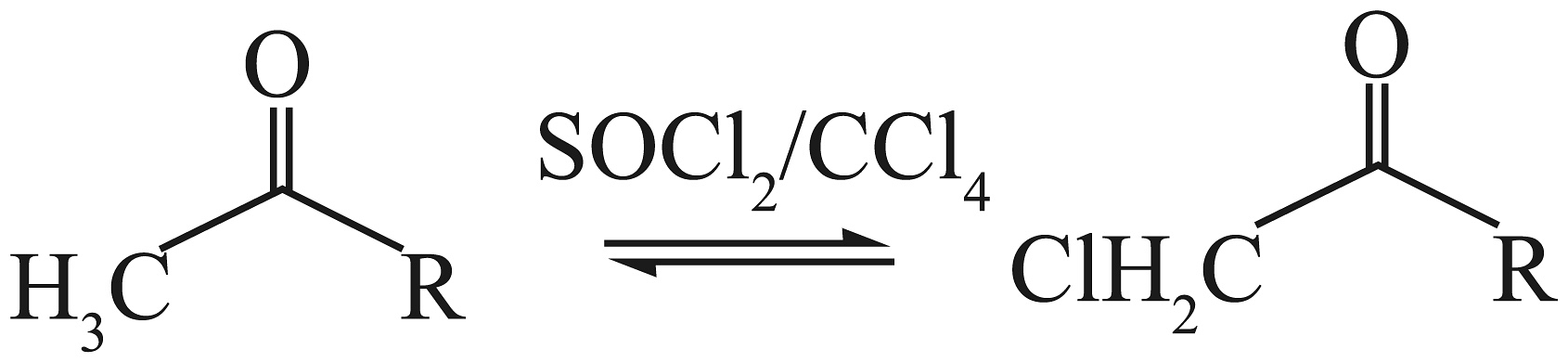 。(1)、化合物B中的官能团名称是。(2)、化合物A的结构简式为。(3)、写出过程③的化学方程式。(4)、下列说法正确的是____________。A、化合物G可发生水解、消去反应 B、过程②可能会生成 C、过程④为还原反应,产生手性碳原子 D、K的分子式为(5)、写出同时符合下列条件的化合物G的4种同分异构体的结构简式。
。(1)、化合物B中的官能团名称是。(2)、化合物A的结构简式为。(3)、写出过程③的化学方程式。(4)、下列说法正确的是____________。A、化合物G可发生水解、消去反应 B、过程②可能会生成 C、过程④为还原反应,产生手性碳原子 D、K的分子式为(5)、写出同时符合下列条件的化合物G的4种同分异构体的结构简式。①含有结构
②能发生银镜反应的芳香族化合物,苯环上有4个取代基,不直接与F原子相连,且含
 基团
基团③核磁共振氢谱显示含4种不同环境的H原子
(6)、乙醛和L( )为原料可合成化合物B,利用已知信息和流程路线中的相关信息,设计合成路线(用流程图表示,无机试剂任选)。
)为原料可合成化合物B,利用已知信息和流程路线中的相关信息,设计合成路线(用流程图表示,无机试剂任选)。 -
5、甘氨酸亚铁是一种新型的铁营养强化剂。实验室制备甘氨酸亚铁部分装置如下图(夹持和加热、搅拌仪器已省略)。
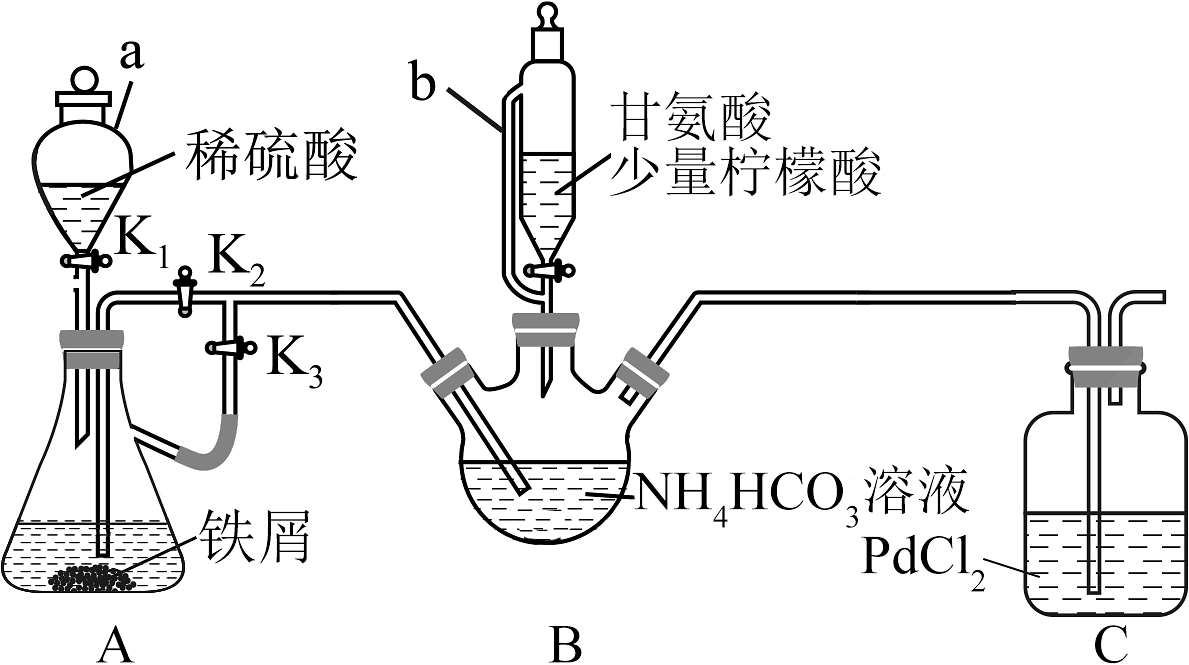
已知:
i.柠檬酸易溶于水和乙醇,有弱酸性和还原性。
ii.易溶于水,难溶于乙醇。
iii.通入溶液中的反应:(黑色)
实验步骤:
Ⅰ.关闭活塞 , 打开活塞和 , 加入适量稀硫酸(铁屑足量),当出现____________现象后关闭活塞。
Ⅱ.____________,磁力搅拌器不断搅拌,B中生成沉淀。
Ⅲ.在恒温条件下继续磁力搅拌,然后向B中滴加甘氨酸和柠檬酸溶液,调节溶液至5.5左右,使反应物充分反应。
Ⅳ.反应完成后,向B的反应混合物中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得到粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)、仪器b的名称为。(2)、步骤Ⅰ中横线处的现象是。(3)、下列说法正确的是____________。A、步骤Ⅰ中的铁屑可以改为铁粉,从而加快反应速率 B、步骤Ⅱ横线处操作为:关闭 , 打开 , 将A中溶液压入到B中 C、步骤Ⅲ可以用水浴加热 D、步骤Ⅳ中洗涤剂可以用冰水(4)、写出B中生成甘氨酸亚铁的化学方程式。(5)、步骤Ⅲ中加入少量柠檬酸的一个作用是能调节溶液促进溶解,另一个作用是。(6)、已知甘氨酸亚铁的结构为: , 请分析,等浓度溶液导电能力远弱于溶液的原因。
, 请分析,等浓度溶液导电能力远弱于溶液的原因。 -
6、硫酸工业在国民经济中占有重要地位。接触法制硫酸的关键反应为的催化氧化:(1)、其他条件不变时,下列措施有利于提高平衡转化率的是__________(填序号)。A、恒容下,按原投料比继续充入和 B、恒压下充入 C、降低温度 D、选择更高效的催化剂(2)、研究表明,催化氧化的反应速率方程为:。式
中:k为反应速率常数,随温度t升高而增大;为平衡转化率,为某时刻转化率,n为常数。在不同下将一系列温度下的k、值代入上述速率方程,得到曲线,如图1所示。下列说法正确的是___________。
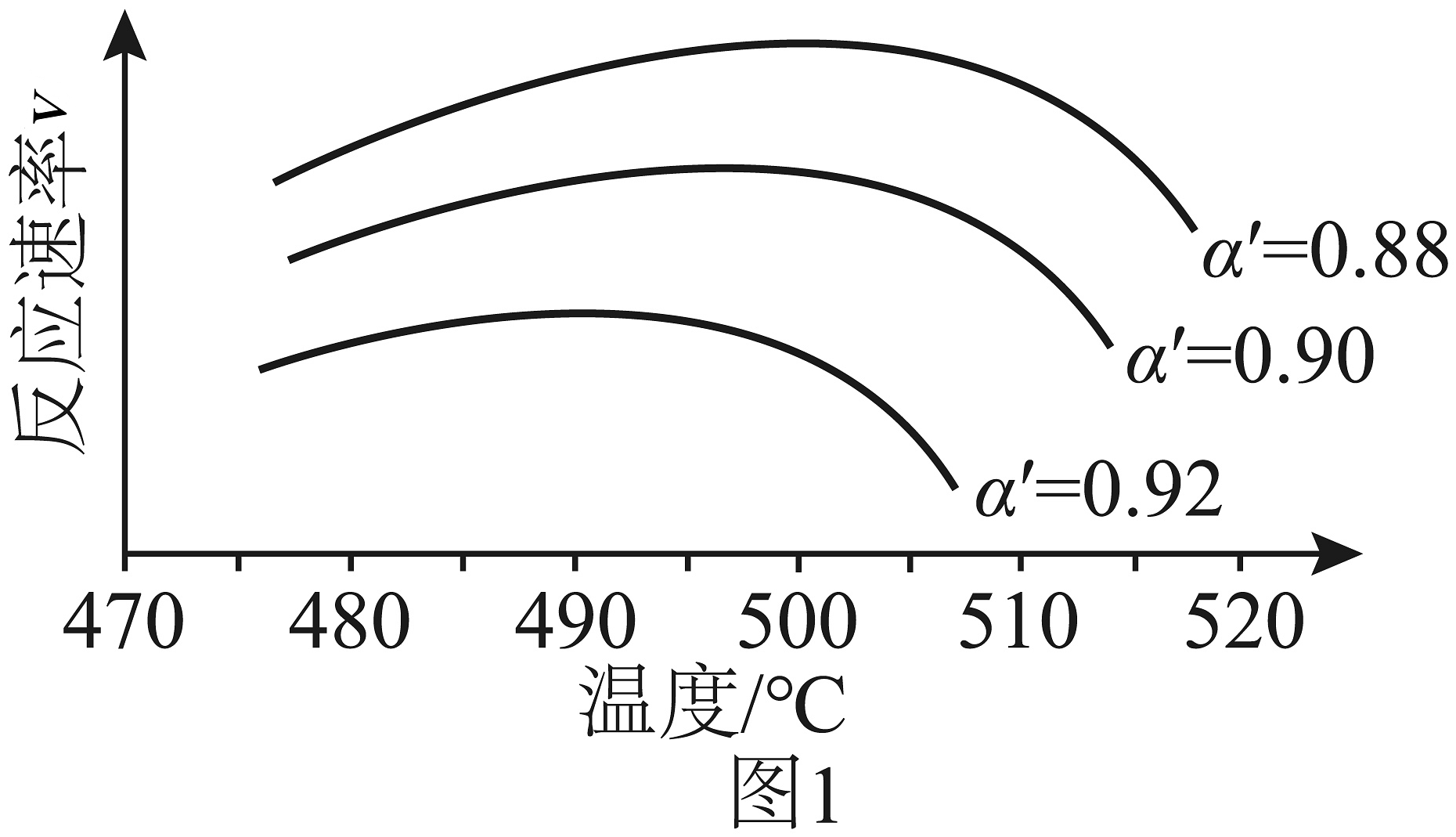 A、温度越高,反应速率越大 B、的曲线可以代表平衡转化率所对应的曲线 C、越大,反应速率最大值对应温度越低 D、由图可知,工业生产中为了追求生产效率,应尽可能选择低温(3)、根据图1,在图2中画出不同转化率与最适宜温度的大致曲线。(曲线上v最大值所对应温度称为该下反应的最适宜温度)
A、温度越高,反应速率越大 B、的曲线可以代表平衡转化率所对应的曲线 C、越大,反应速率最大值对应温度越低 D、由图可知,工业生产中为了追求生产效率,应尽可能选择低温(3)、根据图1,在图2中画出不同转化率与最适宜温度的大致曲线。(曲线上v最大值所对应温度称为该下反应的最适宜温度)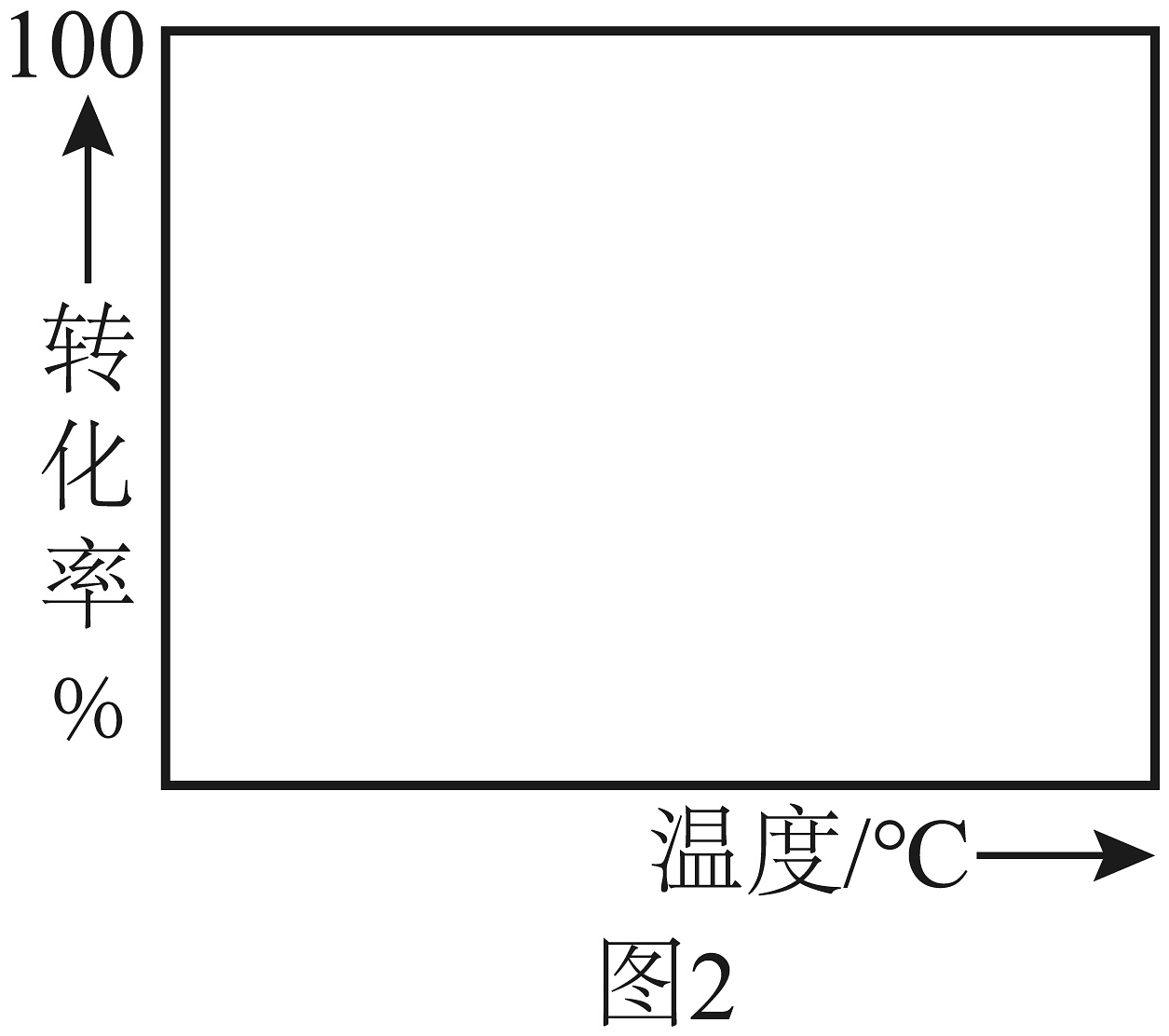 (4)、尾气吸收是硫酸工业必须要考虑的问题,某研究小组用溶液吸收尾气中的生成溶液或溶液。已知:的。
(4)、尾气吸收是硫酸工业必须要考虑的问题,某研究小组用溶液吸收尾气中的生成溶液或溶液。已知:的。①的溶液的。
②保险粉连二亚硫酸钠是一种重要的还原剂,广泛应用于纺织、印染、食品抗氧化等领域,可以通过电解溶液制备,装置如图:

a.写出阴极的电极反应式。
b.已知的结构为
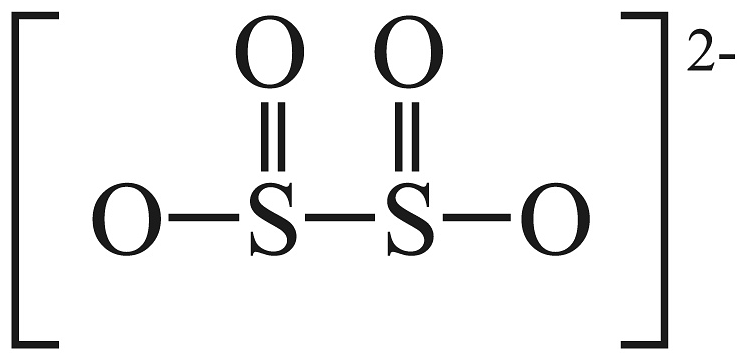 , 请从共价键角度解释具有强还原性的原因。
, 请从共价键角度解释具有强还原性的原因。 -
7、锰氧化物具有较大应用价值,回答下列问题:(1)、下列叙述正确的是____________。A、基态价电子排布式是 B、离子半径: C、是碱性氧化物 D、的第三电离能大于的第三电离能(2)、的某种氧化物的四方晶胞及其在平面的投影如图所示,该氧化物化学式为 , 的配位数为。
 (3)、(见图)是晶型转变的诱导剂。熔点:(填“>”“<”或“=”),从结构角度分析原因。
(3)、(见图)是晶型转变的诱导剂。熔点:(填“>”“<”或“=”),从结构角度分析原因。 (4)、锰锌铁氧体元件是电子线路中的基础组成部分。某实验室利用废弃电子产品中的锰锌铁氧体制备和 , 可用于电池,催化剂等行业,其工艺流程如下:
(4)、锰锌铁氧体元件是电子线路中的基础组成部分。某实验室利用废弃电子产品中的锰锌铁氧体制备和 , 可用于电池,催化剂等行业,其工艺流程如下: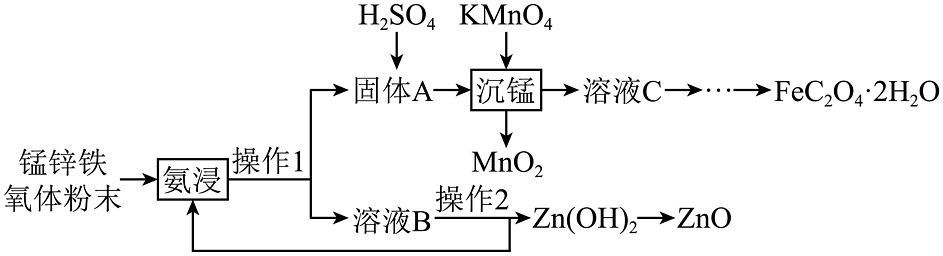
①氨浸后溶液B中存在的阳离子有(填写化学式),操作1是 , 操作2是。
②沉锰反应的离子方程式为。
-
8、化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。

已知:
下列说法不正确的是
A、步骤Ⅰ中发生反应的离子方程式为 B、若消耗的溶液的体积为 , 则废水中苯酚含量为 C、步骤Ⅱ中加入的溶液不能过量 D、由于有挥发性,可能会造成测定结果偏高 -
9、室温下,用只含少量的溶液制备的过程如图所示。已知。下列说法不正确的是
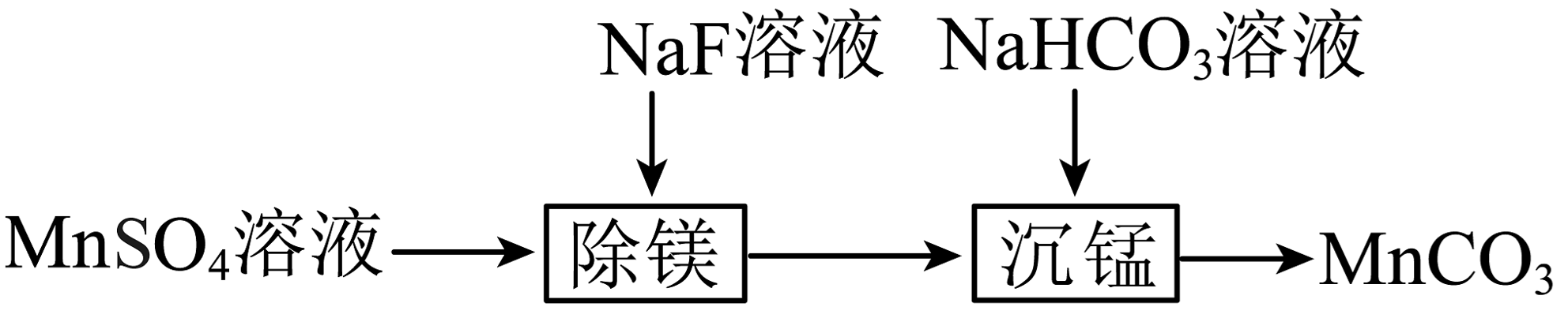 A、“除镁”得到的上层清液中: B、溶液的约为8,可得出: C、反应的平衡常数 D、“沉锰”后的滤液中:
A、“除镁”得到的上层清液中: B、溶液的约为8,可得出: C、反应的平衡常数 D、“沉锰”后的滤液中: -
10、傅克酰基化反应的机理如下:

已知:步骤Ⅱ为决速步
下列说法不正确的是
A、步骤Ⅰ还生成 B、与 发生傅克酰基化反应的速率:苯>甲苯
C、该机理涉及加成反应和消去反应
D、根据机理,苯也可以与反应,所得的产物为
发生傅克酰基化反应的速率:苯>甲苯
C、该机理涉及加成反应和消去反应
D、根据机理,苯也可以与反应,所得的产物为
-
11、氮和氧是构建化合物的常见元素,某的晶胞如图。
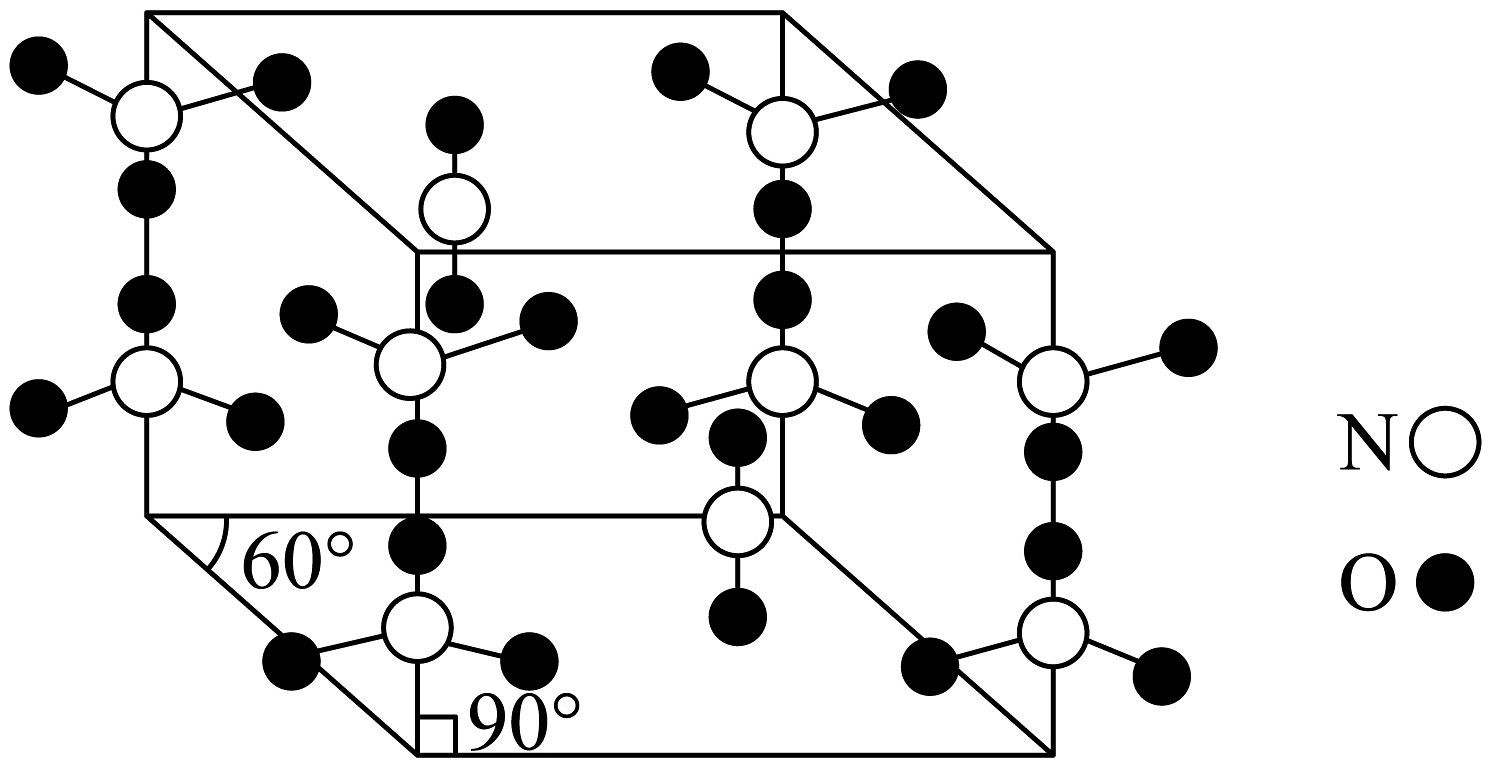
下列说法不正确的是
A、该氮氧化物中N都呈价 B、该晶体中氮原子的杂化方式有两种 C、与足量红棕色气体反应生成的化学方程式为: D、晶体类型是分子晶体 -
12、电解法制取有广泛用途的 , 工作原理如图1所示。已知:只在强碱性条件下稳定。下列说法不正确的
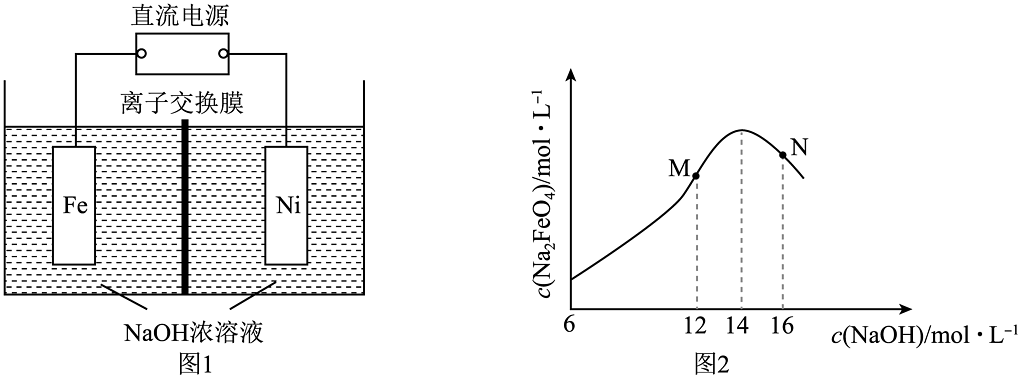 A、离子交换膜应该选择阳离子交换膜 B、阳极的电极反应式为: C、由图2可知,N点浓度低是由于过高,铁电极上可能有生成 D、电解产生(标况)时,电路中转移电子数目为
A、离子交换膜应该选择阳离子交换膜 B、阳极的电极反应式为: C、由图2可知,N点浓度低是由于过高,铁电极上可能有生成 D、电解产生(标况)时,电路中转移电子数目为 -
13、下列说法不正确的是A、依据相同温度下可逆反应的浓度商Q与平衡常数K大小的比较,可推断反应进行的方向 B、平衡:中,断裂中的共价键所需能量小于断裂中的共价键所需能量 C、依据第二周期主族元素电负性依次增大,可推断它们的第一电离能也依次增大 D、在合成氨反应中: , 一定条件下,将通入恒容的容器中反应,当物质的量分数不变时不能判断可逆反应是否达平衡状态
-
14、下列实验装置正确,且能达到相应实验目的的是
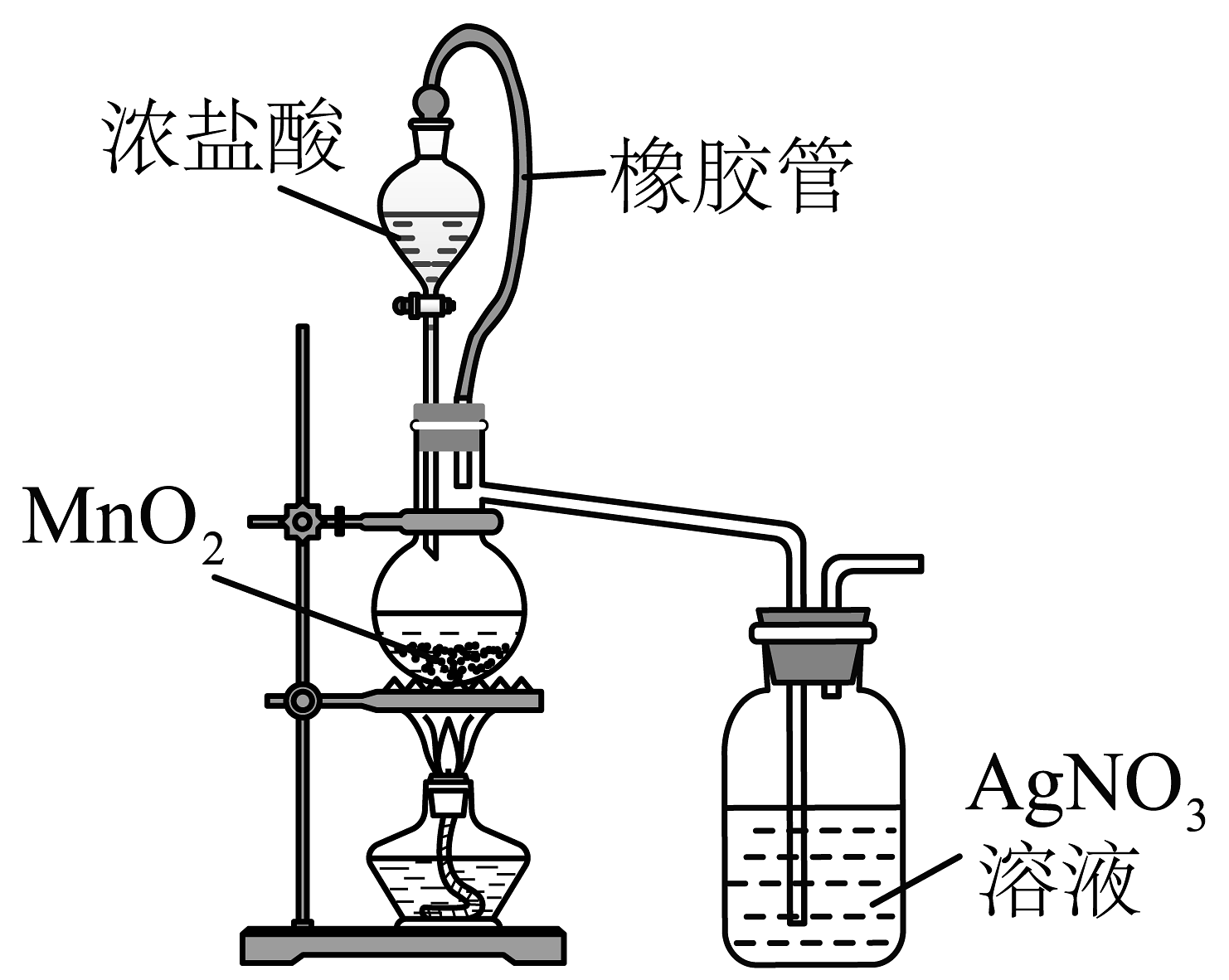

A.验证反应有生成
B.验证铁粉与水蒸气反应有产生

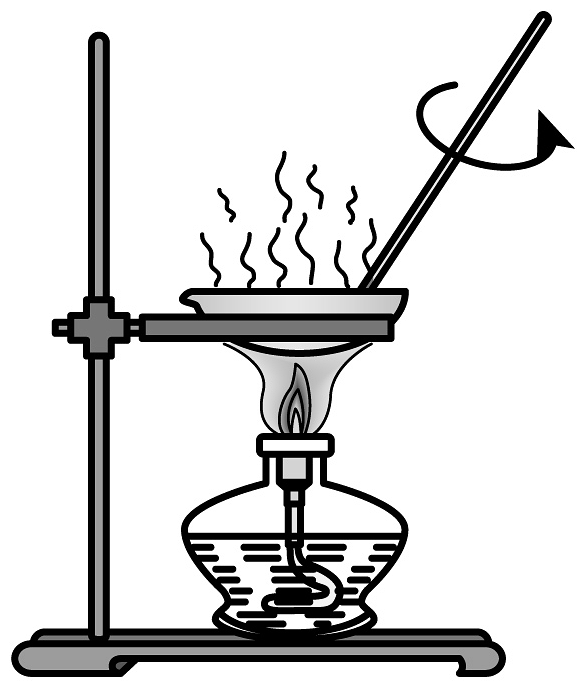
C.制备无水
D.除去固体中少量的
A、A B、B C、C D、D -
15、如下图所示的自催化反应,Y作催化剂。下列说法正确的是
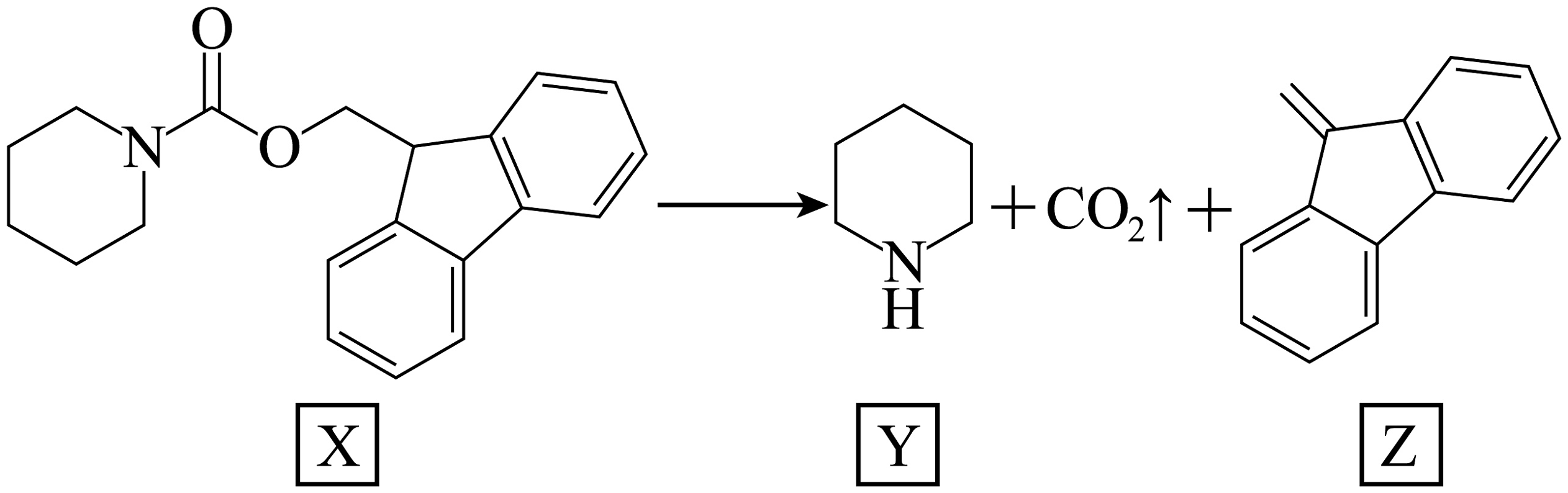 A、X能在碱性条件下水解生成 B、碱性:Y强于X C、Y中所有碳原子均共平面 D、随增大,该反应速率会一直增大
A、X能在碱性条件下水解生成 B、碱性:Y强于X C、Y中所有碳原子均共平面 D、随增大,该反应速率会一直增大 -
16、下列离子方程式正确的是A、硫化亚铁溶于稀硝酸中: B、氯乙酸乙酯在足量溶液中加热: C、少量通入苯酚钠溶液中:(已知:的 , 苯酚的) D、向溶液中滴加过量的硫酸:
-
17、下列有关物质的性质和用途不具有对应关系的是A、纤维素主链上的羟基可与硝酸发生反应,故可制备“无烟火药”硝化纤维 B、乙醇受热易挥发,故酿米酒需晾凉米饭后加酒曲 C、过氧碳酸钠具有较强氧化性,故可用漂白衣物 D、铝合金具有密度小、强度高、耐腐蚀等优越性质,可以做飞机外壳部件
-
18、设是阿伏加德罗常数的值,下列说法不正确的是A、羟胺中氧的价层电子对数为 B、和的固体混合物中含 , 则混合物中质子数为 C、中含阴离子个数为 D、由甘氨酸形成的三肽(相对分子质量:189)中的肽键数目为
-
19、关于实验室安全,下列说法不正确的是A、轻微烫伤或烧伤时,可用冷水处理,然后涂上烫伤膏即可 B、苯酚不慎沾到皮肤上,先用抹布擦拭,再用以上的水冲洗 C、探究钠与水的反应时需要注意:
 D、镁燃烧起火不可用泡沫灭火器灭火
D、镁燃烧起火不可用泡沫灭火器灭火
-
20、物质的结构决定物质的性质,下列说法正确的是A、相同浓度的和[Cu(NH3)4]2+氧化性:前者>后者 B、金刚石中碳碳键键长较短,键能和硬度很大,不容易因锤击而破碎 C、由于水分子间存在氢键,所以稳定性: D、甘油是粘稠液体是因为甘油分子间存在较强的范德华力