相关试卷
-
1、化学镀镍废水经分离处理后得到含磷废液(主要含)和含镍废液(主要含),分别通入如图所示电解装置的两极室回收磷、镍。已知:是一元中强酸;25℃时,的、、。电解过程中,下列说法不正确的是
 A、阳极的主要反应为 B、Ⅰ室溶液的pH逐渐增大,Ⅱ室溶液的pH逐渐减小 C、理论上,每生成1mol Ni,同时处理0.5mol D、理论上,电路中每转移1mol , Ⅲ室溶液质量减少65g
A、阳极的主要反应为 B、Ⅰ室溶液的pH逐渐增大,Ⅱ室溶液的pH逐渐减小 C、理论上,每生成1mol Ni,同时处理0.5mol D、理论上,电路中每转移1mol , Ⅲ室溶液质量减少65g -
2、四种燃煤烟气脱硫方法的原理如图,下列说法不正确的是
 A、方法1中,吸收前后的溶液中硫元素的化合价未发生改变 B、若烟气中还含有 , 采用方法2可实现同时脱硫脱硝 C、方法3中能循环利用的物质是NaOH D、方法4中与CO反应,氧化剂与还原剂的物质的量之比为2:1
A、方法1中,吸收前后的溶液中硫元素的化合价未发生改变 B、若烟气中还含有 , 采用方法2可实现同时脱硫脱硝 C、方法3中能循环利用的物质是NaOH D、方法4中与CO反应,氧化剂与还原剂的物质的量之比为2:1 -
3、水煤气变换反应是获取的重要方式之一,在不同催化剂作用下,其反应历程如图所示(*表示吸附态)。下列说法正确的是
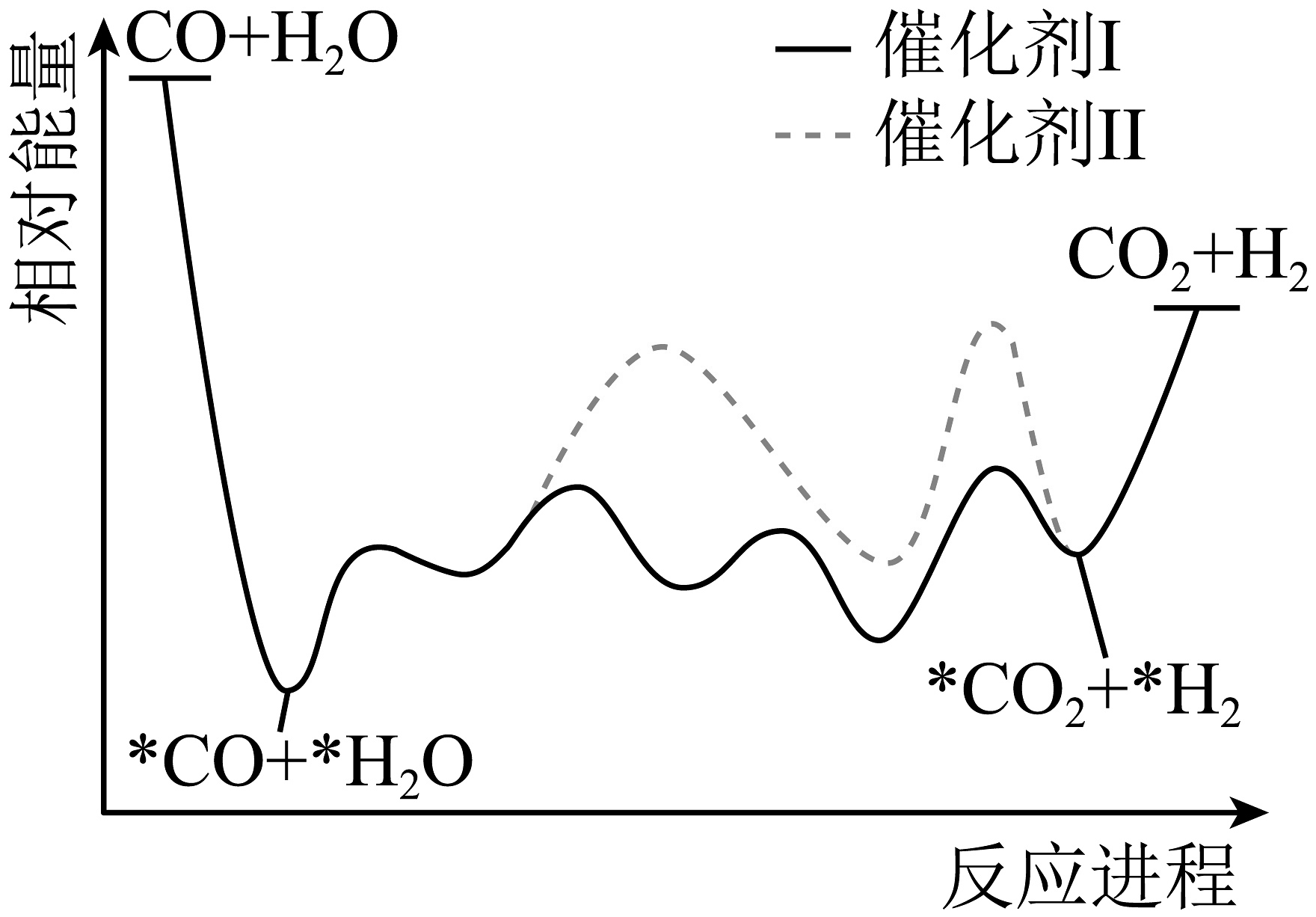 A、使用Ⅰ、Ⅱ,反应历程均分4步进行 B、反应达平衡时,增大压强,增大 C、使用Ⅰ时,反应体系更快达到平衡 D、Ⅰ、Ⅱ均能降低反应的焓变
A、使用Ⅰ、Ⅱ,反应历程均分4步进行 B、反应达平衡时,增大压强,增大 C、使用Ⅰ时,反应体系更快达到平衡 D、Ⅰ、Ⅱ均能降低反应的焓变 -
4、化合物可作催化剂,所含的5种主族元素在每个短周期均有分布,W与Z同族,X、W、Y同周期且原子序数依次递增。X与W的基态原子未成对电子数相同,W的基态原子p能级电子数与s能级电子数相等。下列说法正确的是A、第一电离能:W>Y B、最高价氧化物的水化物的酸性:X>Z C、简单氢化物的沸点:Z>W D、和的VSEPR模型均为四面体形
-
5、实验室利用如图所示装置模拟氨的催化氧化实验。用酒精灯预热催化剂至红热后,移开酒精灯并向试管中注入浓氨水;一段时间后,烧瓶中有红棕色气体产生,再向烧瓶中注入浓氨水,烧瓶中有白烟产生。下列说法正确的是
 A、每消耗0.1mol 生成0.1mol B、催化剂持续红热,说明氨的催化氧化反应为吸热反应 C、烧瓶中有红棕色气体产生,说明被直接氧化为 D、烧瓶中所产生的白烟的主要成分为
A、每消耗0.1mol 生成0.1mol B、催化剂持续红热,说明氨的催化氧化反应为吸热反应 C、烧瓶中有红棕色气体产生,说明被直接氧化为 D、烧瓶中所产生的白烟的主要成分为 -
6、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
当镀层破损时,马口铁(镀锡钢板)比白铁皮(镀锌钢板)更难被腐蚀
用牺牲阳极法防止金属腐蚀
B
冠醚可用于识别碱金属离子
不同空穴大小的冠醚可与不同的碱金属离子形成超分子
C
酸性:
烷基是推电子基团,烷基越长推电子效应越小
D
向溴乙烷水解后的上层溶液中,滴入几滴溶液,有淡黄色沉淀生成
溴乙烷中存在溴离子
A、A B、B C、C D、D -
7、设为阿伏加德罗常数的值。下列说法正确的是A、22.4L乙炔中含有σ键的数目为3 B、1L 1.5 溶液中的数目为1.5 C、46g 和的混合气体含有的原子数目为3 D、溶液与溶液反应生成1mol S,转移电子数目为2
-
8、锂-氟化碳()电池具有优异的性能。该电池的总反应为 , 电池工作时,下列说法正确的是A、锂电极为正极 B、电子由Li电极经导线流向电极 C、负极反应为 D、将电能转化为化学能
-
9、白木香醛(如图)是沉香精油的主要成分之一。下列关于该化合物的说法不正确的是
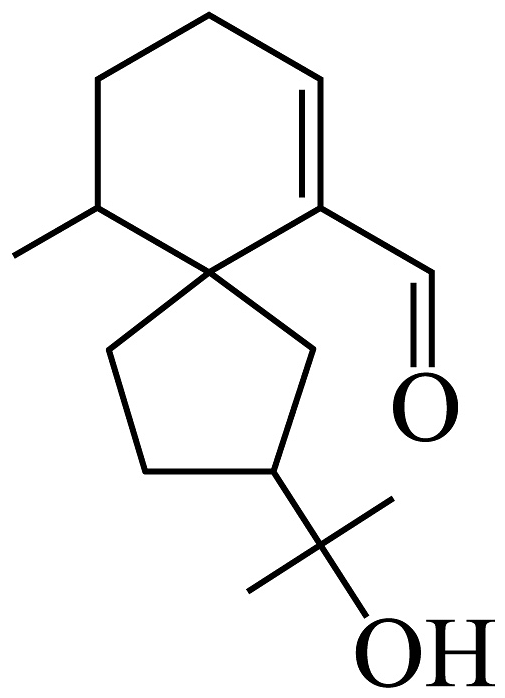 A、能发生银镜反应 B、能使溴的四氯化碳溶液褪色 C、其结构中两个碳环一定共平面 D、1mol该化合物与足量Na反应可产生0.5mol
A、能发生银镜反应 B、能使溴的四氯化碳溶液褪色 C、其结构中两个碳环一定共平面 D、1mol该化合物与足量Na反应可产生0.5mol -
10、为达到相应实验目的,下图所示实验装置不合理的是
 A、图甲:分离正己烷(沸点69℃)和正庚烷(沸点98℃) B、图乙:提纯粗苯甲酸时,趁热过滤去除不溶物 C、图丙:完成乙酸乙酯制备后,分离有机相和水相 D、图丁:用盐酸标准液滴定未知浓度的NaOH溶液
A、图甲:分离正己烷(沸点69℃)和正庚烷(沸点98℃) B、图乙:提纯粗苯甲酸时,趁热过滤去除不溶物 C、图丙:完成乙酸乙酯制备后,分离有机相和水相 D、图丁:用盐酸标准液滴定未知浓度的NaOH溶液 -
11、下列化学方程式或离子方程式书写正确的是A、溶液与NaOH溶液反应: B、高温下Fe与反应: C、与冷的石灰乳反应: D、铜丝与热的浓硫酸反应:
-
12、劳动创造价值。下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
化学实验员:用化学沉淀法去除粗盐溶液中的
B
水厂净水工:使用去除水中的细小悬浮物
是电解质
C
材料分析员:通过X射线衍射实验区分石英玻璃和水晶
石英玻璃是非晶体,水晶是晶体
D
肥皂生产工:利用油脂和烧碱制肥皂
油脂在碱性条件下水解
A、A B、B C、C D、D -
13、实验室中利用如图所示装置进行的相关实验,其中,能够达到预期目的的是


A.制备
B.除杂


C.验证与的反应
D.验证能否与水反应
A、A B、B C、C D、D -
14、服装材料的演变反映了人类文明的进步。下列说法不正确的是A、兽皮制表:用骨针缝制时主要发生物理变化 B、蚕丝纺衣:蚕丝中的蛋白质受热后易发生变性 C、棉花织衣:棉花中的纤维素属于多糖 D、纤维成衣:合成聚氯乙烯纤维的反应属于缩聚反应
-
15、“北斗巡天”“脑机融通”等彰显了我国科技发展的巨大成就。下列说法正确的是A、北斗技术助力生产:卫星外壳中合金的硬度比其成分金属的大 B、人工智能服务生活:人工智能芯片的主要成分为 C、脑机接口融入医疗:植入式电极中的石墨烯属于烯烃 D、多箭齐发探索宇宙:火箭发动机使用的煤油属于可再生能源
-
16、古代的计量器具是劳动人民智慧的结晶。下列计量器具中,主要材质为金属的是


A.称量质量的铜秤砣
B.测量容积的陶量


C.测量长度的木尺
D.计算数目的竹算筹
A、A B、B C、C D、D -
17、硫氰化物是重要的分析试剂和合成中间体。(1)、基态的价电子轨道表示式为。(2)、配制溶液时,常将晶体溶于较浓的盐酸中,再加水稀释到所需浓度,其目的是。(3)、向10mL 0.005溶液中加入10mL 0.015KSCN溶液,反应达平衡后,得到红色溶液M。
①取红色溶液M,分别对其进行如下操作,相关描述正确的有(填标号)。
A.加入少量铁粉,溶液红色变浅
B.加入少量水,溶液中离子总数减小
C.加入几滴1KSCN溶液,溶液红色变深
D.加入几滴0.05 溶液,的值减小
②取红色溶液M,向其中滴加饱和溶液,体系中主要存在以下平衡:
Ⅰ:
Ⅱ:
Ⅲ:
平衡总浓度随滴入饱和溶液滴数的变化曲线如图(忽略溶液体积变化)。
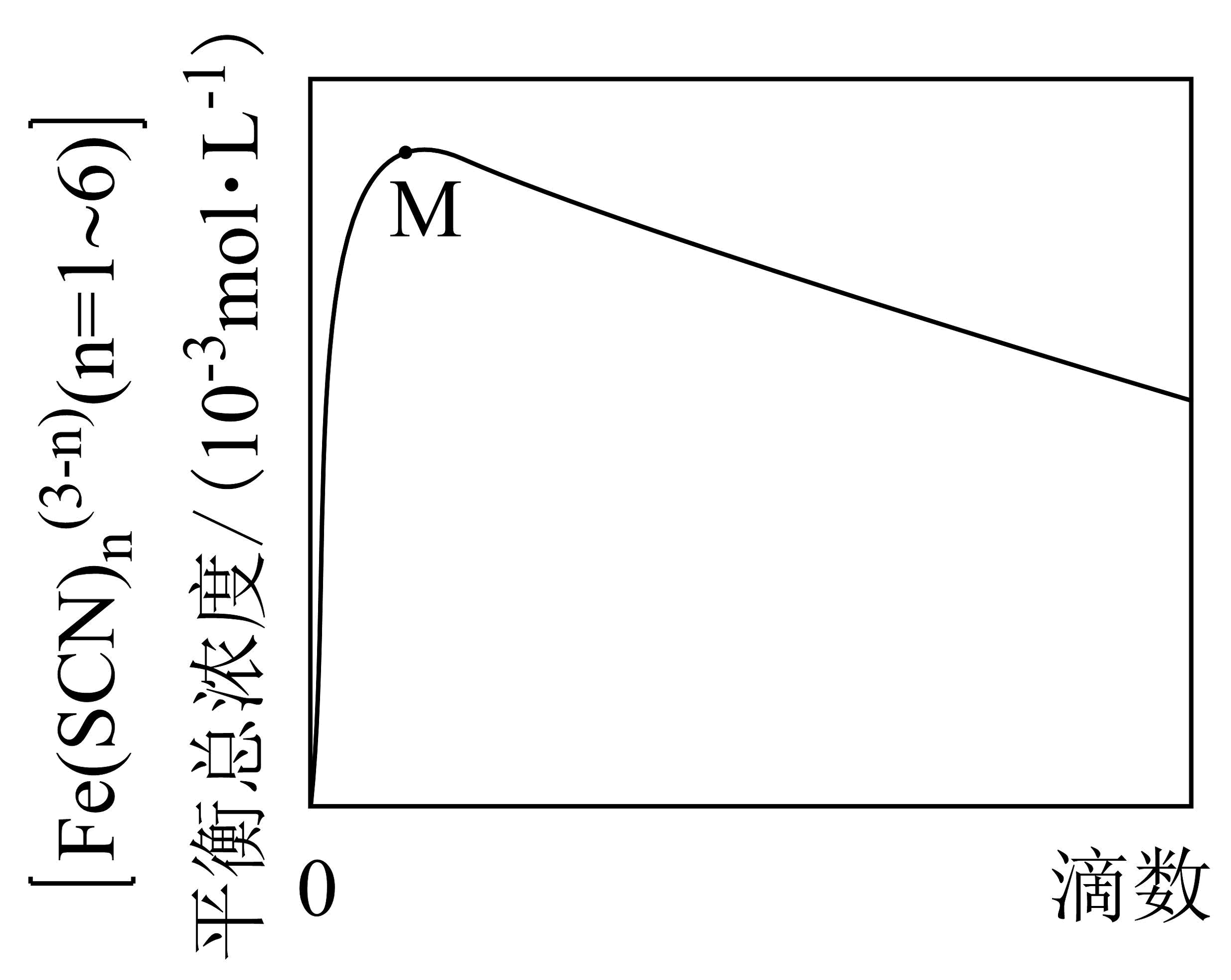
ⅰ.M点前,(填“Ⅰ”“Ⅱ”或“Ⅲ”)的平衡移动,是导致曲线上升的主要原因。
ⅱ.运用平衡移动原理,分析M点后曲线下降的主要原因:。
(4)、某浸金废水中含0.5 , 在相同条件下研究催化剂a、b对该废水中氧化处理过程的影响(氧化处理过程中溶液体积保持不变),的残留率随时间t的变化曲线如图: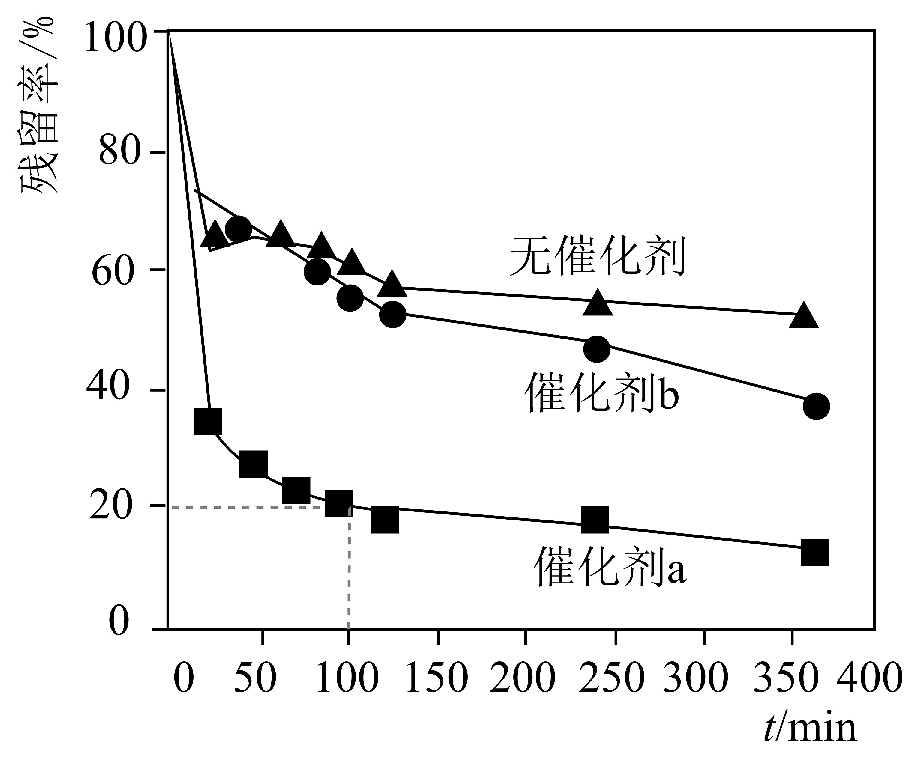
①使用(填“催化剂a”或“催化剂b”)时,的氧化反应活化能更低。
②使用催化剂a时,0~100 min内,的平均反应速率。
(5)、TBP(磷酸三丁酯)难溶于水,对水溶液中HSCN有萃取作用,主要存在的萃取平衡为(o代表有机相)。分别向pH不同的的水溶液中,加入等体积0.2TBP的有机溶液进行萃取(有机溶剂不参与平衡)。、随平衡体系pH的变化如图(分配比D为萃取达平衡时,被萃物在有机相和水相的浓度之比;分析该体系时,需考虑被萃物在水相中的所有存在形式)。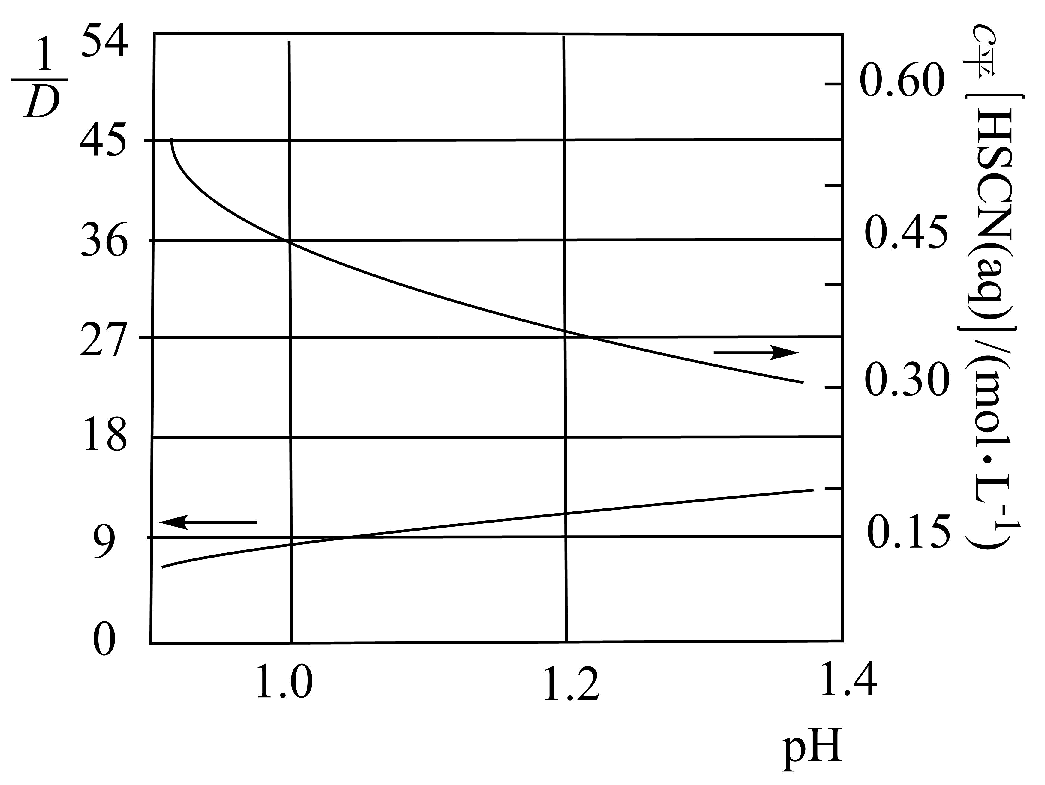
计算上述萃取平衡的平衡常数K=(写出计算过程,保留三位有效数字)。
-
18、利用多膜装置通过电解法可以制备 , 同时获得一定的副产品,其电解装置如图所示。下列说法正确的是
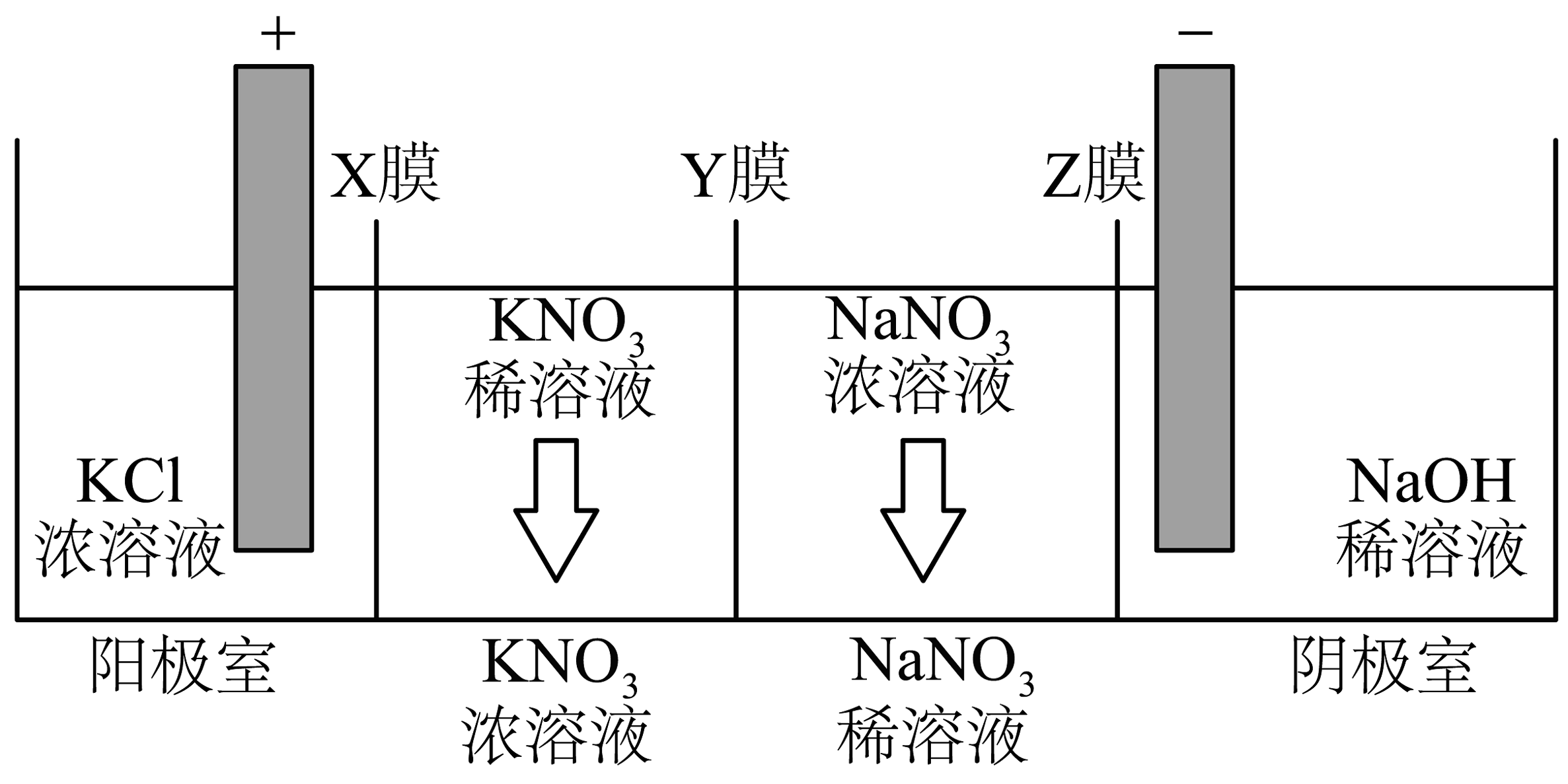 A、Y膜为阳离子交换膜 B、阴极室溶液中浓度逐渐降低 C、理论上每生成标准状况下 , 阳极室内溶液质量减少 D、理论上每生成 , 阴极室溶液质量增加
A、Y膜为阳离子交换膜 B、阴极室溶液中浓度逐渐降低 C、理论上每生成标准状况下 , 阳极室内溶液质量减少 D、理论上每生成 , 阴极室溶液质量增加 -
19、一种杀菌剂的结构式如图所示,元素X、Y、Z、W、T、Q原子序数依次增大且在前四周期均有分布,Y、Z、W在同一周期,和在同一主族,的价层电子排布式为 , 下列说法正确的是
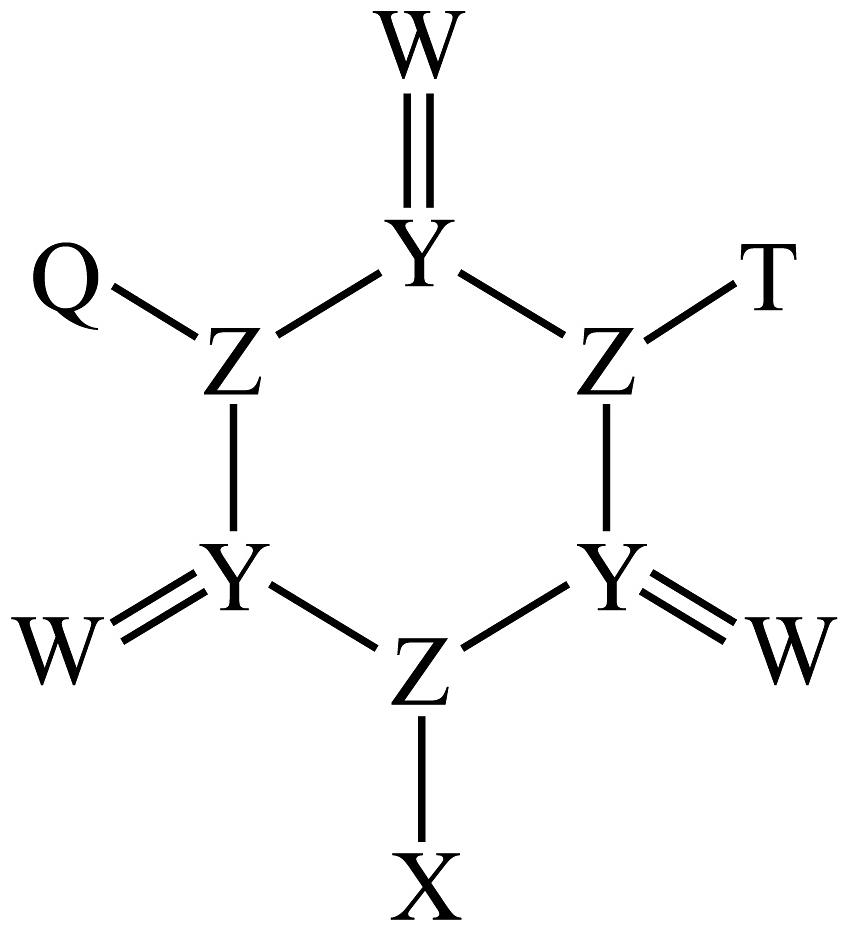 A、的空间结构为平面三角形 B、元素的电负性大小: C、元素的第一电离能: D、最高价氧化物的水化物的酸性:
A、的空间结构为平面三角形 B、元素的电负性大小: C、元素的第一电离能: D、最高价氧化物的水化物的酸性: -
20、下列陈述I、II均正确且存在因果关系的是
选项
陈述I
陈述II
A
酸性:
吸电子效应:
B
金属钠具有强还原性
钠可置换出溶液中的铁单质
C
次氯酸具有漂白性
漂白液在空气中久置易变质
D
往氯乙烷中加入浓溶液后共热,冷却后加入少量溶液,有白色沉淀生成
可证明氯乙烷中含有氯原子
A、A B、B C、C D、D