相关试卷
-
1、二氯二茂钛(M=249g/mol)为红色片状晶体,溶于水和极性溶剂,性质较稳定;其对烯烃聚合具有很高的催化活性,以下是合成二氯二茂钛的一种方法,具体流程如下:

实验制备装置(夹持、加热、水浴装置已省略)如图所示:


步骤Ⅰ:钠砂的制备。在装置(如图一)中加入二甲苯和小块金属钠,加热并搅拌至钠分散成砂粒状。抽出二甲苯,加入溶剂四氢呋喃(THF)。
步骤Ⅱ:将冷凝管换成恒压滴液漏斗(如图二)。边搅拌边加入含环戊二烯的混合液。搅拌2小时后,将制得的深红色的溶液转移到另一滴液漏斗中。
步骤Ⅲ:另取一个三颈烧瓶加入一定量的TiCl4和四氢呋喃,将上述深红色溶液加入三颈烧瓶中,滴毕后室温搅拌1h,静置,抽干溶剂得到粗品。
步骤Ⅳ:用索氏提取器提取产品(如图三)
已知:①环戊二烯存在:


②环戊二烯钠对水和氧气敏感。
请回答:
(1)、步骤Ⅰ将钠制成钠砂的目的是;步骤Ⅱ中环戊二烯在使用前需加热蒸馏,收集42-45℃馏分备用,其目的是。(2)、合成过程为放热反应,步骤Ⅲ需要控制反应速率,可采取的措施有(写2点)。(3)、下列说法不正确的是___________。A、步骤Ⅰ中,溶剂二甲苯、四氢呋喃均需要进行脱水处理 B、步骤Ⅱ中,在通风橱中将未反应的钠过滤除去,将滤液转移到分液漏斗中 C、步骤Ⅲ中,产品二氯二茂钛性质较稳定,故不需要通入N2进行保护 D、步骤Ⅳ中,索氏提取器的优点是可以连续萃取,提高产品的浸取率。(4)、步骤Ⅳ,请从下列选项中选出合理的操作并排序:将产品装入滤纸套筒中→→冷却,过滤得到产品
a.在圆底烧瓶中加入一定量的CCl4
b.在圆底烧瓶中加入一定量的氯仿
c.加热回流
d.打开冷凝水
e.当滤纸套筒中提取液颜色变浅时,停止加热
f.当滤纸套筒中提取液颜色呈深红色时,停止加热
(5)、产品纯度的测定:称取待测样品0.2500g置于烧杯内,加入NaOH溶液,加热至全部样品转化成白色沉淀为止。冷却后加一滴酚酞,溶液变红,再加HNO3至红色恰好褪去,再加入K2CrO4作指示剂,用0.1000mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液20.00mL。
已知:Ksp(AgCl)=1.8×10-10 , Ksp(Ag2CrO4)=1.1×10-12 , Ag2CrO4为砖红色沉淀。
①滴定终点现象为。
②计算得到二氯二茂钛的纯度为。
-
2、甲醇(CH3OH)、甲酸甲酯(HCOOCH3)均是用途广泛的化工原料。请回答:(1)、二氧化碳加氢制甲醇的总反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),一般认为该反应分为两步,体系能量-反应进程如图所示:
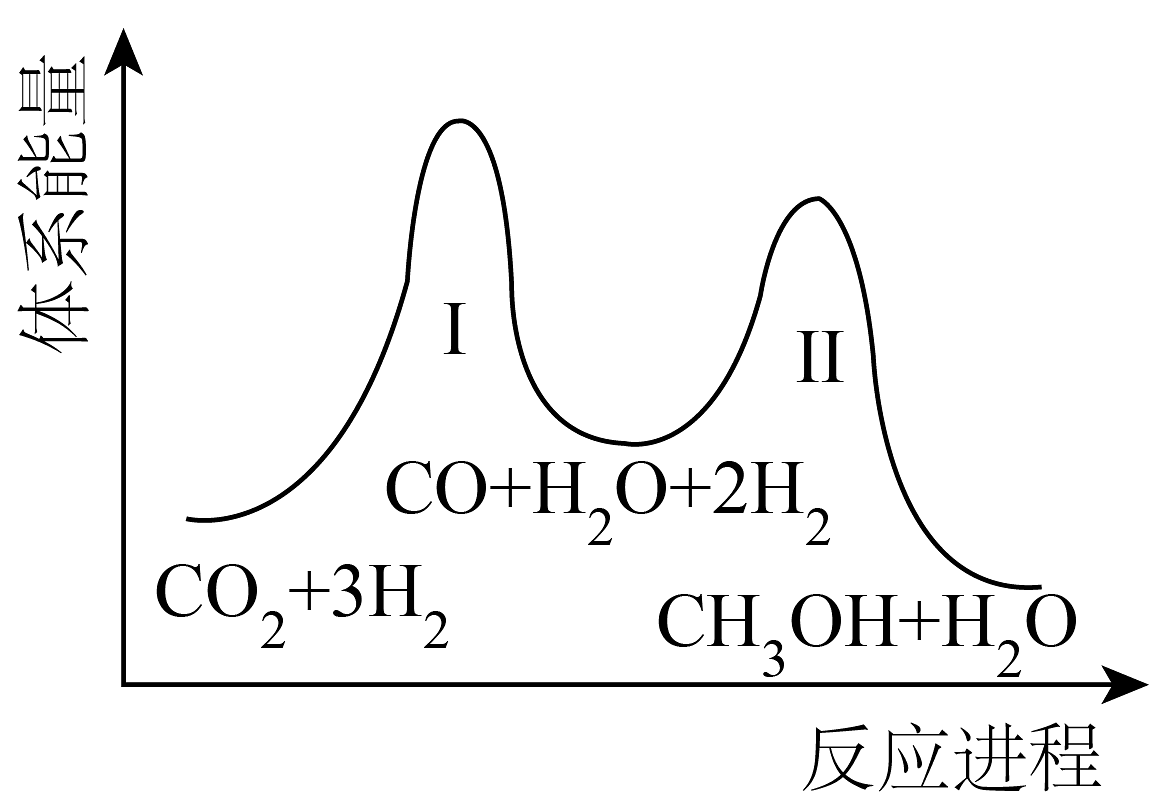
①一定条件下,反应Ⅰ能自发进行,则反应Ⅰ在该条件下的ΔS0(填“>”、“<”或“=”)。
②下列说法不正确的是。
A.反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
B.上述反应建立平衡后,移走CH3OH,反应Ⅰ、Ⅱ平衡均右移
C.适当升温有利于提高一定时间内反应的速率和产率
D.催化剂能提高甲醇的平衡转化率
(2)、通过电解含有甲醇的NaOH溶液可用于制备甲酸盐,生成甲酸盐的电极反应式为。(3)、已知HCOONa的Kh=5.6×10-9 , 若电解一段时间后所得HCOONa溶液的浓度为1.8mol/L,则将HCOONa溶液完全转化为HCOOH溶液需调节溶液中H+浓度约为 , 所得甲酸溶液进一步处理后可用于制备甲酸甲酯。(4)、甲醇催化氧化也可用于制备甲酸甲酯,其工艺过程包含以下反应:Ⅲ:2CH3OH(g)+O2(g)⇌HCOOCH3(g)+2H2O(g) ΔH=+51.2kJ•mol-1
Ⅳ:HCOOCH3(g)⇌2CO(g)+2H2(g) ΔH=+129.1kJ•mol-1
已知:CH3OH和O2在催化剂表面的反应过程如下(M*表示催化剂表面的吸附物种,部分产物已省略)
a.氧在催化剂表面活化:O2→2O*
b.甲醇的化学吸附:CH3OH+O*→CH3O*
c.生成弱吸附的甲醛:CH3O*+O*→HCHO*
d.生成甲酸甲酯并脱附:HCHO*+CH3O*→HCOOCH3
①步骤b是HCOOCH3合成决速步骤,在相同的温度和压强下,以一定的流速通过不同的催化剂表面,反应相同时间,测得实验数据如下:
T(K)
催化剂
甲醇氧化为甲醛的转化率
甲酸甲酯的选择性
353
Au@SiO2
40%
98%
353
Auδ+@SiO2
85%
100%
研究表明在金离子存在的条件下,甲酸甲酯的产率明显提高,可能原因是。
②实际工业生产中,采用的温度约为353K,温度不能太高的理由是(不考虑催化剂活性降低活失活)。
-
3、卤族元素在生产生活中扮演中着重要的角色。(1)、关于VIIA族元素的描述,下列说法正确的是___________。A、基态Br原子的核外电子排布式为[Ar]4s24p3 , 其价层电子数等于最外层电子数 B、键能:HF>HCl>HBr>HI,导致酸性:HF<HCl<HBr<HI C、根据VSEPR模型,可推测OF2和I空间构型均为V形 D、已知AlCl3为分子晶体,则可推测沸点:AlI3>AlBr3>AlCl3(2)、某配位化合物的晶胞及其在xy平面的投影如图所示。晶体中存在独立的阴阳离子,晶胞参数分别为apm,apm,cpm,a=β=γ=90°。
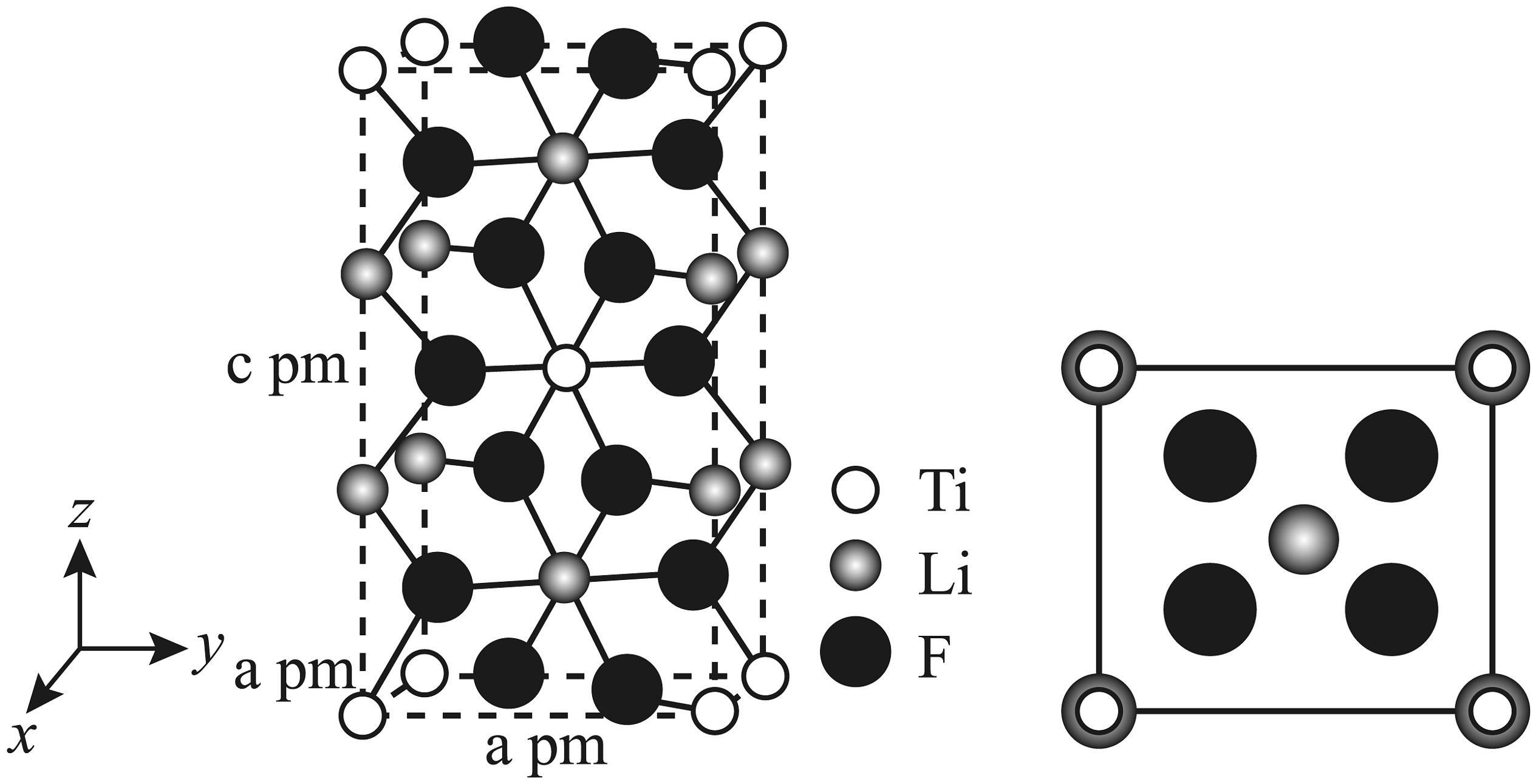
①该化合物中配离子为。
②计算该晶体的密度g/cm3(列出计算表达式)。
(3)、以生产感光材料的过程中生产中产生的含AgBr的废液为原料,制备单质银的一种工艺流程如下图所示: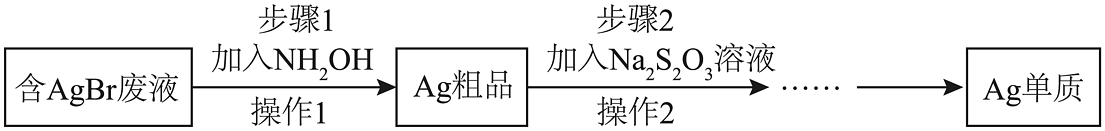
已知:Ag+可与S2O结合生成稳定的[Ag(S2O3)2]3-。
①已知NH2OH与NH3类似,具有碱性,请写出其水溶液中主要存在的阳离子。
②步骤1中,有无毒无害的气体单质,请写出步骤1中AgBr与NH2OH反应的化学方程式是。
③操作1、操作2均为 , 步骤2中,加入稍过量的Na2S2O3溶液的目的是 , 若省去操作1,直接加入Na2S2O3溶液,缺点是。
(4)、(CN)2、(SCN)2等物质具有与卤素单质类似的性质,称为拟卤素,其对应的CN-、SCN-称之为拟卤离子,已知氧化性:I2>(CN)2.①(SCN)2为链状结构,分子中每个原子均满足8e- , 请写出(SCN)2的电子式。
②CN-能与Ag+形成稳定的无色离子[Ag(CN)2]- , 但在CuSO4溶液中加入NaCN溶液,却生成气体和白色难溶盐沉淀,请写出相应的离子方程式。
-
4、三氯乙醛(CCl3CHO)是无色油状液体,常用于制取农药。其纯度的测定如下(杂质不参与反应)。已知:I2+2S2O=2I-+S4O , 下列说法不正确的是
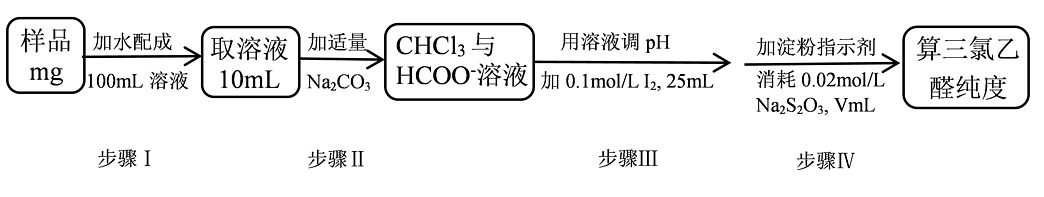 A、步骤Ⅰ,需用100mL容量瓶进行配制 B、步骤Ⅲ,发生的反应为:HCOO-+I2+2OH-=2I-+CO+H2O+H+ C、步骤Ⅳ,滴定终点的现象为:加入最后半滴Na2S2O3溶液,锥形瓶中溶液蓝色恰好褪去,且半分钟内不变色 D、三氯乙醛(摩尔质量为Mg·mol-1)的纯度为
A、步骤Ⅰ,需用100mL容量瓶进行配制 B、步骤Ⅲ,发生的反应为:HCOO-+I2+2OH-=2I-+CO+H2O+H+ C、步骤Ⅳ,滴定终点的现象为:加入最后半滴Na2S2O3溶液,锥形瓶中溶液蓝色恰好褪去,且半分钟内不变色 D、三氯乙醛(摩尔质量为Mg·mol-1)的纯度为 -
5、25℃,向10mL浓度均为0.1mol/L的Na2CO3和NaHCO3混合溶液中,逐滴加入0.1mol/L的MgCl2溶液。H2CO3的电离常数Ka1=4.5×10-7 , Ka2=4.7×10-11;Ksp(MgCO3)=4×10-6。下列有关说法正确的是A、25℃时,MgCO3饱和溶液中,含碳微粒最主要以HCO形式存在 B、25℃时,0.1mol MgCO3固体不可全部溶于1L 0.2mol/L的盐酸中 C、加入10mL的MgCl2溶液后,溶液中存在c(Na+)=c(CO)+c(HCO)+c(H2CO3) D、将上述MgCl2溶液加入到0.1mol/LNaHCO3溶液中无明显现象
-
6、COX2、POX3的水解(取代)机理不同(X表示卤原子),具体过程如图所示。下列说法不正确的是
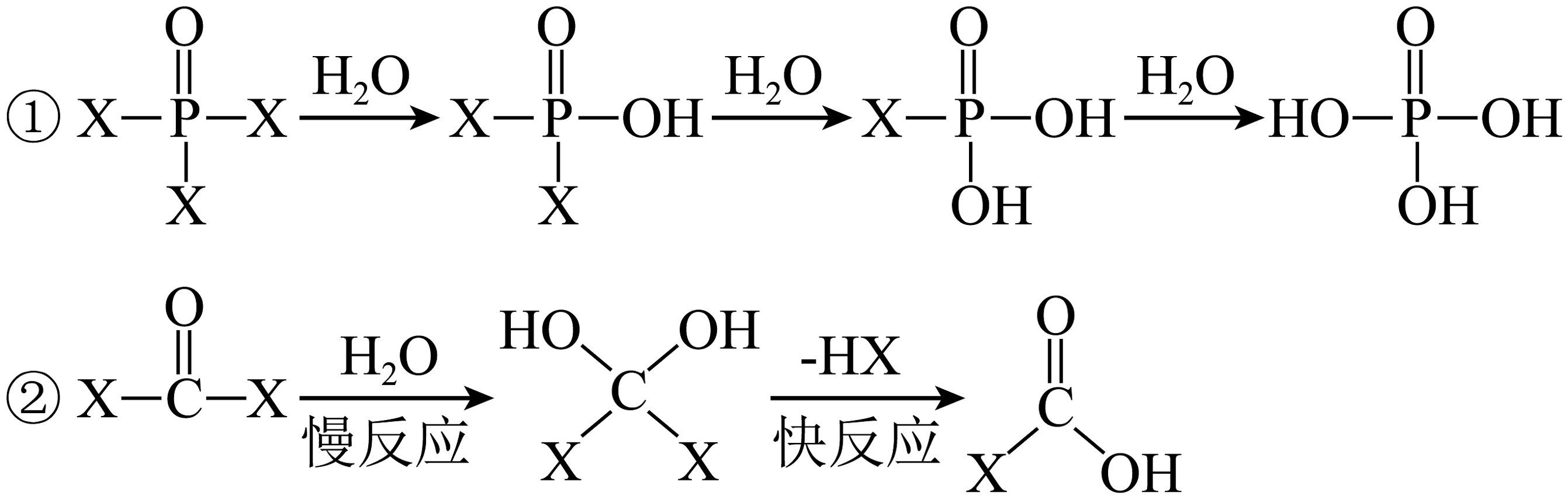 A、POX3在NaOH溶液中彻底水解后可形成两种盐(不考虑阴离子的水解) B、由于键能C-Br<C-Cl,故COBr2的水解速率大于COCl2 C、COX2与POX3的中心原子分别为sp2和sp3杂化 D、COX2水解过程先发生加成反应再发生消去反应
A、POX3在NaOH溶液中彻底水解后可形成两种盐(不考虑阴离子的水解) B、由于键能C-Br<C-Cl,故COBr2的水解速率大于COCl2 C、COX2与POX3的中心原子分别为sp2和sp3杂化 D、COX2水解过程先发生加成反应再发生消去反应 -
7、某化合物M的晶胞如图,下列说法不正确的是
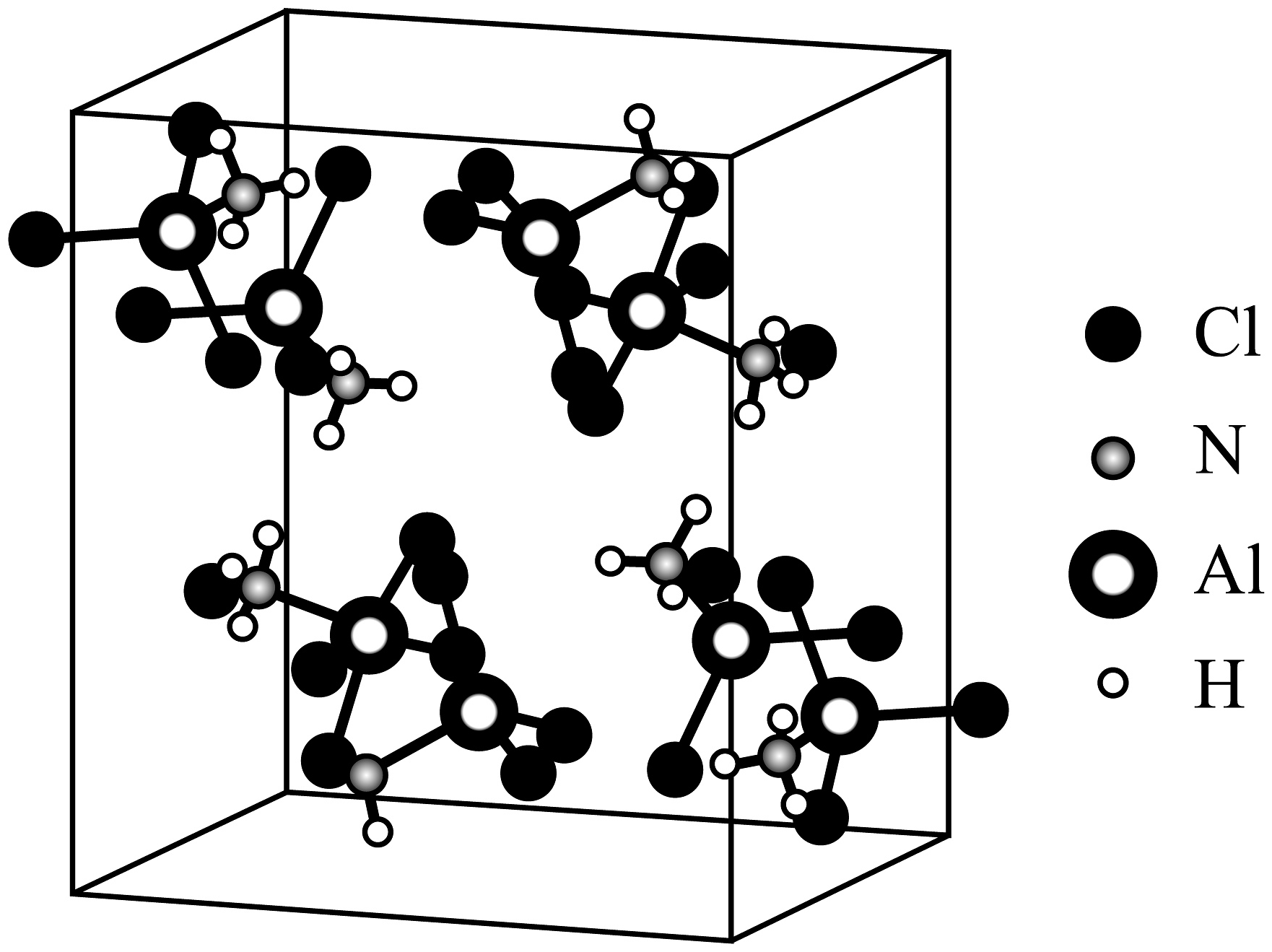 A、该化合物化学式为Al(NH3)Cl3 , 属于分子晶体 B、NH3与Al之间的作用力为配位键 C、该化合物不稳定,受热易分解 D、∠Cl-Al-Cl键角比较:Al(NH3)Cl3>AlCl3
A、该化合物化学式为Al(NH3)Cl3 , 属于分子晶体 B、NH3与Al之间的作用力为配位键 C、该化合物不稳定,受热易分解 D、∠Cl-Al-Cl键角比较:Al(NH3)Cl3>AlCl3 -
8、RbAg4I5是一种只传导Ag+的固体电解质,利用RbAg4I5可以制成电化学气敏传感器。某种测定O2含量的气体传感器如图所示,被分析的O2可以透过聚四氟乙烯薄膜,发生反应:4AlI3+3O2=2Al2O3+6I2 , I2进一步在石墨电极上发生反应,引起电池电动势变化,从而测定O2的含量。下列关于气体传感器工作原理说法不正确的是
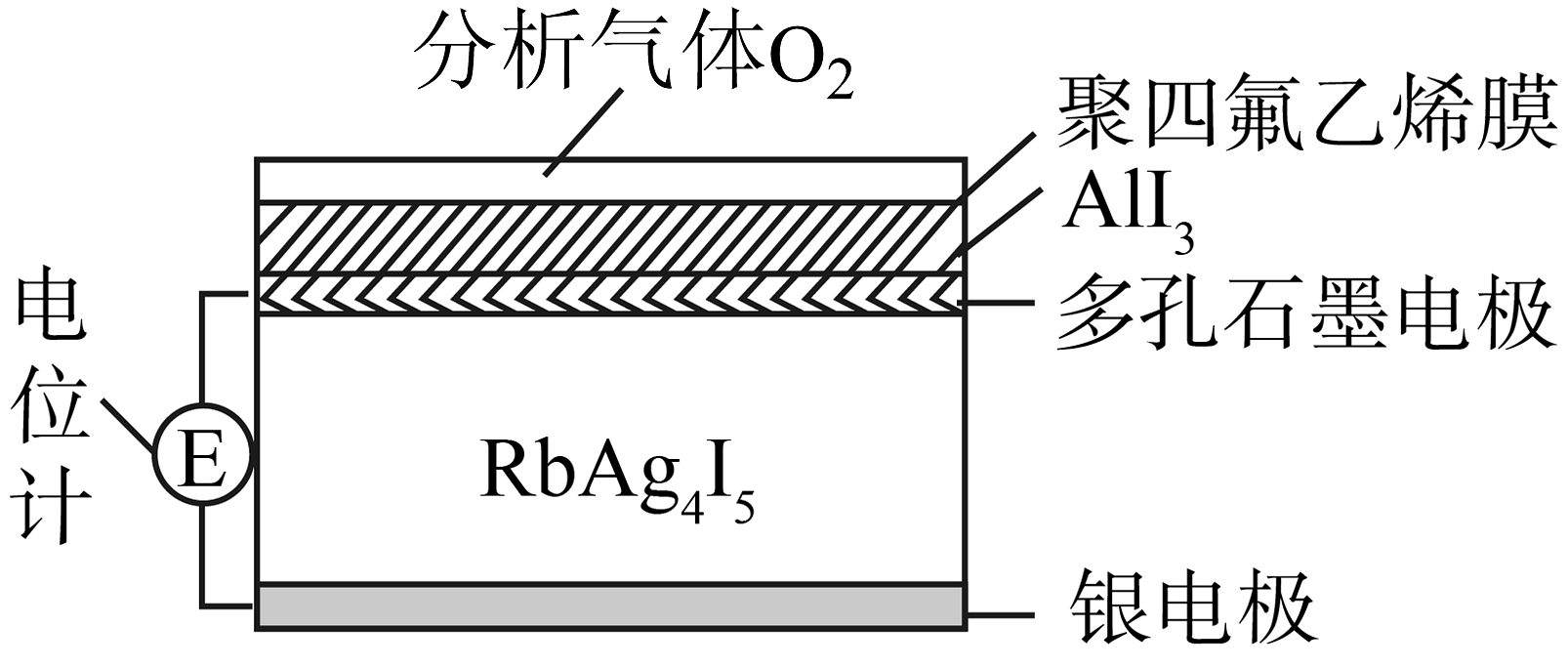 A、Ag+通过固体电解质迁向正极 B、银电极的电极反应式为:Ag-e-=Ag+ C、测定一段时间后,固体电解质中Ag+减少 D、当O2浓度大时,电动势变大
A、Ag+通过固体电解质迁向正极 B、银电极的电极反应式为:Ag-e-=Ag+ C、测定一段时间后,固体电解质中Ag+减少 D、当O2浓度大时,电动势变大 -
9、下列说法正确的是A、已知NaOH固体溶于水是一个自发过程,其ΔH<0,可推测该过程ΔS>0 B、2SO2(g)+O2(g)⇌2SO3(g),压缩容器体积,平衡正移,则反应的平衡常数减小 C、已知HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,可推测温度越高,HF(aq)中HF的电离程度越大 D、已知HX(g)=H(g)+X(g) ΔH>0,HX(aq)=H+(aq)+X+(aq) ΔH<0,则H(g)+X(g)=H+(aq)+X−(aq) ΔH<0
-
10、AlCl3是一种用途广泛的化工原料,某兴趣小组欲从饱和AlCl3溶液中获取AlCl3·6H2O,相关装置如图所示,下列说法不正确的是
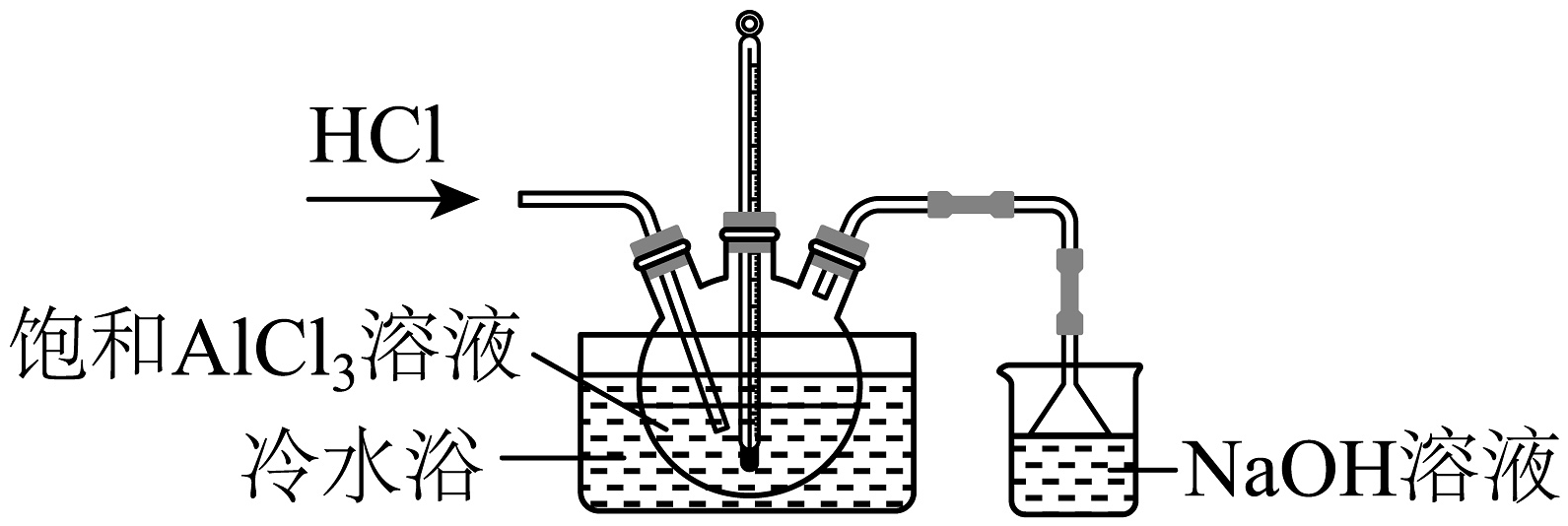
已知:AlCl3·6H2O易溶于水、乙醇及乙醚
A、通入HCl可以抑制AlCl3水解并促使AlCl3·6H2O晶体析出 B、经过滤→冷水洗涤2~3次→低温干燥可以获取AlCl3·6H2O晶体 C、倒扣小漏斗的作用是防止NaOH溶液倒吸 D、AlCl3·6H2O在干燥HCl氛围中加热脱水可以制备无水AlCl3 -
11、科学家将阿司匹林分子结构进行修饰连接,得到的缓释阿司匹林(M)可作为抗血栓长效药,M结构如下。下列说法不正确的是
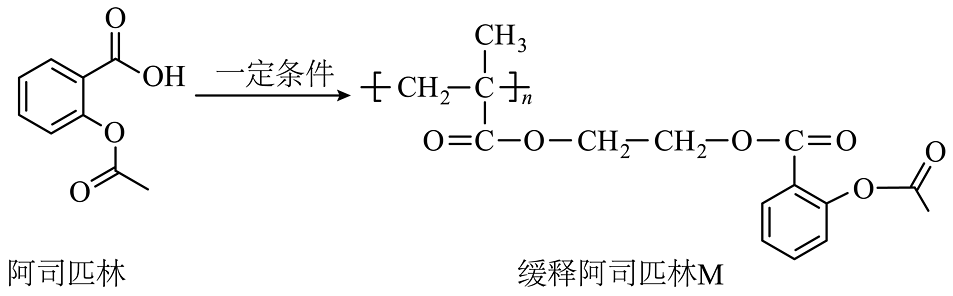 A、可用氯化铁来检验阿司匹林中是否含有水杨酸 B、1mol M彻底水解最多消耗4nmol的NaOH C、阿司匹林最多有9个碳原子共平面 D、M可由甲基丙烯酸、乙二醇、乙酰水杨酸通过缩聚反应生成
A、可用氯化铁来检验阿司匹林中是否含有水杨酸 B、1mol M彻底水解最多消耗4nmol的NaOH C、阿司匹林最多有9个碳原子共平面 D、M可由甲基丙烯酸、乙二醇、乙酰水杨酸通过缩聚反应生成 -
12、下列离子方程式不正确的是A、NaClO溶液中通入少量的CO2:ClO-+CO2+H2O=HCO+HClO B、SO2通入I2水溶液中:SO2+I2+2H2O=2H++SO+2HI C、一元弱酸H3BO3电离方程:H3BO3+H2O[B(OH)4]-+H+ D、两性物质氢氧化铍溶于强碱:Be(OH)2+2OH-=[Be(OH)4]2-
-
13、X、Y、Z、W是原子序数依次增大的前20号元素,常温下只有一种元素的单质为气态,基态X原子s轨道上的电子数是p轨道上的2倍,Y的简单氢化物与其最高价含氧酸反应会产生白烟,Z与X形成的某种化合物常温下为液体,基态W原子有1个未成对电子。下列说法不正确的是A、电负性:Y>Z>W B、原子半径:W>Z>X>Y C、氢化物的沸点:Y>Z>X D、上述4种元素形成的某种化合物的溶液可用于检测Fe3+
-
14、三氯硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,是强还原剂且易水解。实验室通过反应Si(s)+3HCl(g)SiHCl3(l)+H2(g)制备SiHCl3 , 已知电负性:Cl>H>Si.下列说法正确的是A、生成1mol H2 , 转移的电子数为2mol B、氧化剂和还原剂的物质的量之比为3:1 C、SiHCl3在足量NaOH溶液中反应生成Na2SiO3、NaCl和H2O D、上述生成SiHCl3的反应为吸热反应,则该反应需在高温条件下自发进行
-
15、关于物质性质及应用,下列说法正确的是A、利用浓硫酸的吸水性,可除去HCl中的水蒸气 B、漂白粉进行漂白时可加入浓盐酸,增强其漂白效果 C、铁比铜活泼,故电子工业中常用Fe与含Cu2+的溶液反应来蚀刻电路板 D、工业上常将热空气吹出的溴蒸汽用Na2CO3溶液吸收,利用了Br2的挥发性和强氧化性
-
16、下列实验装置使用正确的是
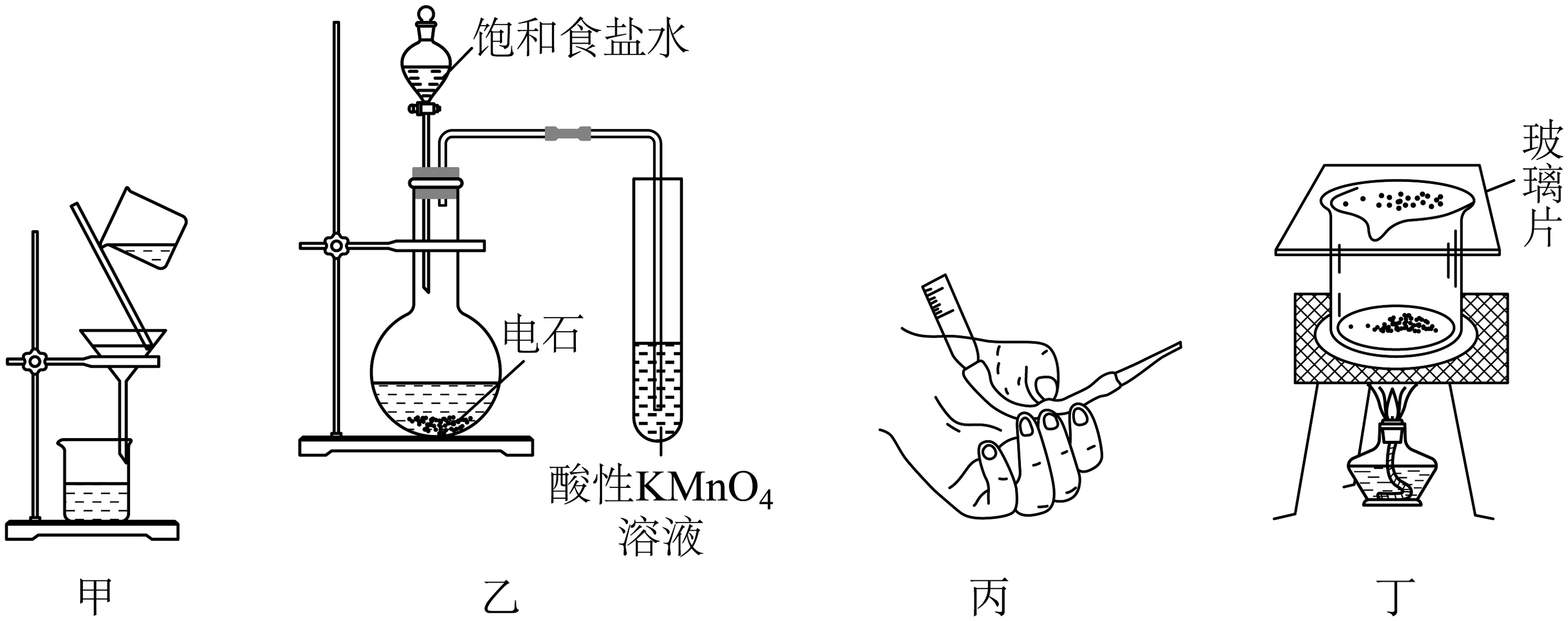 A、图甲装置用于趁热过滤出苯甲酸溶液中的难溶性杂质 B、图乙装置用于验证乙炔的还原性 C、图丙装置用于排出盛有KMnO4溶液的滴定管尖嘴处的气泡 D、图丁装置用于碘晶体(含NH4Cl)的提纯
A、图甲装置用于趁热过滤出苯甲酸溶液中的难溶性杂质 B、图乙装置用于验证乙炔的还原性 C、图丙装置用于排出盛有KMnO4溶液的滴定管尖嘴处的气泡 D、图丁装置用于碘晶体(含NH4Cl)的提纯 -
17、化学与人类社会可持续发展息息相关。下列说法不正确的是A、在质地较软的铝中加入合金元素,可以改变铝原子的排列结构,使其成为硬铝 B、煤的气化是通过化学变化将煤转化为可燃性气体的过程 C、纳米晶体是颗粒尺寸在纳米量级的晶体,其熔点随晶粒大小的减小而降低 D、等离子体是一种特殊的液体,由带电的阳离子、电子及电中性粒子的组成
-
18、下列表示不正确的是A、As原子的简化电子排布式:[Ar]3d104s24p3 B、SO的空间结构为:
 (四面体形)
C、
(四面体形)
C、 的系统命名为:2,2,5-三甲基己烷
D、苯分子中的π键:
的系统命名为:2,2,5-三甲基己烷
D、苯分子中的π键: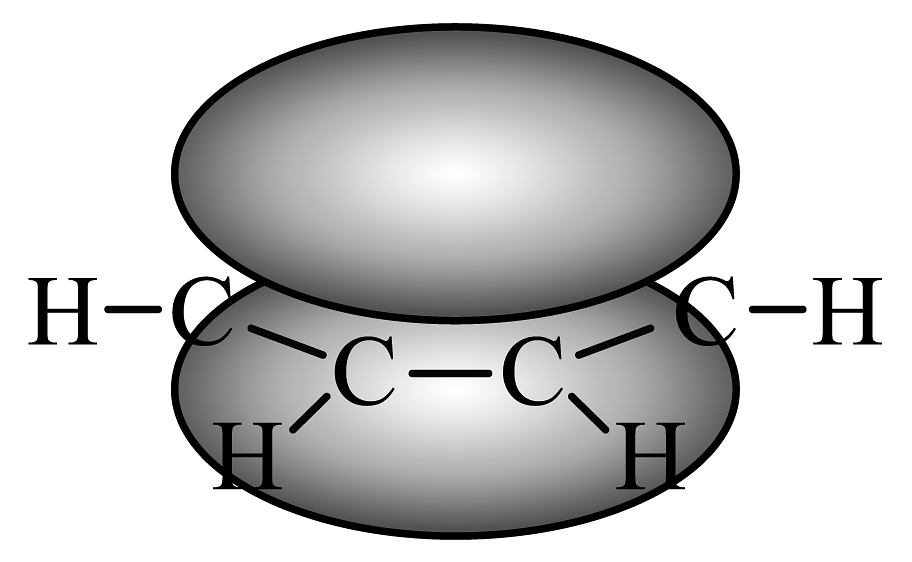
-
19、下列物质属于强电解质的是A、CH3Cl B、C2H5NH3Cl C、SO3 D、Mg(OH)2
-
20、瑞卢戈利(K)是一种小分子促性腺激素释放素受体拮抗剂,其结构如下:
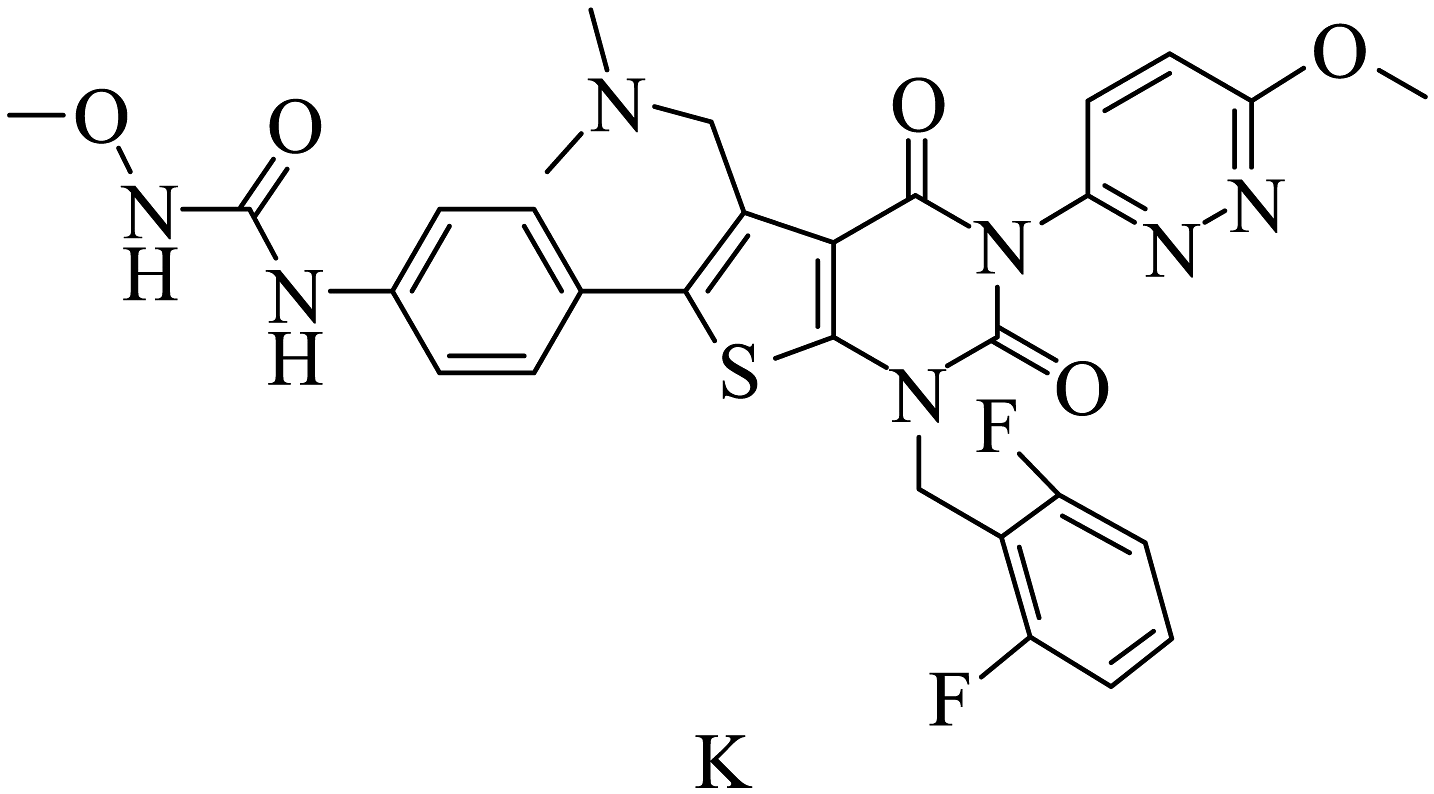
某研究小组按以下路线合成瑞卢戈利(部分反应条件已简化):
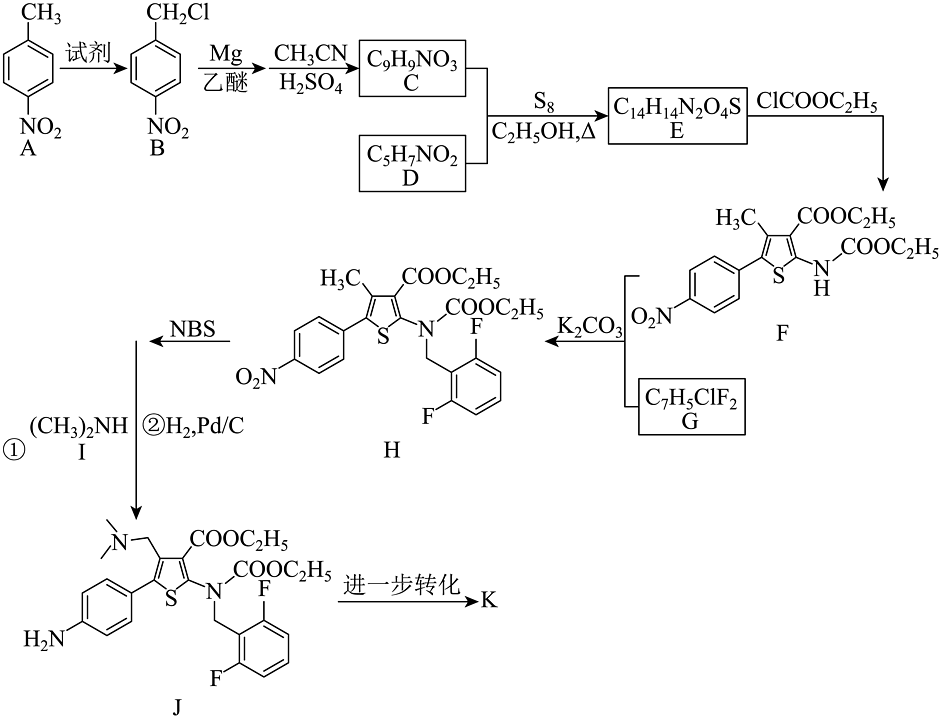
已知:①
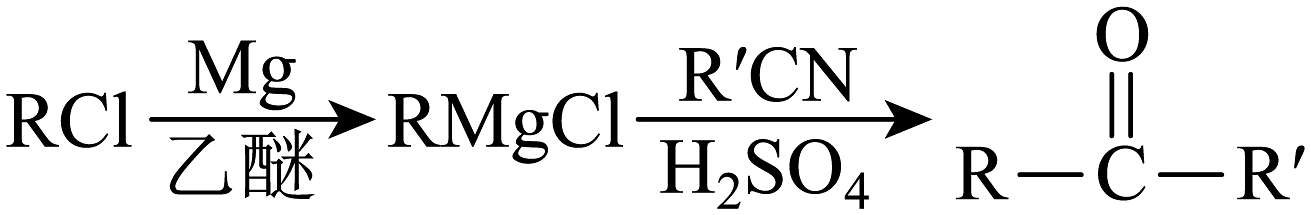
②
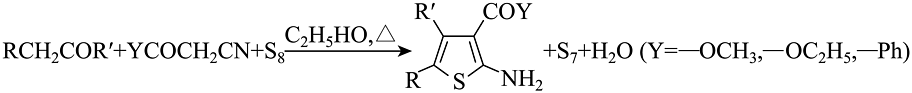
③

请回答:
(1)、化合物F的含氮官能团名称是。(2)、下列说法不正确的是___________。A、的反应中,试剂可用 B、反应过程中只发生取代反应 C、化合物I的碱性弱于 D、瑞卢戈利可在酸性或碱性条件下发生水解反应(3)、化合物G的结构简式是。(4)、的化学方程式是。(5)、写出4种同时符合下列条件的化合物C的同分异构体的结构简式。①谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,无氮氧单键;
②与过量反应生成邻苯二酚(
 )。(已知:
)。(已知: )。(6)、以氯苯、1-氯丁烷和溴乙酸为有机原料,设计化合物
)。(6)、以氯苯、1-氯丁烷和溴乙酸为有机原料,设计化合物 的合成路线(用流程图表示,无机试剂任选)。
的合成路线(用流程图表示,无机试剂任选)。