相关试卷
-
1、以下氮氧化合物, , , 的结构式,有关说法正确的是( )
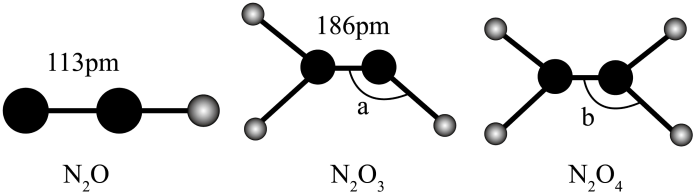 A、氮氮键的键能: B、熔点: C、分子的极性: D、的键角:
A、氮氮键的键能: B、熔点: C、分子的极性: D、的键角: -
2、如图为有机物结构式,有关说法正确的是( )
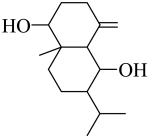 A、分子式为 B、手性碳有3个 C、
A、分子式为 B、手性碳有3个 C、 为加成产物
D、
为加成产物
D、 为缩聚产物
为缩聚产物
-
3、根据元素周期律,同时满足条件(ⅰ)和条件(ⅱ)的元素是( )
(ⅰ)电负性是同主族元素中最大:
(ⅱ)第一电离能比同周期相邻主族元素大的。
A、Al B、Si C、B D、Be -
4、下列实验操作及装置正确的是( )
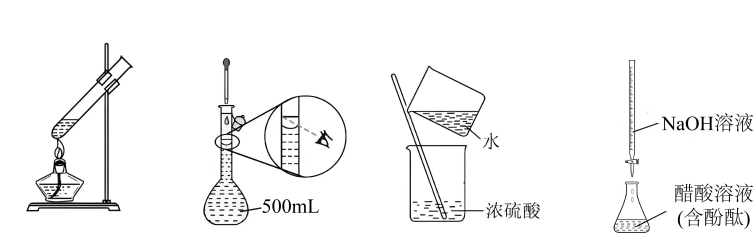 A、加热 B、定容 C、稀释 D、滴定
A、加热 B、定容 C、稀释 D、滴定 -
5、下列有关离子反应错误的是( )A、亚硫酸氢钠与石灰水反应: B、与水反应: C、与水反应: D、与NaBr溶液反应:
-
6、下列实验对应物质性质、现象都正确是( )
选项
性质
现象
A
焰色反应
Na、K火焰都是紫色
B
漂白性
、都可以使物质永久漂白
C
蛋白质变性
醋酸铅和甲醛都能让蛋白质变性
D
腐蚀印刷电路
用氯化铁和浓硫酸在常温下都可以刻画电路板
A、A B、B C、C D、D -
7、抗日战争时期,我国军民同仇敌忾,利用简易装置制作了许多武器,下列制造过程中涉及氧化还原反应的是( )A、用研磨法代替粉碎机碾碎硝化棉 B、在陶缸中使用硫磺制作硫酸 C、用蒸馏法将白酒制取工业酒精 D、用水解法将植物油与熟石灰制备甘油
-
8、以甲烷燃料电池为电源电解NaB(OH)4溶液制备H3BO3的工作原理如图所示,下列叙述错误的是
 A、燃料电池通入氧气的电极接电解池的X电极 B、N室中:a%>b% C、膜I、III为阳离子交换膜,膜II为阴离子交换膜 D、理论上每生成1mol产品,需消耗甲烷的体积为2.8L(标况)
A、燃料电池通入氧气的电极接电解池的X电极 B、N室中:a%>b% C、膜I、III为阳离子交换膜,膜II为阴离子交换膜 D、理论上每生成1mol产品,需消耗甲烷的体积为2.8L(标况) -
9、乙烯和乙炔具有相似的化学性质,下列关于乙烷、乙烯及乙炔的说法正确的是
①它们既不是互为同系物,也不是互为同分异构体
②乙烷是饱和烃,乙烯、乙炔是不饱和烃
③乙烯、乙炔能使溴水褪色,乙烷不能使溴水褪色
④它们都能燃烧,乙炔燃烧时火焰最明亮,有浓的黑烟产生
⑤它们都能使酸性KMnO4溶液褪色
A、①③④ B、①②④⑤ C、②③⑤ D、①②③④ -
10、下列与铁有关的实验对应装置或操作设计不正确的是
 A、用甲装置制取 B、用乙装置在铁件外表镀一层光亮的铜 C、用丙装置蒸干溶液,得到硫酸铁晶体 D、用丁装置将铁与水蒸气反应,并验证气体产物
A、用甲装置制取 B、用乙装置在铁件外表镀一层光亮的铜 C、用丙装置蒸干溶液,得到硫酸铁晶体 D、用丁装置将铁与水蒸气反应,并验证气体产物 -
11、某小组同学用下图装置探究与亚铁盐溶液的反应(夹持装置略)。

已知:稀溶液中的水合离子几乎无色;(黄色)。
操作:向0.56g铁粉中迅速加入10mL试剂X,塞紧试管C上的胶塞,立即打开活塞a,待C中铁粉完全溶解后,关闭活塞a,打开活塞b.C中现象如下表。
序号
试剂X
C中现象
打开活塞a后
打开活塞b后
Ⅰ
盐酸
有大量气泡产生,铁粉逐渐减少,无色溶液迅速变黄,后逐渐变为浅绿色
溶液逐渐变为浅黄色,产生极少量淡黄色沉淀
Ⅱ
盐酸
有大量气泡产生,铁粉逐渐减少,无色溶液迅速变黄,后逐渐变为浅绿色
溶液逐渐变为黄色,产生少量淡黄色沉淀
Ⅲ
硫酸
有大量气泡产生,铁粉逐渐减少,无色溶液逐渐变为浅绿色
无明显变化
(1)、打开活塞b后,B中反应的化学方程式为。(2)、上述实验中,打开活塞a一段时间后关闭,再打开活塞b,目的是。(3)、打开活塞a期间,实验Ⅰ~Ⅲ中的现象有相同也有不同。①实验Ⅰ、Ⅱ中,试管C中无色溶液均先变黄,再逐渐变为浅绿色。溶液由黄色变为浅绿色的原因是(用离子方程式表示)。
②实验Ⅲ中,溶液始终未变黄,可能的原因是。
(4)、经检验,实验Ⅰ、Ⅱ中的淡黄色沉淀为硫单质。甲同学猜想可能是自身发生歧化反应,乙同学通过实验排除了这种可能性,其实验操作及现象为。(5)、综合上述实验,可以得出的结论是(结合化学用语说明)。 -
12、瓢虫分泌的生物碱可用于研发杀虫剂,瓢虫生物碱前体化合物L的合成路线如下。

已知:
ⅰ.



ⅱ.



 (1)、P的结构简式是。用乙酸和甲醇合成P的化学方程式为。(2)、B→C的反应类型是。(3)、C中官能团的名称是。用虚线标注出C→D时C的断键位置:。
(1)、P的结构简式是。用乙酸和甲醇合成P的化学方程式为。(2)、B→C的反应类型是。(3)、C中官能团的名称是。用虚线标注出C→D时C的断键位置:。 (4)、E中不含醛基,含有一个五元环,E的结构简式为。(5)、I的核磁共振氢谱有两组峰,峰面积之比为 , A和P以物质的量之比合成I的化学方程式为。(6)、J中含有三个六元环,J的结构简式为。(7)、K→L过程中转变为。理论上发生反应的K与的物质的量之比为。
(4)、E中不含醛基,含有一个五元环,E的结构简式为。(5)、I的核磁共振氢谱有两组峰,峰面积之比为 , A和P以物质的量之比合成I的化学方程式为。(6)、J中含有三个六元环,J的结构简式为。(7)、K→L过程中转变为。理论上发生反应的K与的物质的量之比为。 -
13、钌(Ru)是贵金属,在医疗、催化等方面有重要应用。熔融-氧化-蒸馏法是工业上回收废钌催化剂中Ru的一种方法,流程如下。

已知:ⅰ.易挥发,加热时容易分解成和。
ⅱ.随温度升高,溶解度增大。
(1)、废钌催化剂中的钌单质和经碱熔焙烧生成 , 其中的作用是。(2)、如图1所示,蒸馏温度高于80℃时,蒸馏收率随着温度的升高而降低,可能的原因是。 (3)、氧化-蒸馏时选用硫酸酸化而非盐酸,原因是(用离子方程式表示)。(4)、获得晶体的操作A包括加热浓缩、、。(5)、用交替电解法可剥落旧电极表面的催化涂层,再用熔融-氧化-蒸馏法回收Ru。
(3)、氧化-蒸馏时选用硫酸酸化而非盐酸,原因是(用离子方程式表示)。(4)、获得晶体的操作A包括加热浓缩、、。(5)、用交替电解法可剥落旧电极表面的催化涂层,再用熔融-氧化-蒸馏法回收Ru。已知:ⅰ.电解时会生成Ru、和 , 新生成的含钌物质在电极上的附着力弱。
ⅱ.电解一段时间后,惰性阳极可能被部分氧化,导电能力降低。
①交替电解装置如图2,每隔5~6分钟改变一次电流方向。电解时两电极上均有少量气泡产生。刚通电时,阳极的电极反应式为、。

②用交替电解法剥落涂层的效率较高,可能的原因有(填序号)。
a.含钌物质可同时从a、b两电极上脱落
b.阴极上,全部电子均用于还原
c.电流变向后,部分氧化的阳极被还原,电阻减小
-
14、Ti是一种密度小,强度大的金属。钛合金也有广泛应用。(1)、将Ti的基态原子价电子轨道表示式补充完整:。
 。(2)、Ti的三种四卤化物的熔点如下表。
。(2)、Ti的三种四卤化物的熔点如下表。四卤化物
熔点/℃
38.3
155
、、的熔点依次升高的原因是。
(3)、可用于制备金属Ti.工业上常以和为原料制备 , 反应时需加入焦炭。已知:ⅰ.
ⅱ.
从平衡移动角度解释加入焦炭的作用:。
(4)、合金有良好的生物相容性,其晶体有和两种立方晶胞结构,如下图。
①中,Au周围最近且等距的Ti的个数为。
②若和两种晶胞棱长分别为anm和bnm,则两种晶体的密度之比为。
(5)、用滴定法测定合金中Ti含量:取ag合金,加入足量浓硫酸共热,得到紫色溶液,并在酸性条件下定容至250mL;取25mL溶液于锥形瓶中,以KSCN为指示剂,用溶液进行滴定,逐渐变为(无色),达到滴定终点时,消耗溶液VmL。①滴定过程被氧化为的离子方程式为。
②滴定终点的现象:滴入最后一滴溶液,。
③合金中Ti的质量分数为。
-
15、氯碱工业是以电解饱和食盐水为基础的工业,电解装置的示意图如下。
 (1)、电解饱和食盐水总反应的化学方程式为。电解时需加盐酸控制阳极区溶液pH在2~3,结合生产目的解释原因:。(2)、储存饱和食盐水的金属设备容易发生电化学腐蚀,食盐水的流动和搅拌会加剧腐蚀,原因是。(3)、淡盐水补食盐后可循环利用,但其中溶解的会部分转化为 , 造成设备腐蚀。需向淡盐水中加入盐酸脱除 , 补全该反应的离子方程式:。
(1)、电解饱和食盐水总反应的化学方程式为。电解时需加盐酸控制阳极区溶液pH在2~3,结合生产目的解释原因:。(2)、储存饱和食盐水的金属设备容易发生电化学腐蚀,食盐水的流动和搅拌会加剧腐蚀,原因是。(3)、淡盐水补食盐后可循环利用,但其中溶解的会部分转化为 , 造成设备腐蚀。需向淡盐水中加入盐酸脱除 , 补全该反应的离子方程式:。______________________。
(4)、阳离子交换膜是一种复合高分子材料,其靠近阴极的一侧富含 , 可排斥阴离子,因而具有离子选择透过性。若阳极室酸性过强,阳离子交换膜的选择透过性会降低,原因是。 -
16、合成气(CO与混合气体)在生产中有重要应用。铁基氧载体可以实现与重整制备合成气,过程如图1.不同温度下,氧化室中气体的体积分数如图2.

下列说法不正确的是
A、氧化室中的主要反应为 B、由图1可知,若实现循环,理论上所得合成气中 C、500~650℃时,氧化室中比CO更易发生副反应 D、该方法既可制备有价值的合成气,又可减少温室气体的排放 -
17、实验室常用磷酸二氢钾()和磷酸氢二钠()配制成磷酸盐缓冲溶液,以保存有生物活性的样品(如蛋白激酶等)。室温下,1L某磷酸盐缓冲溶液中含有0.1mol和0.1mol。
已知:i.可溶,和难溶。
ii.室温下,不同pH时,溶液中含磷微粒的物质的量分数如下图。

下列关于该缓冲溶液的说法不正确的是
A、溶液pH约为7 B、 C、通入0.05molHCl气体后,溶液pH小于6 D、加入激活蛋白激酶时,溶液pH可能降低 -
18、我国科研团队利用酯交换、缩聚两步法成功制备了具有高力学强度的异山梨醇型聚碳酸酯(PBIC),合成路线如下。

下列说法不正确的是
A、碳酸二甲酯中,碳原子的杂化方式有2种 B、异山梨醇中的官能团为羟基和醚键 C、缩聚过程脱除的小分子为甲醇 D、合成1molPBIC时,理论上参加反应的丁二醇的物质的量为mmol -
19、下列方程式与所给事实不相符的是A、铜与稀硝酸反应: B、用溶液检验邻羟基苯甲酸中的羧基:

 C、用作沉淀剂,处理废水中的:
D、向溶液中滴加足量浓氨水:
C、用作沉淀剂,处理废水中的:
D、向溶液中滴加足量浓氨水:
-
20、HCHO和HCOOH是大气中常见的污染物,它们之间反应的可能路径如下图。

下列说法正确的是
A、总反应的速率主要由决定 B、该路径中,HCHO与HCOOH发生取代反应 C、HCHO与HCOOH反应时, D、维持中间体的相互作用中,①和②均为氢键