相关试卷
-
1、下列事实可证明是弱碱的是A、氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B、铵盐受热易分解,放出氨气 C、室温下,氨水溶液的pH为10 D、室温下,氨水可以使酚酞试液变红
-
2、下列物质的分类组合全部正确的是
选项
强电解质
弱电解质
非电解质
A
NaCl
B
HCl
C
Cu
D
NaOH
A、A B、B C、C D、D -
3、
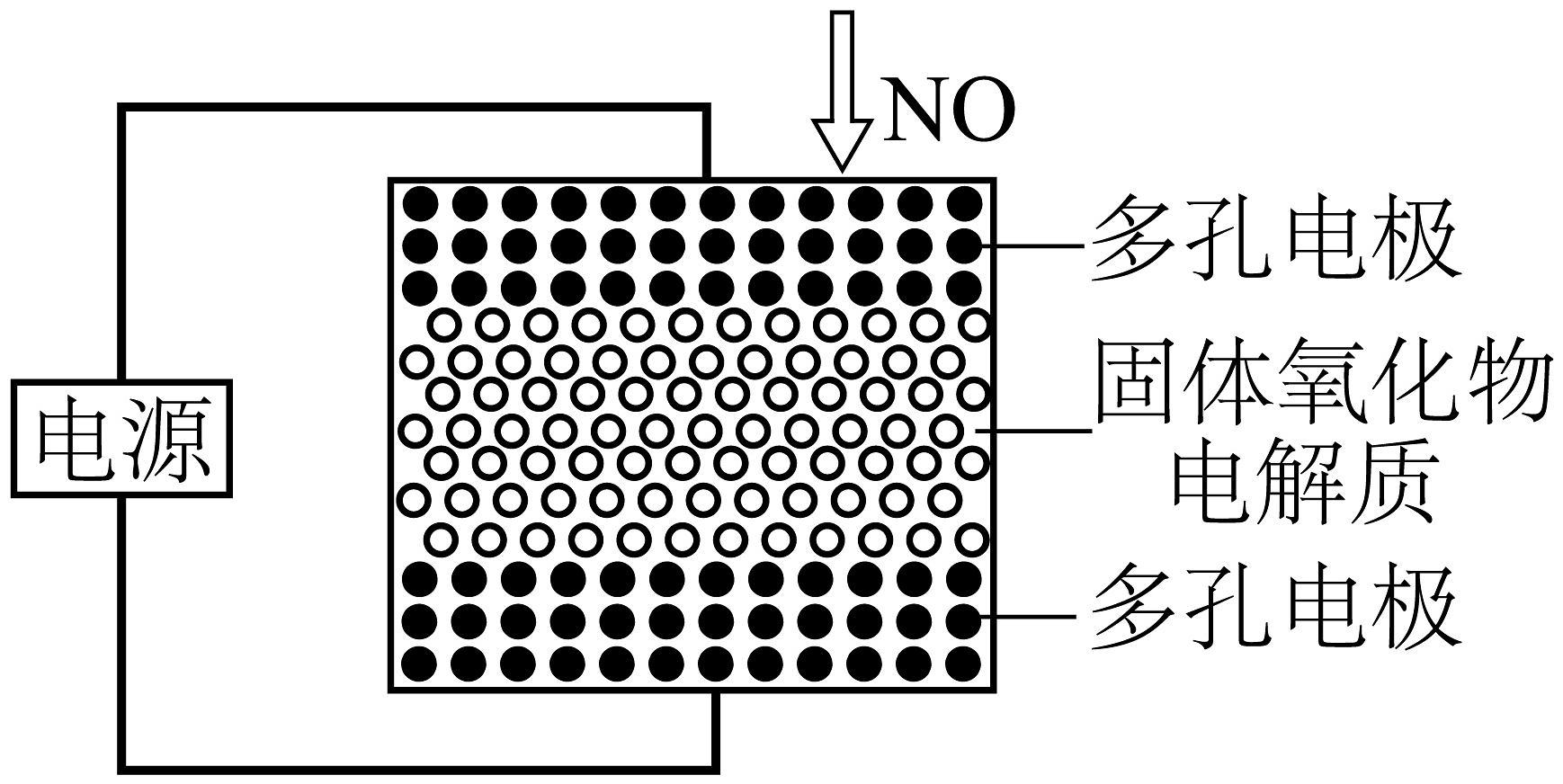
NO的治理是当前生态环境保护中的重要课题之一。
I.电化学技术
(1)利用固体氧化物电解池可将NO直接转化为N2.电解时,如图所示电化学还原器中,阴极发生的电极反应式为。
Ⅱ.NH3-SCR技术
(2)Cu基催化剂是NH3-SCR技术脱除NO中性能较为优异的新型催化剂,但烟气中的SO2会造成Cu基催化剂的催化性能下降。加入CeO2(基态Ce原子核外电子排布式为[Xe]4f15d16s2)可抑制SO2对Cu基催化剂的影响,其作用机理如图所示(含Ce化合物的比例系数均未标定)。

①从整个反应机理来看,总反应中起还原作用的物质是(填化学式)。
②在上述反应机理图中,CemOn的化学式为。
(3)将3%NO、6%NH3、21%O2和70%N2的混合气体(N2为平衡气)以一定流速通过装有Cu基催化剂的反应器,NO去除率随反应温度的变化曲线如图所示。

①在150~300℃范围内,随着温度的升高,NO去除率先迅速上升后缓慢上升的主要原因是。
②燃煤烟气中伴有一定浓度的HCl气体,它会造成NO去除率下降,其原因可能是。
-
4、水合肼(N2H4·H2O)易溶于水,有强还原性,一般被氧化为N2 , 处理碱性银氨{[Ag(NH3)2]}溶液获得超细银粉的工艺流程如下:
 (1)、合成水合肼:如图所示,将NaOH溶液与NaClO、CO(NH2)2溶液中的一种配成混合溶液,加入到三颈烧瓶中,40℃下通过滴液漏斗缓慢滴加另一种溶液,反应一段时间后,再迅速升温至110℃继续反应。
(1)、合成水合肼:如图所示,将NaOH溶液与NaClO、CO(NH2)2溶液中的一种配成混合溶液,加入到三颈烧瓶中,40℃下通过滴液漏斗缓慢滴加另一种溶液,反应一段时间后,再迅速升温至110℃继续反应。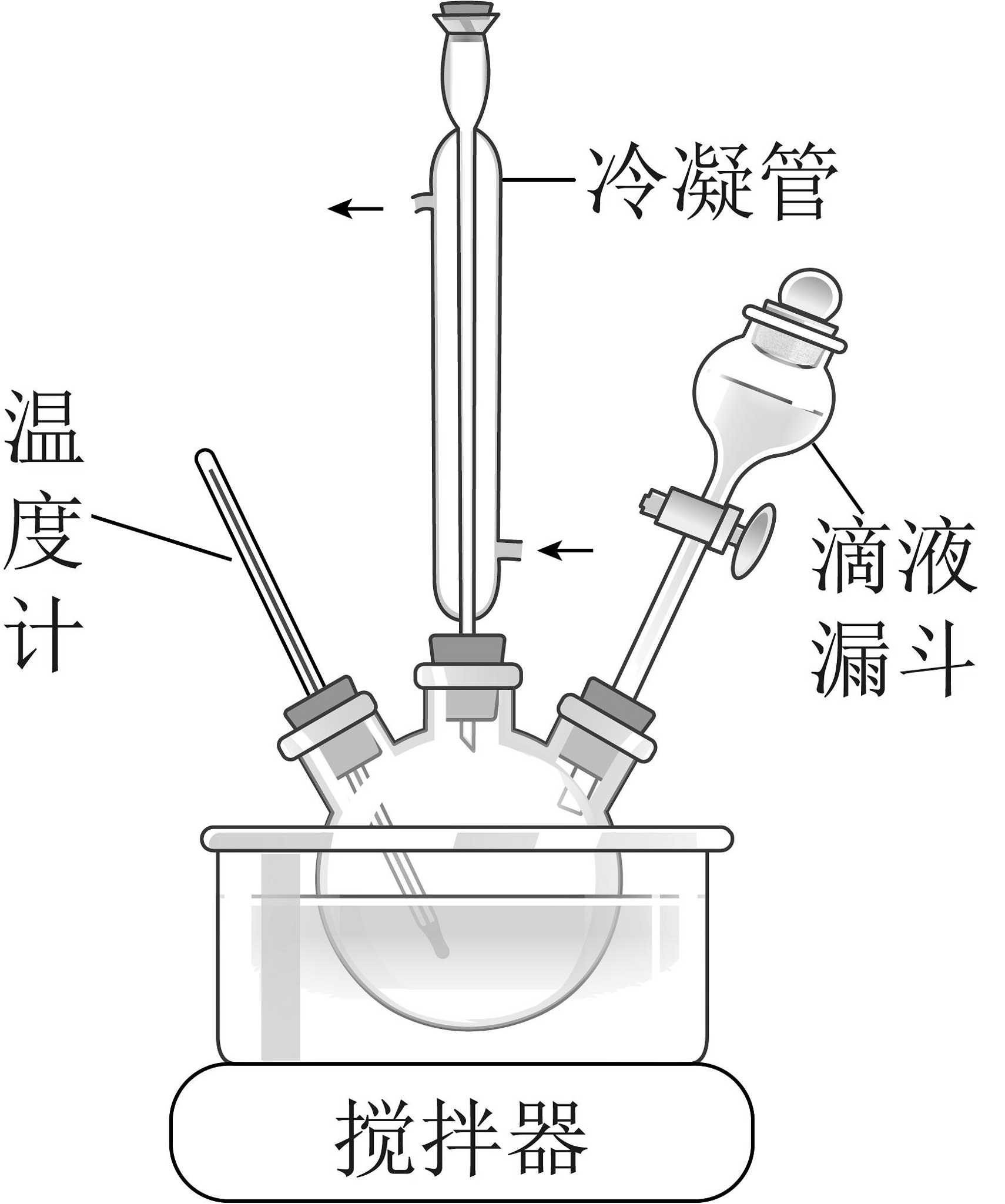
①滴液漏斗中的溶液是。
②反应I制备水合肼的化学方程式为。
(2)、实验室中配制一定体积的银氨溶液的方法为(须使用的试剂:2%的稀氨水、2%的硝酸银溶液)。(3)、制备超细银粉:在水合肼溶液中逐滴加入新制的银氨溶液,控制20℃充分反应,可制得超细银粉。水合肼直接与AgNO3溶液反应也能生成Ag,用银氨溶液代替AgNO3溶液的原因是。(4)、通过如下步骤测定超细银粉样品中Ag的质量分数(杂质不参与反应)。①称取超细银粉样品2.500g,加适量稀硝酸充分溶解、过滤、洗涤,将滤液和洗涤滤液合并定容到250mL容量瓶中。
②准确量取25.00mL溶液置于锥形瓶中,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000mol/LNH4SCN标准溶液滴定。滴定终点的实验现象为。
③重复②的操作3次,所用NH4SCN标准溶液的平均体积为23.00mL。
已知:Ag++SCN-=AgSCN↓(白色),则样品中银的质量分数为(写出计算过程)。
-
5、化合物G是合成氢化橙酮衍生物的中间体,其人工合成路线如下:
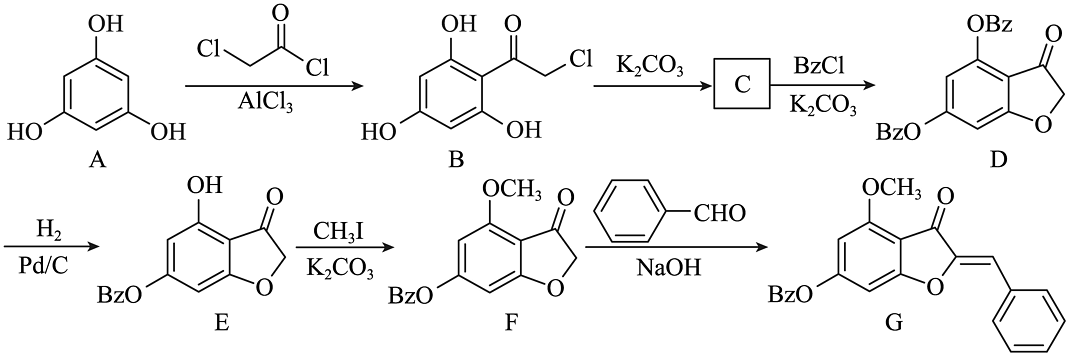
注:-Bz为苯甲酰基,结构式为
 (1)、B中含氧官能团的名称为。(2)、E→F的反应类型为。(3)、C的结构简式为。(4)、D的一种同分异构体同时满足下列条件,该同分异构体的结构简式为。
(1)、B中含氧官能团的名称为。(2)、E→F的反应类型为。(3)、C的结构简式为。(4)、D的一种同分异构体同时满足下列条件,该同分异构体的结构简式为。①分子中不同化学环境的氢原子数目比为2:2:2:1.
②碱性条件下水解,酸化后得2种产物,其中一种产物分子只含一种含氧官能团,另一种产物含有2种含氧官能团且能与FeCl3发生显色反应。
(5)、写出以 、
、 、CH3I为原料制备
、CH3I为原料制备 的合成路线流程图(无机试剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线示例见本题题干)。 -
6、我国学者分别使用Fe2O3和Fe3O4作催化剂对燃煤烟气脱硝脱硫进行了研究。(1)、催化剂制备。在60~100℃条件下,向足量NaOH溶液中通入N2一段时间,再加入适量新制FeSO4溶液,充分反应后得到混合物X;向混合物X中加入NaNO3溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得Fe3O4催化剂。
①通入N2的目的是。
②混合物X与NaNO3反应生成Fe3O4和NH3 , 该反应的化学方程式为。
(2)、催化剂性能研究。如图1所示,当其他条件一定时,分别在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测定H2O2浓度对模拟烟气(含一定比例的NO、SO2、O2、N2)中NO和SO2脱除率的影响,NO脱除率与H2O2浓度的关系如图2所示。
已知•OH能将NO、SO2氧化。•OH产生机理如下。
反应Ⅰ:Fe3++H2O2=Fe2++•OOH+H+(慢反应)
反应Ⅱ:Fe2++H2O2=Fe3++•OH+OH-(快反应)
①与Fe2O3作催化剂相比,相同条件下Fe3O4作催化剂时NO脱除率更高,其原因是。
②NO部分被氧化成NO2。NO2被NaOH溶液吸收生成两种含氧酸钠盐,该反应的离子方程式为。
③实验表明•OH氧化SO2的速率比氧化NO速率慢。但在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测得SO2脱除率几乎均为100%的原因是。
-
7、和联合重整能减少温室气体的排放。重整时发生如下反应:
反应I:
反应Ⅱ:
其他条件相同,投料比为时,和的平衡转化率与温度变化关系如图所示,下列说法不正确的是
 A、其他条件不变,投料比为 , 则平衡时转化率一定高于 B、一定条件下,使用高效催化剂可以提高单位时间内氢气的产量 C、始终低于1.0,是因为发生了反应Ⅱ D、其他条件不变, , 升高温度更有利于反应Ⅱ进行
A、其他条件不变,投料比为 , 则平衡时转化率一定高于 B、一定条件下,使用高效催化剂可以提高单位时间内氢气的产量 C、始终低于1.0,是因为发生了反应Ⅱ D、其他条件不变, , 升高温度更有利于反应Ⅱ进行 -
8、室温下,Ka1(H2C2O4)=5.4×10-2 , Ka2(H2C2O4)=5.4×10-5 , Ksp(CaC2O4)=2.4×10-9.某小组进行如下实验:
实验I:向20mL0.1mol/LNaHC2O4溶液中滴加0.1mol/LNaOH溶液。
实验II:向20mL0.1mol/LNaHC2O4溶液中滴加0.1mol/LCaCl2溶液。
若溶液混合后体积变化忽略不计,下列说法正确的是
A、实验I可选用甲基橙作指示剂,指示反应终点 B、实验I中V(NaOH)=10mL时,存在c(C2O)<c(HC2O) C、实验II中发生反应+Ca2+=CaC2O4↓+H+ D、实验II中V(CaCl2)=80mL时,溶液中c(C2O)=4.0×10-8mol/L -
9、常温下,根据下列实验操作和现象得出的解释或结论正确的是
选项
实验操作和现象
解释或结论
A
将少量铜粉加入稀硫酸中,无明显现象,再加入Fe(NO3)3溶液,铜粉溶解
Fe3+将铜粉氧化
B
用蒸馏水溶解CuCl2固体,并继续加水稀释,溶液由绿色逐渐变为蓝色
[CuCl4]2-+4H2O[Cu(H2O)4]2++4Cl-正向移动
C
用pH计分别测NaClO溶液和CH3COONa溶液的pH,前者pH大于后者
酸性:CH3COOH>HClO
D
取2mL某卤代烃样品于试管中,加入5mL20%KOH溶液并加热,冷却后滴加AgNO3溶液,产生白色沉淀
该卤代烃中含有氯元素
A、A B、B C、C D、D -
10、一种用于污水净化和海水淡化的微生物电池如图所示。下列说法正确的是
 A、a电极作原电池的正极 B、处理后的含硝酸根废水pH降低 C、左室发生反应的电极反应为C6H12O6-24e-+6H2O=6CO2↑+24H+ D、电池工作时,中间室的Cl-移向右室,Na+移向左室,实现海水淡化
A、a电极作原电池的正极 B、处理后的含硝酸根废水pH降低 C、左室发生反应的电极反应为C6H12O6-24e-+6H2O=6CO2↑+24H+ D、电池工作时,中间室的Cl-移向右室,Na+移向左室,实现海水淡化 -
11、用粗硅制备高纯硅,发生的反应包括①Si(s)+3HCl(g)H2(g)+SiHCl3(g)、②SiHCl3(g)+H2(g)3HCl(g)+Si(s)。下列说法正确的是A、反应①的△S>0 B、反应②的化学平衡常数K= C、制备高纯硅的过程中应设法循环使用H2和HCl D、1mol晶体硅中含有4mol Si-Si键
-
12、阅读下列材料,完成下面小题:
氯在自然界中以NaCl、MgCl2等形式存在于海水、盐湖中,是制备含氯化合物的来源。ClO2是一种黄绿色气体,混合气体,中其体积分数大于10%就可能发生爆炸,易溶于水,可以替代Cl2用于自来水消毒。除此之外,NaClO2等物质也是常用的含氯消毒剂。
(1)、实验室制取Cl2时,下列装置能达到相应实验目的的是A、制备Cl2 B、净化Cl2
B、净化Cl2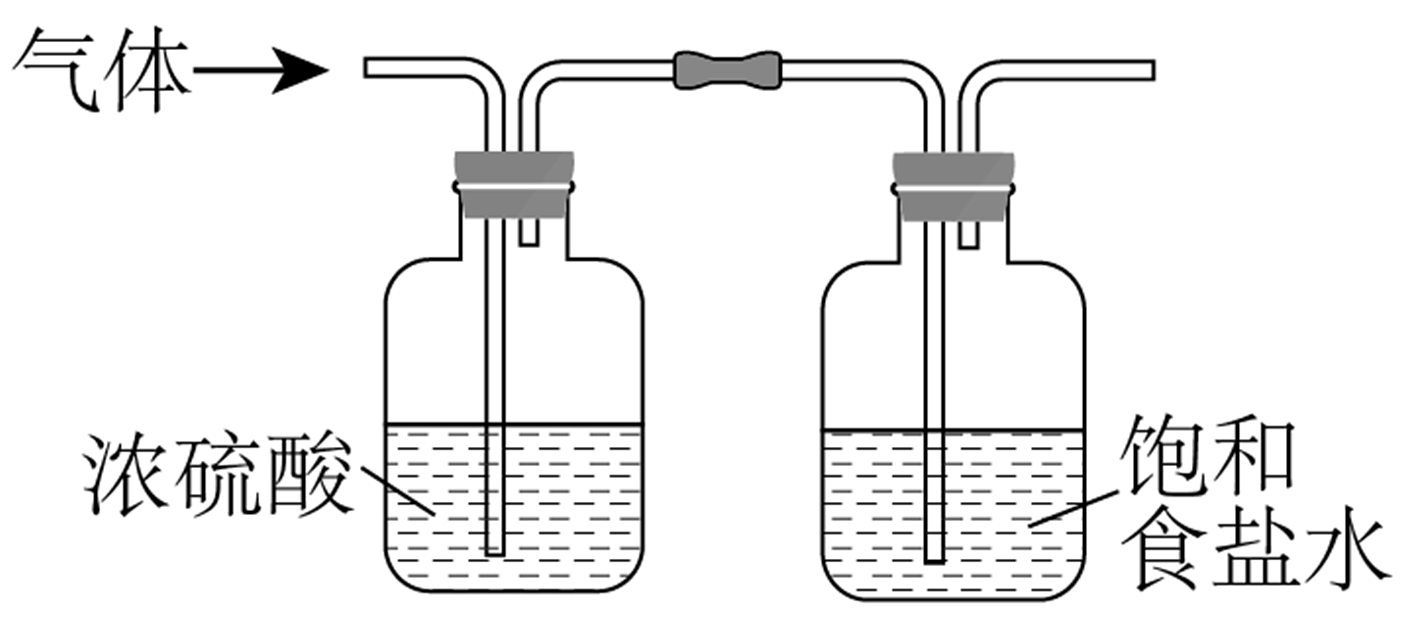 C、收集Cl2
C、收集Cl2 D、尾气处理
D、尾气处理 (2)、下列关于ClO2的说法正确的是A、ClO2是电解质 B、ClO2中含有非极性键 C、相同条件下,ClO2的沸点低于O2 D、相同条件下,ClO2在水中的溶解度比Cl2的大(3)、下列有关说法正确的是
(2)、下列关于ClO2的说法正确的是A、ClO2是电解质 B、ClO2中含有非极性键 C、相同条件下,ClO2的沸点低于O2 D、相同条件下,ClO2在水中的溶解度比Cl2的大(3)、下列有关说法正确的是 A、基态Cl原子的核外存在7个未成对电子 B、如图所示晶胞中Cl-周围等距离且最近的Na+有6个 C、在空气中灼烧MgCl2·6H2O可得到无水氯化镁 D、电解饱和MgCl2溶液可制得金属镁
A、基态Cl原子的核外存在7个未成对电子 B、如图所示晶胞中Cl-周围等距离且最近的Na+有6个 C、在空气中灼烧MgCl2·6H2O可得到无水氯化镁 D、电解饱和MgCl2溶液可制得金属镁 -
13、有机物基团间相互作用对有机物性质有重要影响。下列有关说法不正确的是A、甲苯比苯易发生硝化反应,是由于甲基使苯环上的氢原子更活泼 B、苯酚能与NaOH溶液反应而环己醇不能,是由于羟基对侧链产生影响 C、CCl3COOH的酸性强于CH3COOH,是由于-CCl3使羧基更易电离出H+ D、乙醇和钠反应不如水与钠反应剧烈,是由于乙基使羟基中氢氧键极性减弱
-
14、下列有关含硫物质的性质与用途具有对应关系的是A、浓H2SO4具有吸水性,可用于干燥氧气 B、Na2S溶液显碱性,可去除污水中的Cu2+ C、SO2具有氧化性,可用作纸浆的漂白剂 D、硫磺具有还原性,可用于去除洒落的金属汞
-
15、[Cu(NH3)4]SO4常用作杀虫剂、媒染剂。下列说法正确的是A、原子半径:r(O)>r(N) B、沸点:H2S>H2O C、第一电离能:I1(N)>I1(O) D、电负性:χ(H)>χ(O)
-
16、HCN主要用于电镀行业,可通过反应CH4+NH3=HCN+CH4+H2制备。下列说法正确的是A、CH4的空间结构为正四面体形 B、C2H4为极性分子 C、NH3的电子式为
 D、HCN中C原子采取sp3杂化
D、HCN中C原子采取sp3杂化
-
17、我国倡导培育和发展新质生产力。下列与科技成就相关的描述不正确的是A、“朱雀二号”是全球首枚成功入轨的液氧甲烷运载火箭,甲烷作助燃剂 B、“神舟十七号”发动机使用Si3N4作耐高温材料,Si3N4是共价晶体 C、自供电软机器人成功挑战马里亚纳海沟,采用的硅树脂是无机非金属材料 D、空间探测器要求高强度的零部件采用钛合金和不锈钢等合金材料
-
18、按要求回答下列问题。(1)、18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。
①该反应的化学方程式为。某同学拟用该原理按如下装置制备并收集纯净的氯气,在虚线框内选用的发生装置为(填“甲”、 “乙”或“丙”)。

②试剂X是 , 其作用是。
③NaOH溶液用于 , 反应的离子方程式为。
(2)、若将Cl2通入热的NaOH溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和的个数比为6:1时,混合液中ClO-和的个数比为。(3)、通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是(请用化学方程式说明),请在图2中画出氧气的体积随时间变化的趋势图。
-
19、
Ⅰ.钠单质及其化合物与人类生产、生活密切相关,请回答下列问题。
(1)实验室常将钠保存在煤油中,原因是。
(2)过氧化钠可作呼吸面具中的供氧剂,请写出其与CO2反应的化学方程式;当消耗156 g过氧化钠时,产生的O2在标准状况下体积是。
Ⅱ.纯碱和小苏打都是重要的化工原料,根据下列三组实验,回答。

(3)甲组实验能鉴别纯碱和小苏打的实验现象是。
(4)对比实验乙组和丙组,丙组能更便捷的验证两者的热稳定性,则丙组实验中A处盛放的物质为(填化学式)。
(5)某同学欲采用CaCl2溶液检验Na2CO3和NaHCO3溶液,做了如下探究实验。
实验组号
反应物
现象
物质
浓度/(mol/L)
CaCl2浓度/(mol/L)
是否有沉淀(室温)
气泡情况
室温
60℃水浴
A
NaHCO3
0.5
0.5
有大量白色沉淀
无
有明显气泡
B
Na2CO3
0.5
0.5
有大量白色沉淀
无
无
C
NaHCO3
0.05
0.05
有少量白色沉淀
无
无
D
Na2CO3
0.05
0.05
有较多白色沉淀
无
无
①由实验现象得出“常温下可以用CaCl2溶液鉴别同浓度的Na2CO3和NaHCO3溶液”结论,须满足的条件是。
②请写出A组中60℃时NaHCO3和CaCl2溶液反应的离子方程式。
③加热15.0 g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9 g,则混合物中碳酸氢钠的质量分数为。
-
20、利用铁元素“价—类”二维图可以从不同角度研究含铁物质的性质及其转化关系,请据此图回答问题。
 (1)、根据高铁酸钾(K2FeO4)中铁元素的化合价,推测其具有(填“氧化性”或“还原性”)。工业上制备高铁酸钠的一种方法的化学原理为:3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl+5H2O。请用双线桥法表示该反应电子转移的方向和数目:。(2)、FeCl3是棕黄色固体,主要用于金属蚀刻,污水处理。回答下列问题。
(1)、根据高铁酸钾(K2FeO4)中铁元素的化合价,推测其具有(填“氧化性”或“还原性”)。工业上制备高铁酸钠的一种方法的化学原理为:3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl+5H2O。请用双线桥法表示该反应电子转移的方向和数目:。(2)、FeCl3是棕黄色固体,主要用于金属蚀刻,污水处理。回答下列问题。①在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现 , 即可制得Fe(OH) 3胶体,写出制备的化学方程式:。
②为检验胶体是否制备成功,可利用胶体的。
③取少量制得的胶体置于试管中,再加入少量稀H2SO4溶液,观察到的现象为。
④下列有关Fe(OH) 3胶体制备的说法正确的是。
A.向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,应长时间加热
B.制备Fe(OH)3胶体时应煮沸至产生红褐色沉淀时停止加热
C.Fe(OH)3胶体和FeCl3溶液的本质区别是分散质粒子大小不同
D.制备Fe(OH)3胶体的反应为氧化还原反应。
电子工业中常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔(反应过程转化为Cu2+)来制造印刷电路板。写出FeCl3溶液与铜发生反应的化学方程式:。
(3)、人体对Fe2+的吸收效果更好,但人体中时刻进行着Fe2+Fe3+的相互转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C体现性。