相关试卷
-
1、关于实验室安全,下列说法不正确的是A、轻微烫伤或烧伤时,可用冷水处理,然后涂上烫伤膏即可 B、苯酚不慎沾到皮肤上,先用抹布擦拭,再用以上的水冲洗 C、探究钠与水的反应时需要注意:
 D、镁燃烧起火不可用泡沫灭火器灭火
D、镁燃烧起火不可用泡沫灭火器灭火
-
2、物质的结构决定物质的性质,下列说法正确的是A、相同浓度的和[Cu(NH3)4]2+氧化性:前者>后者 B、金刚石中碳碳键键长较短,键能和硬度很大,不容易因锤击而破碎 C、由于水分子间存在氢键,所以稳定性: D、甘油是粘稠液体是因为甘油分子间存在较强的范德华力
-
3、化学与生产、生活、科技密切相关。下列说法不正确的是A、生活中常用聚乙烯制成的薄膜来包装水果、蔬菜等食物 B、等离子体具有良好的导电性和流动性,可以用于制造等离子体显示器等 C、用热的纯碱溶液可清洗衣物上的汽油污渍 D、电热水器用镁棒防止内胆腐蚀,原理是电化学保护法的牺牲阳极法
-
4、下列表示正确的是A、异丙基的结构简式:
 B、激发态H原子的轨道表示式:
B、激发态H原子的轨道表示式: C、N-甲基乙酰胺的键线式为:
C、N-甲基乙酰胺的键线式为: D、与互为同位素
D、与互为同位素
-
5、下列只含极性键的极性分子是A、 B、 C、 D、
-
6、海水资源综合利用过程中,下列有关说法正确的是A、海水晒盐是利用溶质的溶解度随温度变化而变化的原理 B、海水提镁的转化为 C、用溶液吸收溴,离子方程式为 D、将氧化为时,加入过量的会使的产率降低
-
7、
钴氨配合物在电镀及环境科学研究中有着重要的应用价值。某科研小组对其研究过程如下:
I.配制CoCl2溶液
(1)配制100mL0.1mol·L-1CoCl2溶液,需要CoCl2的质量为________g。
(2)溶液配制过程中,下列仪器需要用到的有_______(填标号)。
A. 
B. 
C. 
D. 
Ⅱ.制备[Co(NH3)6]2+配合物
实验操作
实验现象
在试管内混合CoCl2溶液和适量6mol·L-1NH3·H2O溶液。
得到浅青色沉淀的浑浊液,沉淀未见明显溶解。
在试管内混合CoCl2溶液和适量14mol·L-1NH3·H2O溶液。
得到浅青色沉淀的浑浊液,沉淀未见明显溶解。
资料:Co(OH)2为浅青色沉淀,[Co(NH3)6]2+溶液为红色。
(3)实验①中生成浅青色沉淀的离子方程式为________。
(4)实验①和②现象可知,Co(OH)2与NH3·H2O难以生成[Co(NH3)6]2+配合物。学习小组预测对生成[Co(NH3)6]2+生成有一定促进作用。设计实验如下:取等体积实验①的浊液于1、2两支试管中,分别加入不同试剂,实验现象证实了预测。

①x的化学式是________,c = ________。
②实验现象是________。
③从平衡移动角度,结合化学用语,解释对[Co(NH3)6]2+生成有一定促进作用原理________。
Ⅲ.制备[Co(NH3)6]3+配合物
往CoCl2溶液中加入浓氨水、H2O2、NH4Cl溶液,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液。为探究反应过程,小组成员提出了不同的猜想。
提出猜想 猜想1:Co2+先失电子生成Co(OH)3后与氨水形成配合物;
猜想2:Co2+先被H2O2氧化成Co3+后与氨水形成配合物;
猜想3:Co2+先与氨水形成[Co(NH3)6]2+后被H2O2氧化成[Co(NH3)6]3+。
(5)科研小组取少量Co(OH)3固体于试管中,逐滴加入浓氨水,观察到________,证明猜想1不成立。
教师指导 氧化剂电对的电极电势大于还原剂电对的电极电势时,反应可以自发进行。
验证猜想 按照连接装置,分别往两烧杯中加入药品,关闭K,观察到________,猜想2不成立。往左边烧杯中滴加________,观察到________,猜想3成立。

-
8、对乙酰氨基酚是一种常用的解热镇痛药,其结构简式如图,关于该化合物的说法不正确的是
 A、能与FeCl3溶液发生显色反应 B、能与浓硝酸和浓硫酸发生硝化反应 C、碳原子的杂化方式有sp、sp2和sp3 D、分子中所有原子不可能共平面
A、能与FeCl3溶液发生显色反应 B、能与浓硝酸和浓硫酸发生硝化反应 C、碳原子的杂化方式有sp、sp2和sp3 D、分子中所有原子不可能共平面 -
9、化合物是一种重要的免疫增强剂,工业上可以进行如下路线的合成:
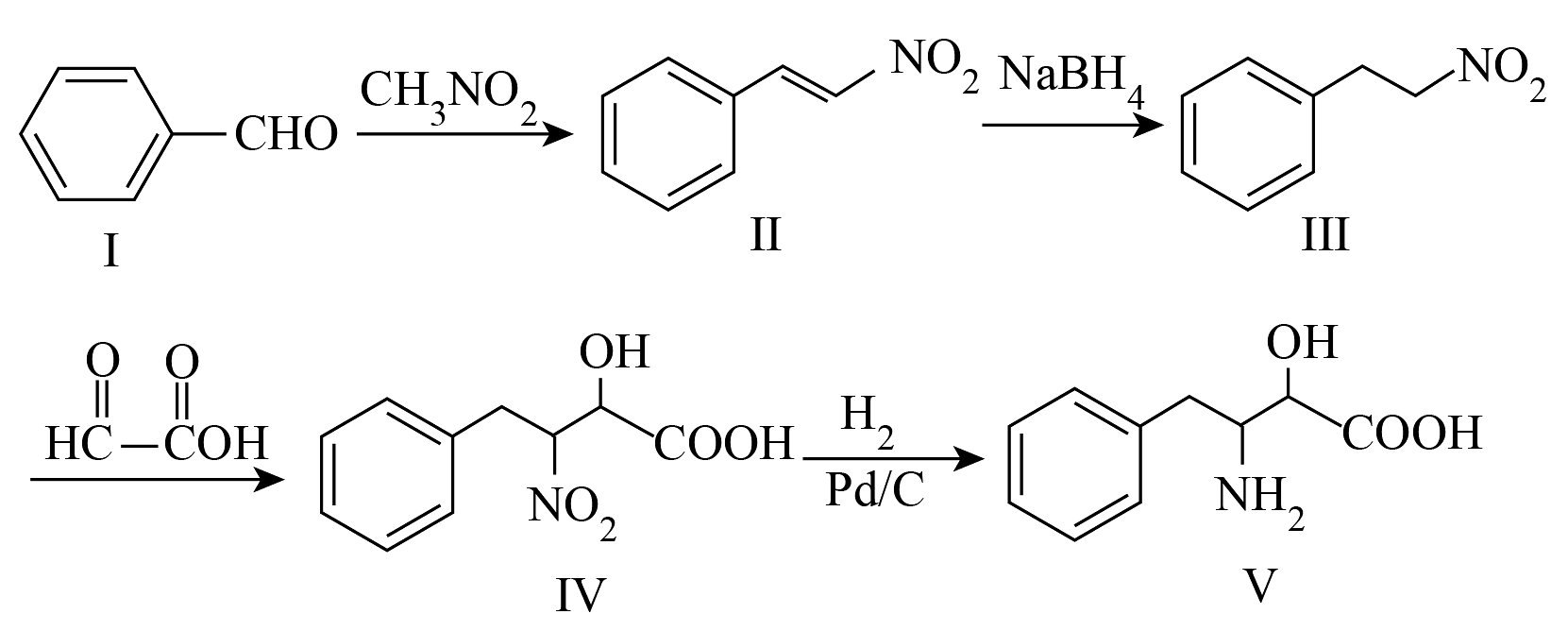 (1)、化合物Ⅰ的分子式 , 名称为。(2)、化合物Ⅱ中含氧官能团的名称是。化合物Ⅱ的某种同分异构体,在核磁共振氢谱图上只有4组峰,能够发生银镜反应,且苯环上的一氯代物有3种,其结构简式为。(3)、关于上述示意图中的相关物质及转化,下列说法正确的有___________。A、化合物Ⅲ到Ⅳ原子利用率100% B、由化合物Ⅰ到Ⅱ的转化中,有非极性键的断裂与形成 C、由化合物Ⅱ到Ⅲ以及由Ⅳ到V的转化过程,反应类型相同 D、化合物中原子的杂化方式有、、三种(4)、对化合物V,分析预测其可能的化学性质,完成下表。
(1)、化合物Ⅰ的分子式 , 名称为。(2)、化合物Ⅱ中含氧官能团的名称是。化合物Ⅱ的某种同分异构体,在核磁共振氢谱图上只有4组峰,能够发生银镜反应,且苯环上的一氯代物有3种,其结构简式为。(3)、关于上述示意图中的相关物质及转化,下列说法正确的有___________。A、化合物Ⅲ到Ⅳ原子利用率100% B、由化合物Ⅰ到Ⅱ的转化中,有非极性键的断裂与形成 C、由化合物Ⅱ到Ⅲ以及由Ⅳ到V的转化过程,反应类型相同 D、化合物中原子的杂化方式有、、三种(4)、对化合物V,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
①

②
催化氧化反应
(5)、由化合物Ⅲ到Ⅳ的转化中,生成一种副产物,其分子式为 , 请写出其结构简式为。(6)、以1,2-二溴乙烷和为有机原料,合成 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:①第一步反应的化学方程式为(注明反应条件)。
②最后一步反应的有机反应物是(写结构简式)。
-
10、汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。(1)、在周期表中,Hg是第六周期的元素,与Zn同族,则Hg的价层电子排布式为。(2)、富氧燃烧烟气中Hg的脱除主要是通过与反应实现,反应的化学方程式为
根据实验结果,有研究组提出了与的可能反应机理:
①根据盖斯定律,(写出代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是。
A.增大的浓度,可提高的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 , 可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为汞蒸气和的气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如下图所示。

(i)15℃,内的平均脱除反应速率为。
(ii)0(填“>”或“<”)。
(3)、溶液可用于手术刀消毒。常温下,与的配合物存在如下平衡: , 含微粒的分布系数与的关系如下图所示:
已知:平均配位数
①熔融状态的不能导电,是(填“共价”或“离子”)化合物。
②图中能代表曲线是(填字母),平衡常数。
③在点,溶液中(写出计算过程)。
-
11、锗是一种战略性金属,广泛应用于光学及电子工业领域。某锌浸渣中含有、、、、等,利用锌浸渣提取的实验流程如下图所示:
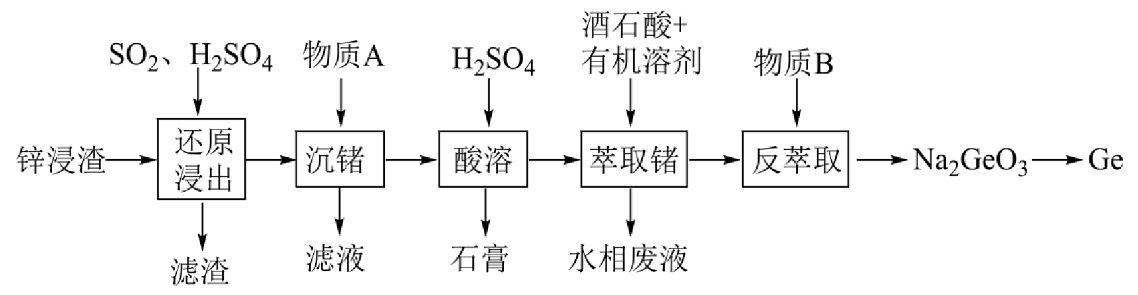
已知:①部分含锗微粒的存在形式与的关系为:
pH
pH<2
pH>12
Ge存在形式
②部分金属离子的沉淀:
开始沉淀
7.5
2.3
6.2
沉淀完全
9.0
3.2
8.0
回答下列问题:
(1)、“滤渣”的主要成分的化学式是。(2)、在“还原浸出”步骤中发生反应的离子方程式为。(3)、“沉锗”步骤中加入的物质A属于碱性氧化物,其化学式是。“沉锗”操作后,Ge以的形式存在,随着的升高,的沉淀率升高,“沉锗”操作理论上需控制范围为。(4)、“酸溶”后,溶液的为1.8,向溶液中加入酒石酸萃取剂,其原理为酒石酸与含锗微粒形成酒石酸络阴离子①若升高,锗的萃取率下降,原因是。
②“反萃取”中加入的物质B是(填标号)。
a.溶液 b.溶液 c.溶液
(5)、一种锗晶胞结构如下左图,与锗原子距离最近且相等的锗原子有个,锗原子A的原子坐标为 , 锗原子的原子坐标为;将该晶胞沿图中体对角线投影,下左图中锗原子B投影的位置是下右图的号位(填数字)。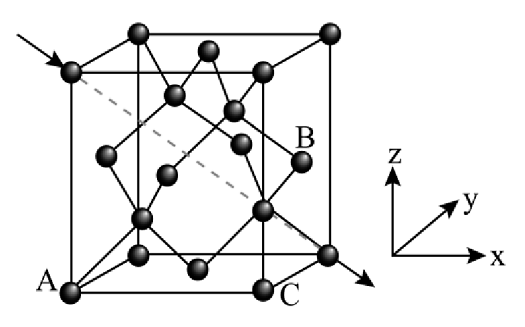

-
12、
性质活泼,可以和许多物质发生反应。
Ⅰ.实验室用和反应制备(黄绿色粉末,易与水反应产生)。
已知:(反应剧烈,温度高时会产生副产物)
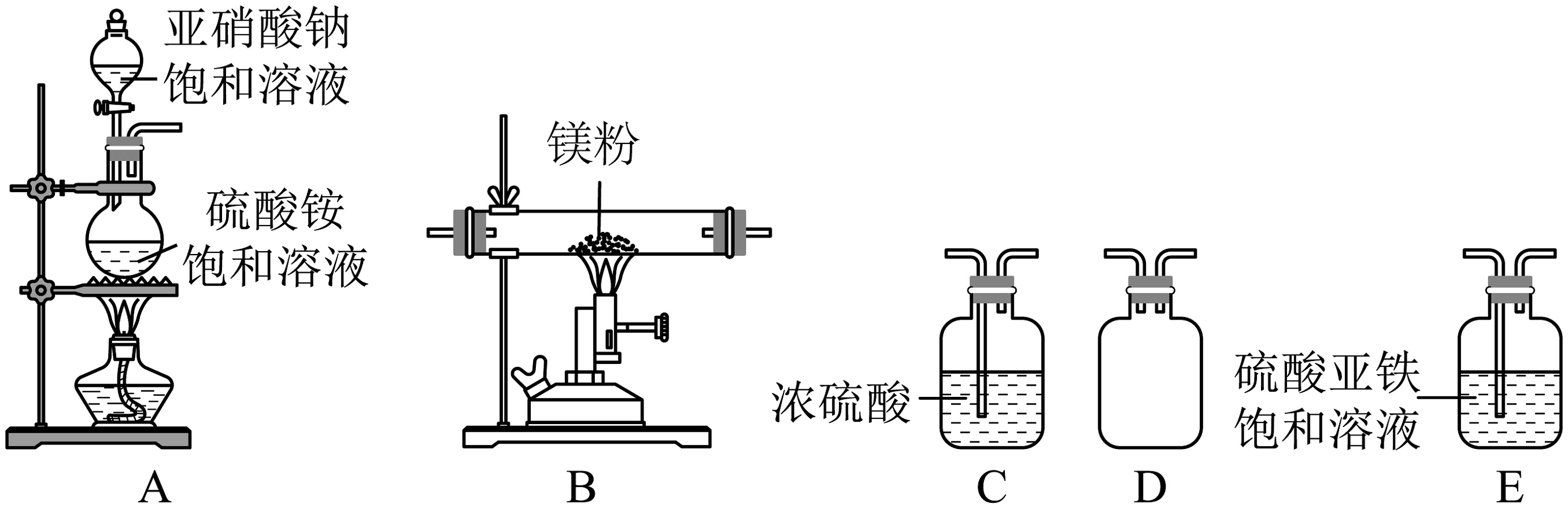
(1)上述装置正确的连接顺序是:。
A→___________→___________→___________→B→C(必要时可重复使用)
(2)装置A中装溶液的仪器名称为。饱和溶液的作用。
Ⅱ.常温下和水反应缓慢,反应时,条表面缓慢产生少量气泡,数分钟后反应停止,未收集到气体,镁条表面失去光泽。
查阅资料:与水反应时,表面覆盖了致密的导致反应缓慢;和可以加快Mg与水反应。
同学们为了验证和对与水反应的促进作用,用与水反应后的条与4种盐溶液进行对比实验,结果如下。
实验序号
a
b
c
d
盐溶液(均为)
NaCl
溶液起始
5.1
8.3
7.0
7.8
30min时产生气体体积/mL
1.5
0.7
<0.1
1.4
气体的主要成分
30min时镁条表面情况
大量固体附着(固体可溶于盐酸)
(3)根据的沉淀溶解平衡可解释和的作用。在水中存在的沉淀溶解平衡可用离子方程式表示为。
(4)经检验,a中还生成少量其他气体,可进一步证明促进与水反应,检验该气体的方法是。
(5)上表中能够说明对与水反应起促进作用的证据是。
(6)b、d所得固体中还检验出碱式碳酸镁[用表示],写出生成该固体的离子方程式。
(7)综合实验a-d可以得到的结论是:和都能与作用加快与水反应,;(补充两点)。
-
13、第二代钠离子电池是以嵌钠硬碳()和锰基高锰普鲁士白为电极的新型二次电池,充电时嵌入硬碳,放电时发生脱嵌,其工作原理如图所示。下列说法正确的是
 A、充电时,a接电源的负极 B、充电时,B极反应为 C、放电时,穿过离子交换膜向B极移动 D、放电时,每转移1mol电子,A极质量减少23g
A、充电时,a接电源的负极 B、充电时,B极反应为 C、放电时,穿过离子交换膜向B极移动 D、放电时,每转移1mol电子,A极质量减少23g -
14、丙烯与HBr发生加成反应,存在以下两种途径:

已知:1-溴丙烷的能量大于2-溴丙烷的能量。两个途径的反应过程,其图像如下:
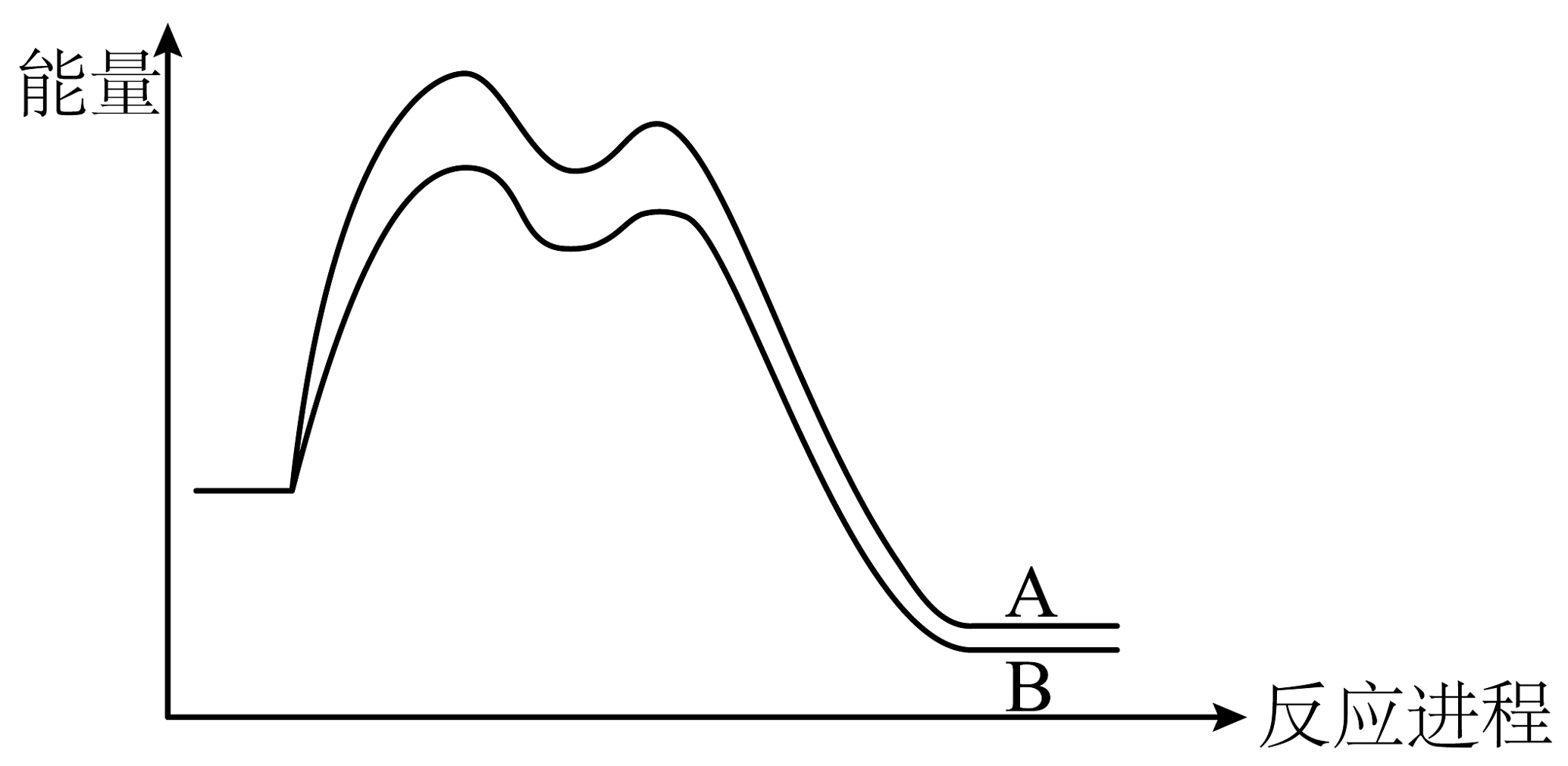
下列说法正确的是
A、相同条件下,生成2-溴丙烷的速率快 B、相同条件下,生成1-溴丙烷的产率高 C、生成两种溴代产物时,决速步均由第二步反应决定 D、
-
15、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
向蛋白质溶液中加入饱和溶液,有白色沉淀
蛋白质遇到盐溶液会发生变性
B
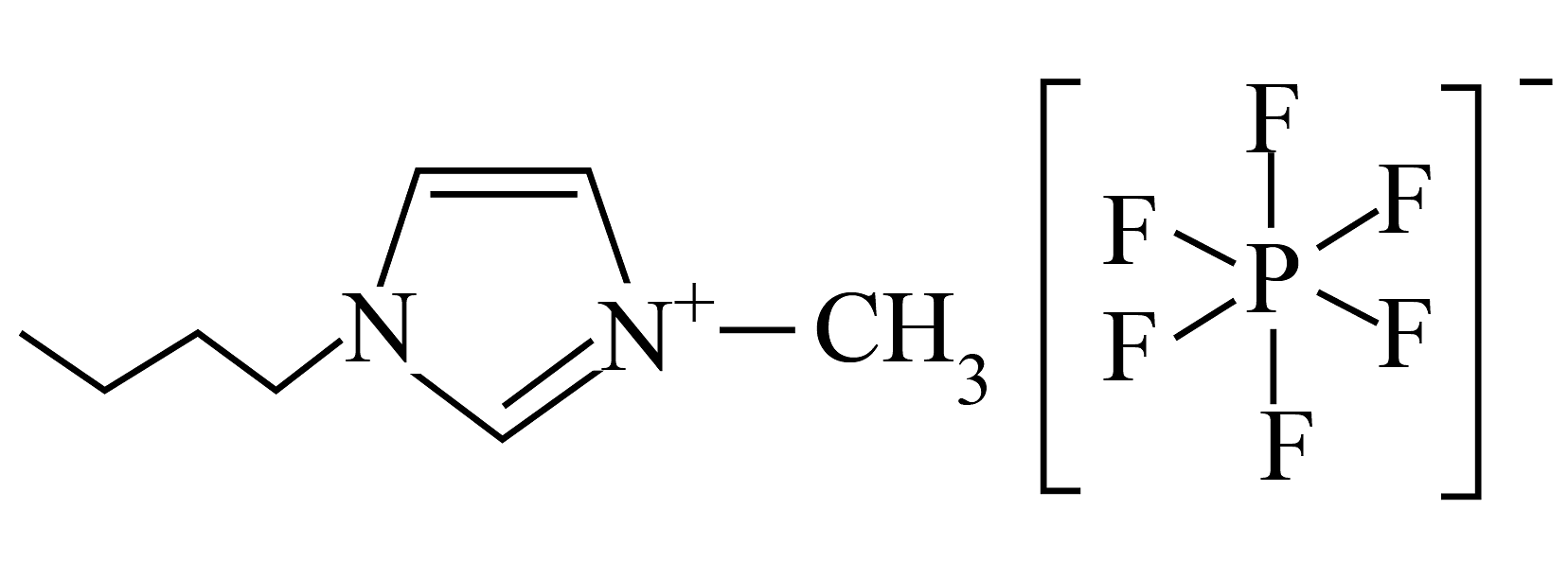 为离子化合物,常温下呈液态
为离子化合物,常温下呈液态阴、阳离子的体积大,离子键弱,熔点低
C
的沸点比的高
中的键能大于中的键能
D
工业上电解熔融冶炼铝
的熔点比低
A、A B、B C、C D、D -
16、原子序数依次增大的短周期主族元素、、、、组成的一种化合物结构如图所示,其中Z、E同族,基态Y原子的核外有3个未成对电子。下列说法正确的是
 A、第一电离能: B、含有离子键和非极性键 C、简单离子半径: D、的空间结构为平面三角形
A、第一电离能: B、含有离子键和非极性键 C、简单离子半径: D、的空间结构为平面三角形 -
17、按下图装置进行实验(夹持装置省略),下列判断正确的是
 A、甲装置试管中的固体是 B、乙中a处比b处先变蓝 C、由于与酸产生铵盐,丙中有白烟 D、因为极易溶于水,所以丁中会产生倒吸
A、甲装置试管中的固体是 B、乙中a处比b处先变蓝 C、由于与酸产生铵盐,丙中有白烟 D、因为极易溶于水,所以丁中会产生倒吸 -
18、已知:反应常用来判断输送的管道是否漏气。设为阿伏加德罗常数的值。下列说法正确的是A、通入水中充分反应,溶液中分子数为 B、溶液中,含离子数为 C、中含极性键的个数为 D、含有键数为
-
19、实验室制取并验证其性质,下列装置及操作能达到相应实验目的的是
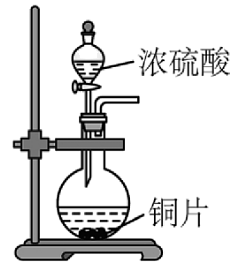

A.生成
B.验证的漂白性


C.干燥
D.吸收
A、A B、B C、C D、D -
20、化学之美无处不在。下列说法正确的是A、水可形成晶莹剔透的晶体冰,冰中存在氢键 B、绚丽的焰火与电子跃迁时产生的吸收光谱有关 C、手性分子互为镜像,能在三维空间里叠合 D、呈现规则多面体外形的金刚石为分子晶体