相关试卷
-
1、下列化学用语或图示正确的是A、基态Mn原子价层电子轨道表示式:
 B、键形成的轨道重叠示意图:
B、键形成的轨道重叠示意图: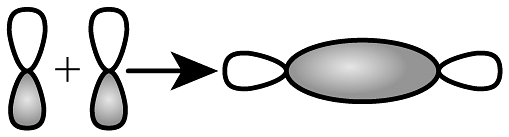 C、二氧化碳的空间填充模型:
C、二氧化碳的空间填充模型: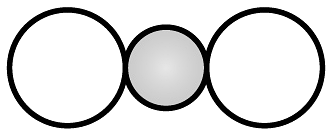 D、的离子结构示意图:
D、的离子结构示意图: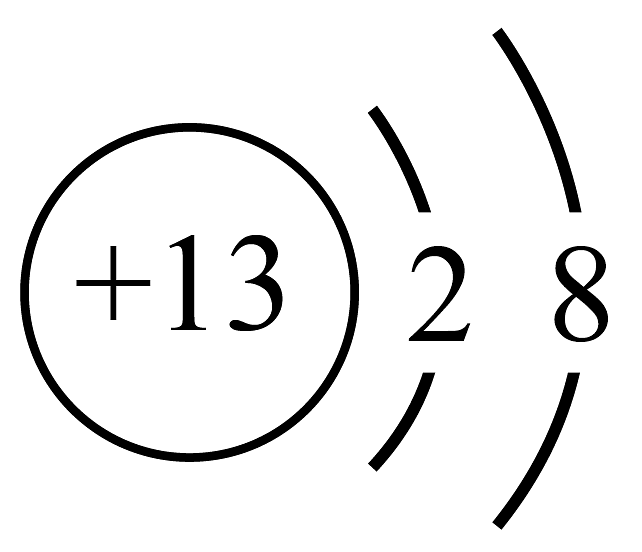
-
2、化学与生产生活、科技密切相关。下列说法正确的是A、“奋斗者号”潜水器含钛合金,其熔点、强度都高于纯钛金属 B、高强度芳纶纤维(聚对苯二甲酰对苯二胺)可通过缩聚反应合成 C、美缝剂-环氧彩砂中的石英砂与金刚砂属于同素异形体 D、利用合成脂肪酸,实现了无机小分子向有机高分子的转变
-
3、一种水性电解液可充电电池如图所示。下列叙述错误的是
 A、放电时,M电极是正极 B、放电时,N电极反应: C、充电时,Ⅱ区中溶液的浓度减小 D、充电时,转移 , Ⅲ区溶液质量减少
A、放电时,M电极是正极 B、放电时,N电极反应: C、充电时,Ⅱ区中溶液的浓度减小 D、充电时,转移 , Ⅲ区溶液质量减少 -
4、化合物L是一种黄酮类物质,对某些微生物具有一定的抗菌活性,其合成路线如下图所示:

已知:
①

②R3-CHO+


回答下列问题:
(1)、A的名称是。(2)、C→D第ⅰ步反应的化学方程式为。(3)、E中官能团的名称为。(4)、I的结构简式为;J→K的反应类型是。(5)、F→G的化学方程式为;F转化为G的过程中加入可提高产率,其原因是。(6)、D有多种同分异构体,其中满足下列条件的同分异构体有种;①能与发生显色反应;②能与碳酸钠反应生成二氧化碳
其中,核磁共振氢谱显示五组峰,且峰面积之比为2∶2∶2∶1∶1的同分异构体的结构简式为。
-
5、“双碳战略”有利于实现碳减排,促进生态环境改善。利用氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。主要反应如下:
I.
II.
III.
回答下列问题:
(1)、有利于同时提高平衡产率和反应速率的措施是_______(填字母)。A、升高温度 B、加入催化剂 C、增大压强 D、增大氢气浓度(2)、在一定温度下、压强为P kPa条件下,向某恒压密闭容器中加入1mol 和4mol , 若只发生反应I,达到平衡后,测得容器中转化率为70%,则此时反应I的压强平衡常数(列出计算表达式)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)、反应II实验测得 , (、为速率常数),若升高温度,值(填“增大”“减小”或“不变”)。(4)、一定温度时,向某固定容积的容器中充入一定量的和1mol CO,平衡时和CO的转化率()及和的物质的量(n)随变化的曲线如图所示。
①图中表示和变化的曲线分别是、(填编号);
②m=;
③的选择性为(已知的选择性为)。
(5)、研究者利用电解法实现了和两种分子的耦合转化,其原理如图所示。则阴极上的反应式为;同温同压下,若生成的乙烷和乙烯的体积比为4∶1,则消耗的和的体积比为。
-
6、
氯气在有机合成和无机化工中都有着广泛的应用,现用氯气和其他原料分别制备氯苯和。实验中可能用到的装置如图所示(其中夹持仪器已略)。

已知:
①苯及其生成物的沸点如下表所示。
有机物
苯
氯苯(
 )
)邻二氯苯
间二氯苯
对二氯苯
沸点/℃
80.0
132.2
180.4
172.0
173.4
②苯与干燥的氯气在催化剂作用下发生取代反应生成氯苯,同时会有少量副产物二氯苯。
③易潮解;不易被氧化,具有较强还原性,易被氧化。
回答下列问题:
I.氯苯的制备
①向反应器(内有铁屑作催化剂)中滴入苯,通入氯气,维持反应温度在50~60℃,回流40min。
②将反应后的液体倒入分液漏斗中,分别用蒸馏水和NaOH溶液洗涤,分离出的产物干燥后,进行蒸馏纯化,得到纯净的氯苯。
(1)从所给装置中选择制氯苯需要用到的装置________(填大写字母);图中X仪器使用时冷水从(填“m”或“n”)________口进入;Y仪器的名称是________。
(2)仪器A中盛有高锰酸钾晶体,该装置中发生反应的离子方程式为________。
(3)下列有关该实验说法正确的是_______(填字母)。
A. 制备氯苯时用酒精灯直接加热 B. 回流的主要目的是让苯和氯气回流以提高转化率和产率 C. 碱洗前先进行水洗的目的是洗去产品中的、HCl,节省碱的用量,降低成本 D. 蒸馏温度控制在80.0℃可收集产品 (4)氯苯的产率低于理论产率的可能原因是________(填写一条)。
II.(三氯化六氨合钴,Mr=267.5)的制备制备步骤如下:
①用金属钴与氯气反应制备;
②在100mL锥形瓶内加入13.0g研细的、9.3g 和10mL水,加热溶解后加入0.3g活性炭作催化剂;
③冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入25mL (足量)溶液;
④经过一系列操作,得到橙黄色的晶体21.4g。
(5)用图中的装置组合制备 , 仪器的连接顺序为a→________(填小写字母)。
(6)在制备时,先加入浓氨水后滴加的原因是________。
(7)制得产品的产率为________%(精确到0.1%)。
-
7、金属镓被称为“电子工业脊梁”,氮化镓(GaN)、氧化镓是第三代、第四代半导体的主要材料。由炼锌矿渣[主要含铁酸锌、铁酸镓、钛酸亚铁、]制取氮化镓的部分工艺流程如下所示:

已知:
①镓和铝同主族,化学性质相似;20℃氯化镓的溶解度为180g,且温度升高,溶解度明显增大;
②“酸浸”时,钛元素以形式存在,室温下极易水解得到;矿渣经“酸浸”后所得“浸出液”中含有、、、等离子;
③金属离子形成氢氧化物沉淀的pH及金属离子的萃取率,如下表:
金属离子
开始沉淀pH
8.0
1.7
5.5
3.0
0.4
沉淀完全pH
9.6
3.2
8.0
4.9
1.1
萃取率(%)
0
99
0
97~98.5
回答下列问题:
(1)、Ga元素的价电子轨道表示式为。(2)、“酸浸”时发生反应的离子方程式为。(3)、“滤液2”可用于回收硫酸锌,则“滤液1”需调节的pH范围是;加入的“固体M”为(写化学式)。(4)、反萃取后水溶液中镓元素以(用化学用语表示)形式存在。(5)、“操作4”是指、、冷却结晶、过滤、洗涤、干燥。(6)、“高温气相沉积”中镓先转化为 , 然后再与发生反应,写出与反应生成GaN的化学方程式:。(7)、测定钛白粉中的含量可用滴定分析法:取1.000g样品充分溶于过量稀硫酸中,再加入铝粉将钛元素转化为 , 过滤,将滤液用稀硫酸稀释至100mL。取20mL于锥形瓶中,滴加2~3滴KSCN溶液,用0.1000mol/L的标准溶液进行滴定(能将氧化成四价钛的化合物),重复上述滴定操作两次,平均消耗标准溶液23.00mL。①上述滴定的终点现象为。
②钛白粉中的质量分数为。
-
8、制造尼龙-66的原料己二腈[]用量很大,工业上常采用丙烯腈()电合成法来制备。其工作原理如图所示。已知比得电子能力强。下列说法正确的是
 A、b极为阳极,电极材料可改为Fe B、甲室的电极反应式为 C、甲室中加入磷酸四乙基铵,其阳离子覆盖在电极表面,以抑制水电离出过多 D、若在乙室产生标准状况下44.8L , 理论上可制备216g
A、b极为阳极,电极材料可改为Fe B、甲室的电极反应式为 C、甲室中加入磷酸四乙基铵,其阳离子覆盖在电极表面,以抑制水电离出过多 D、若在乙室产生标准状况下44.8L , 理论上可制备216g -
9、一定条件下,丙烯与HCl发生加成反应: , , 其反应历程如图所示。下列说法正确的是
(已知:的选择性)。
 A、丙烯与HCl的加成反应一定能自发进行 B、一定温度下,对丙烯与HCl的加成反应增大压强,平衡正向移动,平衡常数增大 C、根据该反应推测,相同条件下丙烯与HBr加成产物中2-溴丙烷的选择性较高 D、其他条件不变,降低温度,体系中增大
A、丙烯与HCl的加成反应一定能自发进行 B、一定温度下,对丙烯与HCl的加成反应增大压强,平衡正向移动,平衡常数增大 C、根据该反应推测,相同条件下丙烯与HBr加成产物中2-溴丙烷的选择性较高 D、其他条件不变,降低温度,体系中增大 -
10、水的电离常数如图两条曲线所示,曲线中的点都符合常数。下列说法正确的是
 A、纯水中时大于时 , 则水的电离放热 B、曲线上任意点的溶液均呈中性,且一定是纯水 C、温度T:;水的离子积常数:D点>C点 D、B点时,将pH=2的稀硫酸与pH=11的NaoH溶液等体积混合后,溶液显碱性
A、纯水中时大于时 , 则水的电离放热 B、曲线上任意点的溶液均呈中性,且一定是纯水 C、温度T:;水的离子积常数:D点>C点 D、B点时,将pH=2的稀硫酸与pH=11的NaoH溶液等体积混合后,溶液显碱性 -
11、氢气是重要的绿色能源。工业上制取氢气涉及的主要热化学方程式有:
①
②
③
已知H-H键能为a kJ/mol,O-H键能为b kJ/mol,C=O键能为c kJ/mol,则CO(g)的碳氧键键能(单位:kJ/mol)为
A、 B、 C、 D、 -
12、如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,W、Y原子中未成对电子数均为3。下列说法正确的是
 A、两种化合物中都有一个苯环 B、原子半径:Z>Y>X>W C、最高价含氧酸的酸性:X>Z>W>Y D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
A、两种化合物中都有一个苯环 B、原子半径:Z>Y>X>W C、最高价含氧酸的酸性:X>Z>W>Y D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物 -
13、某钙钛矿型太阳能电池吸光材料的晶胞如图所示,其中A为 , 可由分子制得,晶胞参数为a nm,为阿伏加德罗常数的值。下列说法错误的是
 A、1mol 中含有7NAσ键 B、与最近距离的数为8 C、该晶体属于混合型晶体 D、晶胞密度的计算式为
A、1mol 中含有7NAσ键 B、与最近距离的数为8 C、该晶体属于混合型晶体 D、晶胞密度的计算式为 -
14、下列实验操作与现象,得出的结论错误的是
选项
实验操作与现象
结论
A
将充满的玻璃球浸泡在冰水中,红棕色变浅
△H<0
B
用pH试纸测0.01mol/L 溶液的酸碱性,试纸显红色
是弱酸
C
向含有酚酞的溶液中加入少量固体,溶液红色变浅
溶液中存在水解平衡
D
室温下,向0.1mol/L NaCl和0.01mol/L NaI混合溶液中逐滴滴加溶液,立即出现黄色沉淀
相同温度下:(AgCl)>(AgI)
A、A B、B C、C D、D -
15、已知反应 , 为阿伏加德罗常数的值,若消耗44.8L(标准状况) , 下列叙述正确的是A、转移的电子数为12 B、反应的分子数为3 C、生成的中Si-N键数为4 D、生成的CO含有的孤电子对数为6
-
16、使用含氟牙膏是目前应用最广泛的预防龋齿的措施。添入牙膏中的氟化物主要有一氟磷酸钠()等。下列说法错误的是A、一氟磷酸钠水溶液呈碱性 B、和的空间结构均为正四面体形 C、预防龋齿的原理是 D、的溶解度比小
-
17、下列离子方程式中,正确的是A、向稀中滴加少量溶液: B、向溶液中加入少量: C、向溶液中通入少量: D、向溶液中加入过量NaOH溶液并加热:
-
18、下列实验装置及操作能达到相应实验目的的是
 A、配制500mL饱和溶液 B、制备氢氧化铁胶体 C、分离得到氢氧化铁胶体 D、将氢氧化铁胶体转化为氢氧化铁沉淀
A、配制500mL饱和溶液 B、制备氢氧化铁胶体 C、分离得到氢氧化铁胶体 D、将氢氧化铁胶体转化为氢氧化铁沉淀 -
19、有机物M是一种药物合成中间体,其结构简式如图所示。下列有关说法错误的是
 A、M的分子式为 B、M分子中含有四种官能团和1个手性碳原子 C、1mol M与足量氢气反应可消耗5mol D、M既能与盐酸反应又能与氢氧化钠反应
A、M的分子式为 B、M分子中含有四种官能团和1个手性碳原子 C、1mol M与足量氢气反应可消耗5mol D、M既能与盐酸反应又能与氢氧化钠反应 -
20、明矾晶体的培养需要加入铬钾矾晶体,铬钾矾晶体中含有H、O、S、K、Cr五种元素。下列说法正确的是A、Cr位于元素周期表第ⅥB族 B、5种元素中,第一电离能最大的是S C、5种元素中,电负性最小的是H D、基态时,S原子和K原子的单电子数相等