相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、
(以下题目中的图片根据回忆所得信息结合文献资料重新整合所得,仅供参考)
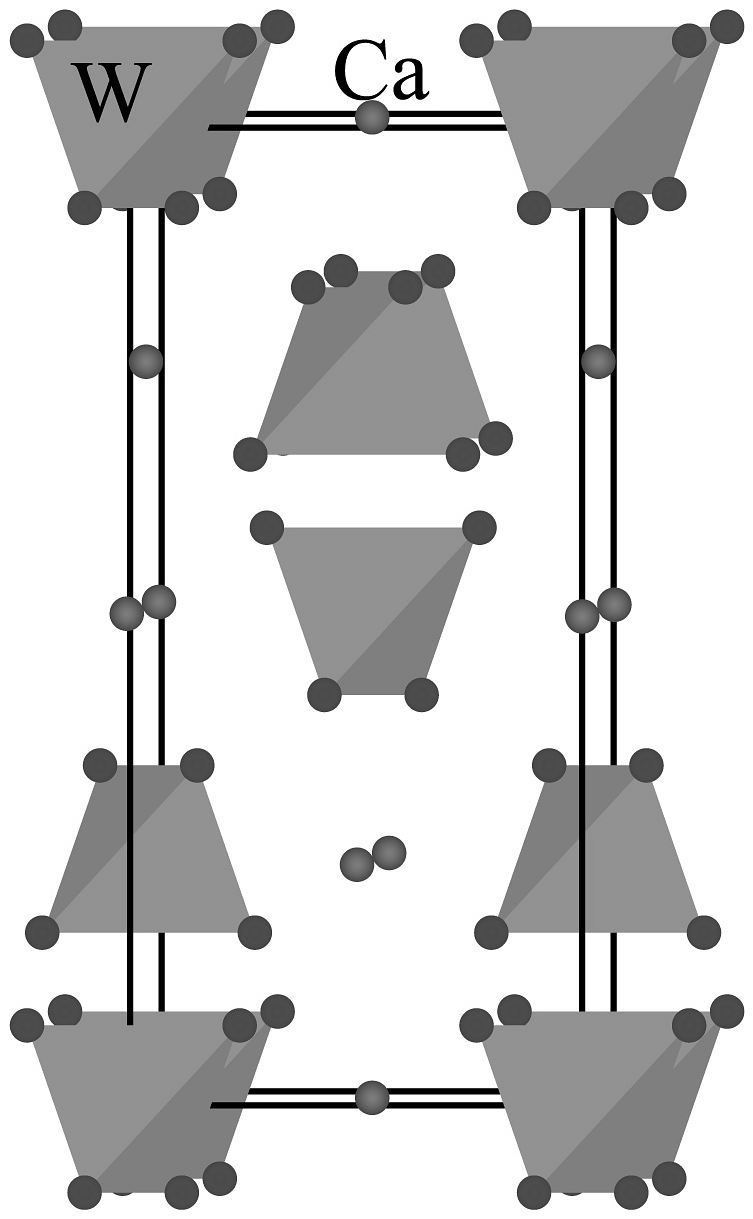
(1)钨作灯丝与_______性质有关(不定项)。
A.延展性 B导电性 C.高熔点 D.高密度
(2)钨有金属光泽的原因________ (从微观角度解释)。(3)原子在晶胞中的_______位置。
A. 顶点 B. 棱上 C. 面上 D. 体心 (4)钨在周期表中的位置是_______。

A. 第五周期第ⅡB族 B. 第五周期第ⅣB族 C. 第六周期第ⅡB族 D. 第六周期第ⅥB族 (5)根据价层电子对斥理论,的价层电子对数是________。
(6)图晶胞号O原子,若晶胞仅含1个完整四面体,组成该四面体的O编号是________。
表格(各种矿石密度)。

(7)给出晶胞参数,求并说明“重石头”俗名依据________。(有V和M?)
电解制备是光电陶瓷材料
已知
(8)写出电解的阳极方程式________。
(9)为获取高纯产物,制备时需要不断通入的原因________。
-
2、
已知反应1
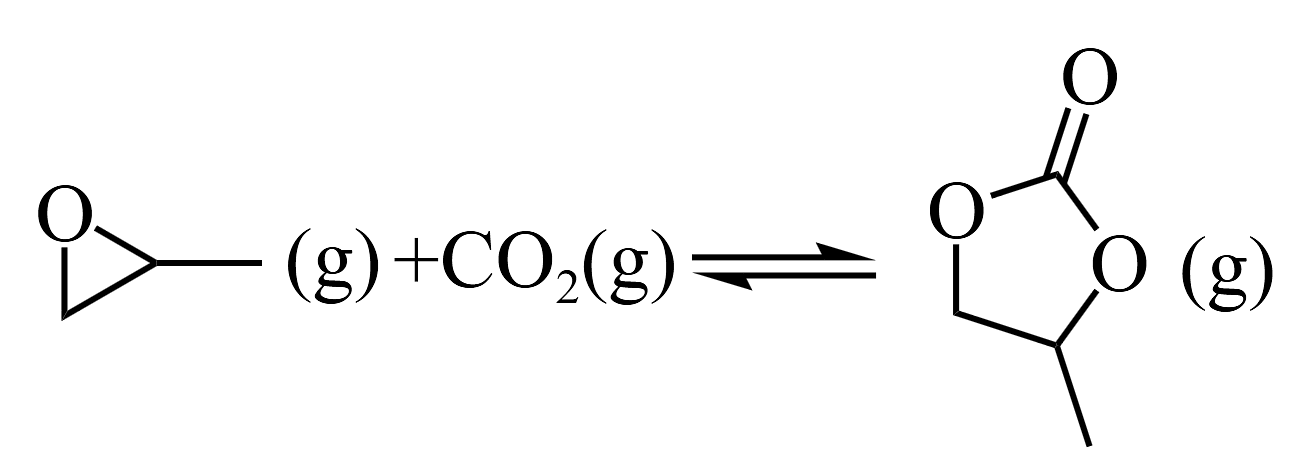 的
的反应2的
反应3的
反应4的
物质
环氧丙烷
(1)计算出_______。
A. B. 613.2 C. 395.2 D. (2)随温度T的变化趋势________。
(3)
 中电负性最大的是________。
中电负性最大的是________。A.C B.H C.O
(4)
 分了中键的数目为_______。
分了中键的数目为_______。A. 7 B. 12 C. 13 D. 14 已知:环氧丙烷生成
 会发生副反应
会发生副反应选择性=转化生成A的环氧丙烷/消耗环氧丙烷
M(环氧丙烷) ρ(环氧丙烷)
容器容积的高压反应釜反应后体积缩小为 , 选择性为95%,反应。
(5)求环氧丙烷的化学反应速率________(精确到小数点后2位)
(6)下列哪种操作可以使得活化分子的百分数变大_______。
A. 升高温度 B. 增大浓度 C. 压缩容器 D. 充入惰性气体 (7)碳酸丙烯酯相同时间内随温度变化如图所示,请解释产率随温度先升后下降的原因________。
(8)达到平衡的判据_______。
A. v正=v逆 B. 体系总质量不变 C. 气体体积不再变化 D. 混合气体密度(可能是摩尔质量)不变 (9)制备
 还有一种光气法,用
还有一种光气法,用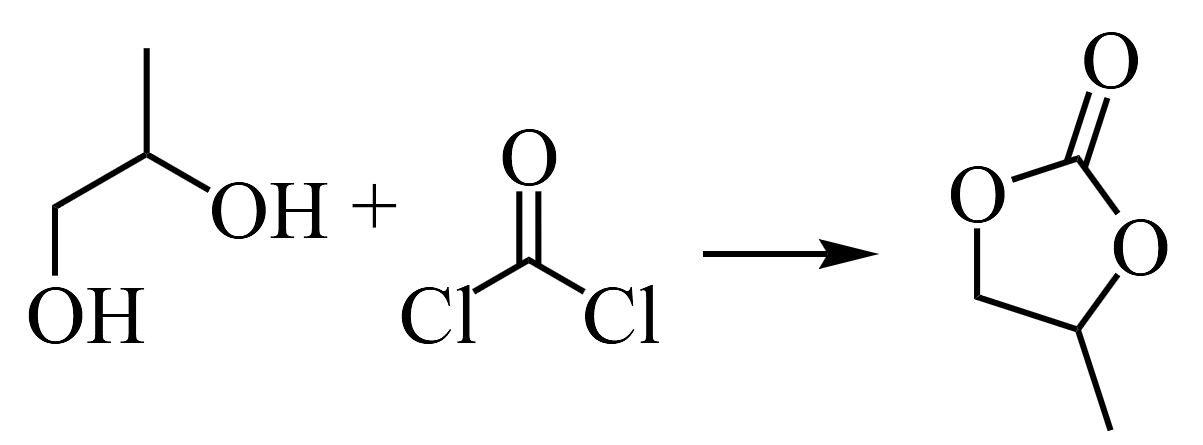 。请从绿色化学的角度解释,写出3点与光气-二醇法相比,法合成的优势________。
。请从绿色化学的角度解释,写出3点与光气-二醇法相比,法合成的优势________。 -
3、我国科学家最近在光-酶催化合成中获得重大突破,光-酶协同可实现基于三组分反应的有机合成,其中的一个反应如下(反应条件略:Ph-代表苯基)。
 (1)、化合物1a中含氧官能团的名称为。(2)、①化合物2a的分子式为。
(1)、化合物1a中含氧官能团的名称为。(2)、①化合物2a的分子式为。②2a可与发生加成反应生成化合物Ⅰ.在Ⅰ的同分异构体中,同时含有苯环和醇羟基结构的共种(含化合物Ⅰ)。
(3)、下列说法正确的有_______。A、在1a、2a和3a生成4a的过程中,有键断裂与键形成 B、在4a分子中,存在手性碳原子,并有20个碳原子采取杂化 C、在5a分子中,有大键,可存在分子内氢键,但不存在手性碳原子 D、化合物5a是苯酚的同系物,且可发生原子利用率为100%的还原反应(4)、一定条件下,与丙酮发生反应,溴取代丙酮中的 , 生成化合物3a.若用核磁共振氢谱监测该取代反应,则可推测:与丙酮相比,产物3a的氢谱图中。(5)、已知:羧酸在一定条件下,可发生类似于丙酮的取代反应。根据上述信息,分三步合成化合物Ⅱ。
①第一步,引入溴:其反应的化学方程式为。
②第二步,进行(填具体反应类型):其反应的化学方程式为(注明反应条件)。
③第三步,合成Ⅱ:②中得到的含溴有机物与1a、2a反应。
(6)、参考上述三组分反应,直接合成化合物Ⅲ,需要以1a、(填结构简式)和3a为反应物。
-
4、钛单质及其化合物在航空、航天、催化等领域应用广泛。(1)、基态Ti原子的价层电子排布式为。(2)、298K下,反应的、 , 则298K下该反应(填“能”或“不能”)自发进行。(3)、以为原料可制备。将与10.0molTi放入容积为的恒容密闭容器中,反应体系存在下列过程。
编号
过程
(a)
(b)
(c)
(d)
①kJ/mol。
②不同温度下,平衡时反应体系的组成如图。曲线Ⅰ对应的物质为。

③温度下, , 反应(c)的平衡常数(列出算式,无须化简)。
(4)、钛基催化剂可以催化储氢物质肼的分解反应:(e)
(f)
为研究某钛基催化剂对上述反应的影响,以肼的水溶液为原料(含的物质的量为),进行实验,得到、随时间t变化的曲线如图。其中,为与的物质的量之和;为剩余的物质的量。设为0~t时间段内反应(e)消耗的物质的量,该时间段内,本体系中催化剂的选择性用表示。

①内,的转化率为(用含的代数式表示)。
②内,催化剂的选择性为(用含与的代数式表示,写出推导过程)。
-
5、我国是金属材料生产大国,绿色生产是必由之路。一种从多金属精矿中提取Fe、Cu、Ni等并探究新型绿色冶铁方法的工艺如下。

已知:多金属精矿中主要含有Fe、Al、Cu、Ni、O等元素。
氢氧化物
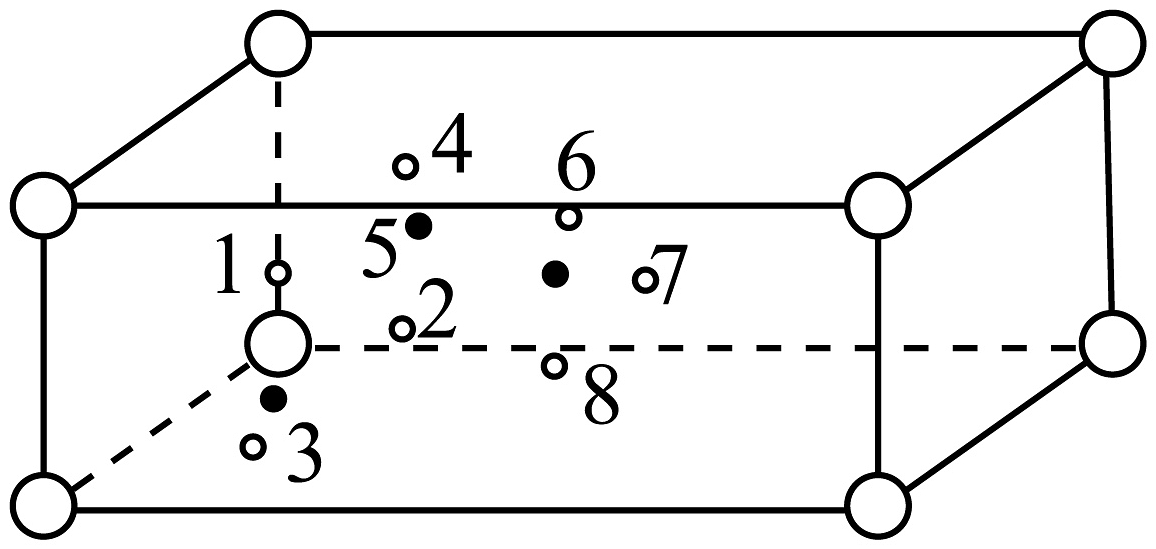
(1)、“酸浸”中,提高浸取速率的措施有(写一条)。(2)、“高压加热”时,生成的离子方程式为:。(3)、“沉铝”时,pH最高可调至(溶液体积变化可忽略)。已知:“滤液1”中 , 。(4)、“选择萃取”中,镍形成如图的配合物。镍易进入有机相的原因有_______。 A、镍与N、O形成配位键 B、配位时被还原 C、配合物与水能形成分子间氢键 D、烷基链具有疏水性(5)、晶体的立方晶胞中原子所处位置如图。已知:同种位置原子相同,相邻原子间的最近距离之比 , 则;晶体中与Cu原子最近且等距离的原子的数目为。
A、镍与N、O形成配位键 B、配位时被还原 C、配合物与水能形成分子间氢键 D、烷基链具有疏水性(5)、晶体的立方晶胞中原子所处位置如图。已知:同种位置原子相同,相邻原子间的最近距离之比 , 则;晶体中与Cu原子最近且等距离的原子的数目为。 (6)、①“700℃加热”步骤中,混合气体中仅加少量 , 但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为和。
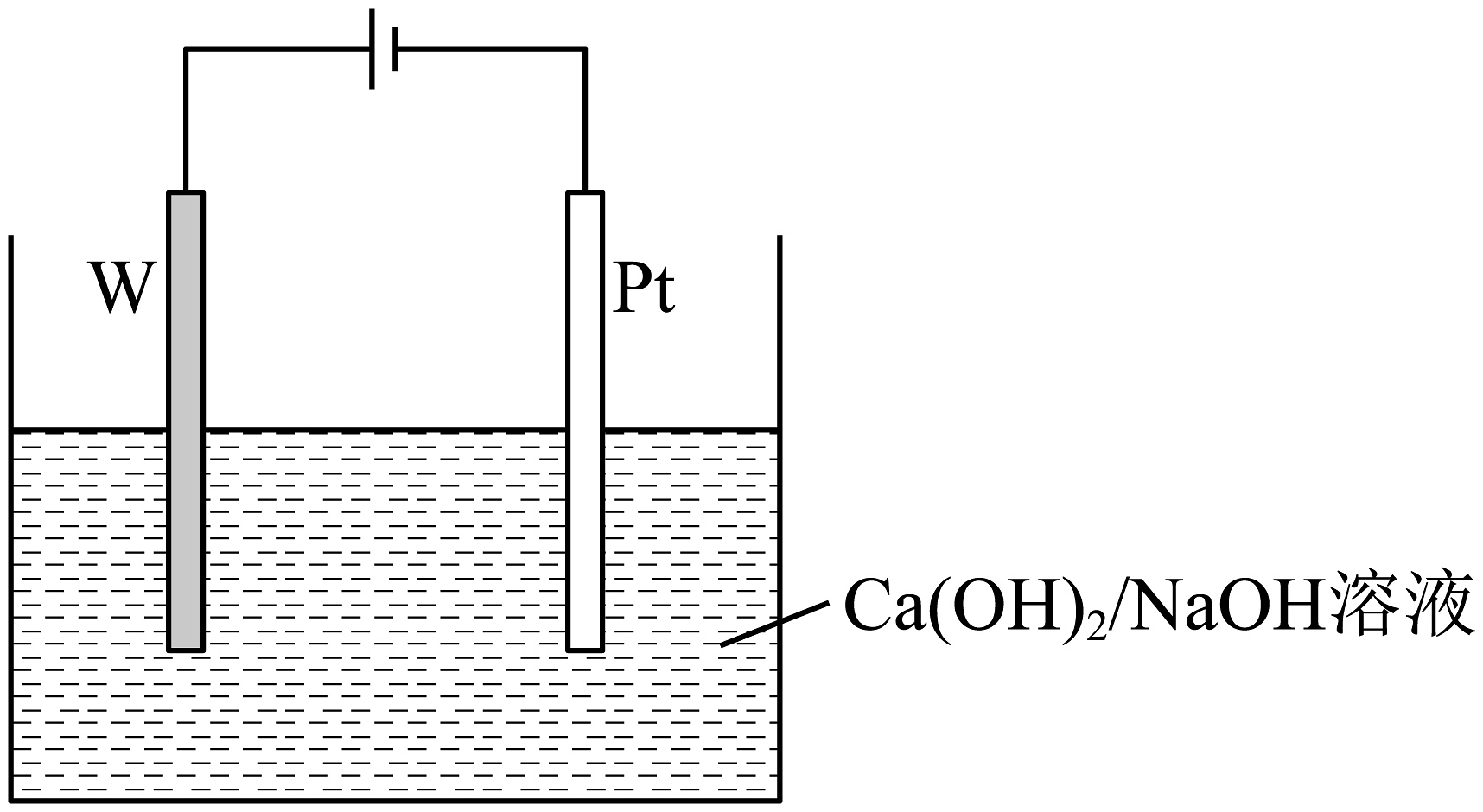
(6)、①“700℃加热”步骤中,混合气体中仅加少量 , 但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为和。②“电解”时,颗粒分散于溶液中,以Fe片、石墨棒为电极,在答题卡虚线框中,画出电解池示意图并做相应标注。
③与传统高炉炼铁工艺相比,上述两种新型冶铁方法所体现“绿色化学”思想的共同点是(写一条)。
-
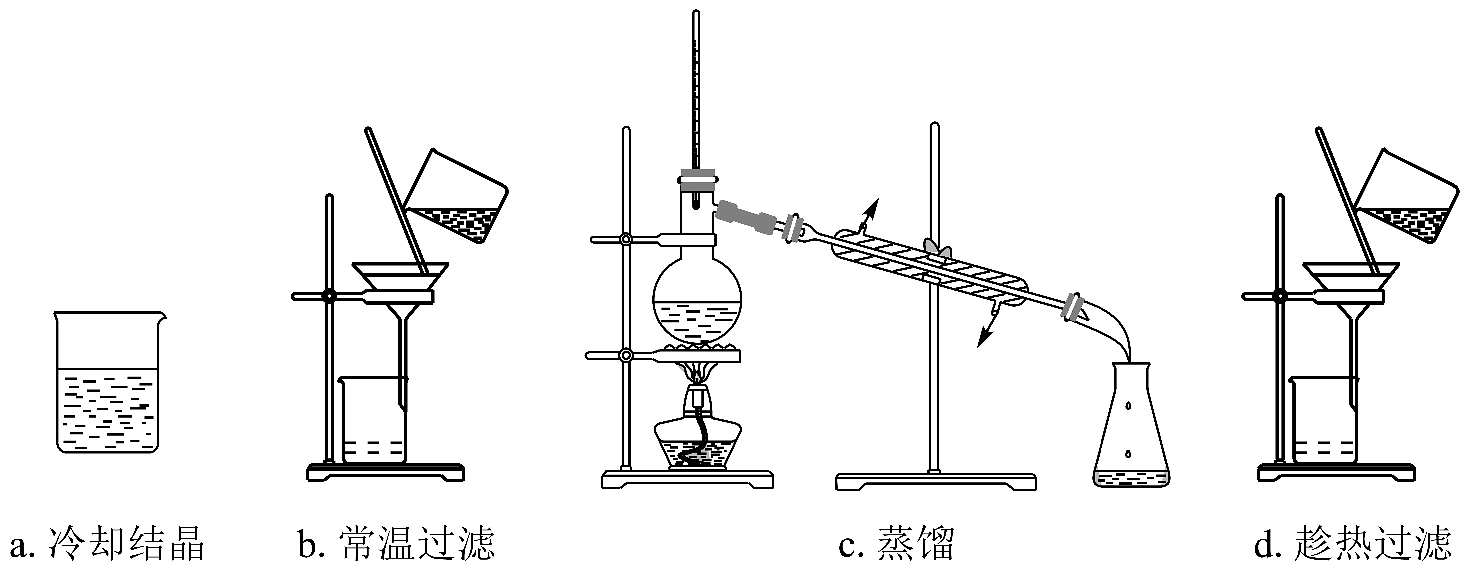
6、酸及盐在生活生产中应用广泛。(1)、甲苯氧化可生成苯甲酸。向盛有2mL甲苯的试管中,加入几滴酸性溶液,振荡,观察到体系颜色。(2)、某苯甲酸粗品含少量泥沙和氯化钠。用重结晶法提纯该粗品过程中,需要的操作及其顺序为:加热溶解、(填下列操作编号)。
 (3)、兴趣小组测定常温下苯甲酸饱和溶液的浓度和苯甲酸的 , 实验如下:取50.00mL苯甲酸饱和溶液,用溶液滴定,用pH计测得体系的pH随滴入溶液体积V变化的曲线如图。据图可得:
(3)、兴趣小组测定常温下苯甲酸饱和溶液的浓度和苯甲酸的 , 实验如下:取50.00mL苯甲酸饱和溶液,用溶液滴定,用pH计测得体系的pH随滴入溶液体积V变化的曲线如图。据图可得:
①。
②苯甲酸的(列出算式,水的电离可忽略)。
(4)、该小组继续探究取代基对芳香酸酸性的影响。①知识回顾 羧酸酸性可用衡量。下列羧酸的变化顺序为:。随着卤原子电负性 , 羧基中的羟基增大,酸性增强。
②提出假设 甲同学根据①中规律推测下列芳香酸的酸性强弱顺序为:

③验证假设 甲同学测得常温下三种酸的饱和溶液的pH大小顺序为Ⅲ>Ⅱ>Ⅰ,据此推断假设成立。但乙同学认为该推断依据不足,不能用所测得的pH直接判断大小顺序,因为。
乙同学用(3)中方法测定了上述三种酸的 , 其顺序为Ⅱ>Ⅰ>Ⅲ。
④实验小结 假设不成立,芳香环上取代基效应较复杂,①中规律不可随意推广。
(5)、该小组尝试测弱酸HClO的。①丙同学认为不宜按照(3)中方法进行实验,其原因之一是次氯酸易分解。该分解反应的离子方程式为。
②小组讨论后,选用0.100mol/LNaClO溶液(含少量NaCl)进行实验,以获得HClO的。简述该方案(包括所用仪器及数据处理思路)。
③教师指导:设计实验方案时,需要根据物质性质,具体问题具体分析。
-
7、某理论研究认为:燃料电池(图b)的电极Ⅰ和Ⅱ上所发生反应的催化机理示意图分别如图a和图c,其中获得第一个电子的过程最慢。由此可知,理论上
 A、负极反应的催化剂是ⅰ B、图a中,ⅰ到ⅱ过程的活化能一定最低 C、电池工作过程中,负极室的溶液质量保持不变 D、相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
A、负极反应的催化剂是ⅰ B、图a中,ⅰ到ⅱ过程的活化能一定最低 C、电池工作过程中,负极室的溶液质量保持不变 D、相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同 -
8、按如图组装装置并进行实验:将铜丝插入溶液中,当c中红色褪去时,将铜丝拔离液面。下列叙述错误的是
 A、a中有化合反应发生,并有颜色变化 B、b中气体变红棕色时,所含氮氧化物至少有两种 C、c中溶液红色刚好褪去时,恰好完全反应 D、若将a中稀硝酸换为浓硫酸并加热,则c中溶液颜色会褪去
A、a中有化合反应发生,并有颜色变化 B、b中气体变红棕色时,所含氮氧化物至少有两种 C、c中溶液红色刚好褪去时,恰好完全反应 D、若将a中稀硝酸换为浓硫酸并加热,则c中溶液颜色会褪去 -
9、一种高容量水系电池示意图如图。已知:放电时,电极Ⅱ上减少;电极材料每转移1mol电子,对应的理论容量为。下列说法错误的是
 A、充电时Ⅱ为阳极 B、放电时Ⅱ极室中溶液的pH降低 C、放电时负极反应为: D、充电时16gS能提供的理论容量为
A、充电时Ⅱ为阳极 B、放电时Ⅱ极室中溶液的pH降低 C、放电时负极反应为: D、充电时16gS能提供的理论容量为 -
10、由结构不能推测出对应性质的是
选项
结构
性质
A
的VSEPR模型为平面三角形
具有氧化性
B
钾和钠的原子结构不同,电子跃迁时能量变化不同
钾和钠的焰色不同
C
乙烯和乙炔分子均含有键
两者均可发生加聚反应
D
石墨层中未参与杂化的p轨道中的电子,可在整个碳原子平面中运动
石墨具有类似金属的导电性
A、A B、B C、C D、D -
11、CuCl微溶于水,但在浓度较高的溶液中因形成和而溶解。将适量CuCl完全溶于盐酸,得到含和的溶液,下列叙述正确的是A、加水稀释,浓度一定下降 B、向溶液中加入少量NaCl固体,浓度一定上升 C、的电离方程式为: D、体系中,
-
12、利用如图装置进行实验:打开 , 一定时间后,a中溶液变蓝;关闭 , 打开 , 点燃酒精灯加热数分钟后,滴入无水乙醇。下列说法错误的是
 A、a中现象体现了的还原性 B、b中既作氧化剂也作还原剂 C、乙醇滴加过程中,c中的铜丝由黑变红,说明乙醇被氧化 D、d中有银镜反应发生,说明c中产物有乙酸
A、a中现象体现了的还原性 B、b中既作氧化剂也作还原剂 C、乙醇滴加过程中,c中的铜丝由黑变红,说明乙醇被氧化 D、d中有银镜反应发生,说明c中产物有乙酸 -
13、设为阿伏加德罗常数的值。下列说法正确的是A、的中子数,比的多 B、与水蒸气完全反应,生成的数目为 C、在的溶液中,的数目为 D、标准状况下的与足量反应,形成的共价键数目为
-
14、元素a~i为短周期元素,其第一电离能与原子序数的关系如图。下列说法正确的是
 A、a和g同主族 B、金属性: C、原子半径: D、最简单氢化物沸点:
A、a和g同主族 B、金属性: C、原子半径: D、最简单氢化物沸点: -
15、下列陈述Ⅰ与陈述Ⅱ均正确,且两者间具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
浓硝酸保存在棕色试剂瓶中
浓硝酸具有强氧化性
B
向蔗糖中加适量浓硫酸,蔗糖变黑
浓硫酸具有脱水性
C
与可生成蓝色物质
KSCN溶液可用于检验
D
与浓盐酸共热,生成黄绿色气体
A、A B、B C、C D、D -
16、能满足下列物质间直接转化关系,且推理成立的是
单质X氧化物1氧化物2酸(或碱)盐
A、X可为铝,盐的水溶液一定显酸性 B、X可为硫,氧化物1可使品红溶液褪色 C、X可为钠,氧化物2可与水反应生成 D、X可为碳,盐的热稳定性: -
17、对铁钉进行预处理,并用铜氨溶液给铁钉镀铜。下列操作不能达到实验目的的是
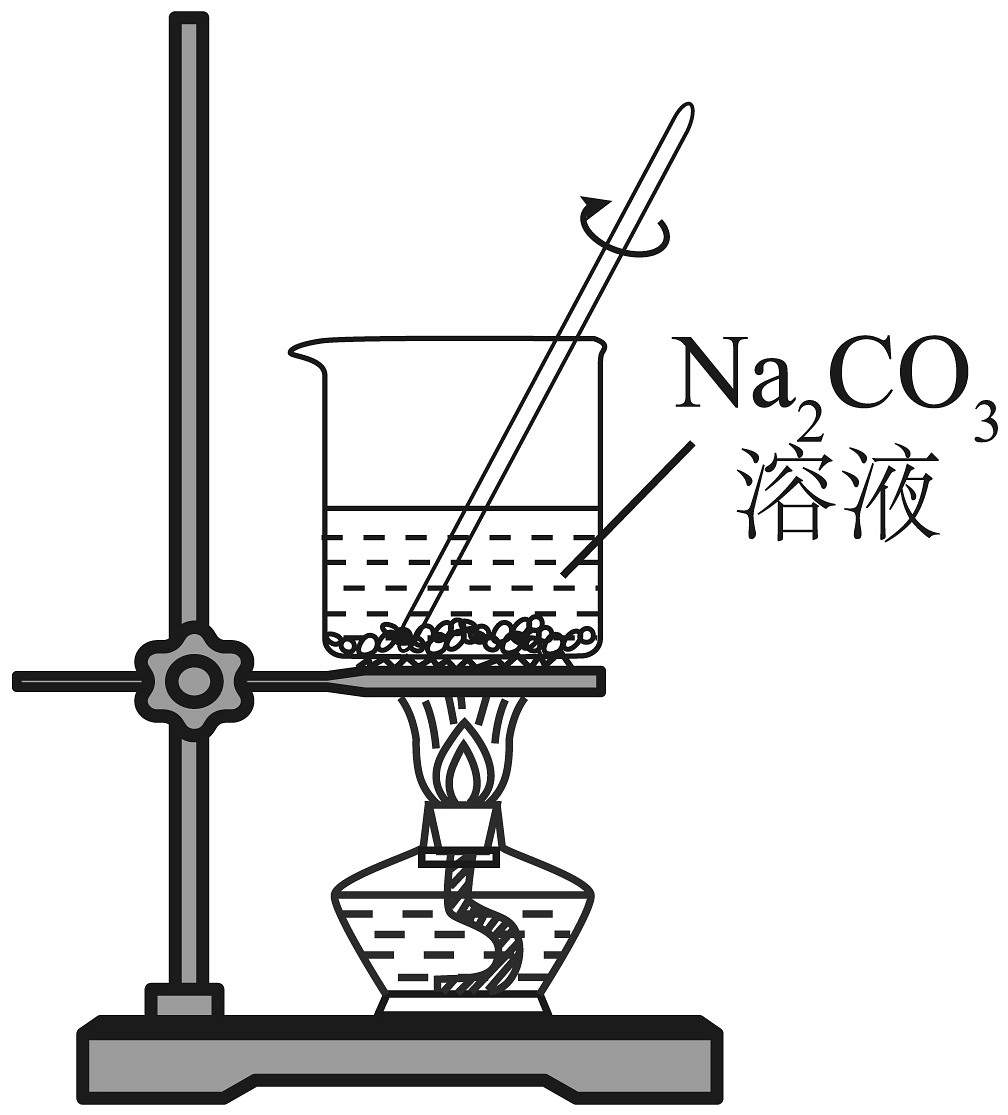

A.除油污
B.除铁锈


C.制铜氨溶液
D.铁钉镀铜
A、A B、B C、C D、D -
18、声波封印,材料是音乐存储技术的基础。下列说法错误的是A、制作黑胶唱片使用的聚氯乙烯,其单体是 B、磁带可由四氧化三铁涂覆在胶带上制成,具有磁性 C、光碟擦写过程中材料在晶态和非晶态间的可逆转换,涉及物理变化 D、固态硬盘芯片常使用单晶硅作为基础材料,单晶硅是一种共价晶体
-
19、劳动创造美好生活。下列对劳动项目涉及的相关化学知识表述错误的是
选项
劳动项目
化学知识
A
向燃煤中加入生石灰以脱硫减排
B
用和盐酸检验粗盐中是否含
C
使用溶液点卤制豆腐
使蛋白质盐析
D
用铁粉、活性炭、食盐等制暖贴
使用时铁粉被氧化,反应放热
A、A B、B C、C D、D -
20、现代科技,增强国力,增进民生福祉。下列说法正确的是A、我国科学家首次测得了月球背面月幔水含量质量为10g B、利用成功为金属材料“重塑金身”,中Mo的化合价为+6 C、穿上电动机械腿,助力行走不是梦,行走时电池将电能转化为化学能 D、沙海养鱼蹚出治沙新路,让沙海沙山变成金山银山,鱼肉富含蛋白质