相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、下列校本课程中涉及的劳动项目与化学知识没有关联的是
选项
劳动项目
化学知识
A
帮厨活动:煎鱼时同时加酒和醋
生成有香味的酯类物质
B
家务劳动:油锅起火时不能用水灭火
油脂可发生水解反应
C
学农活动:用大豆酿制酱油
蛋白质水解生成氨基酸
D
环保行动:用除去废水中的
溶度积:
A、A B、B C、C D、D -
2、以二氧化铪()为原料,通过电解脱氧法可制得杂质含量很低的铪,其工作原理如图所示.下列说法错误的是
 A、电极b与电源负极相连 B、电极a的电极反应式为 C、电解时移向电极a D、电极b发生氧化反应
A、电极b与电源负极相连 B、电极a的电极反应式为 C、电解时移向电极a D、电极b发生氧化反应 -
3、衣食住行皆化学.下列说法错误的是A、用四氯乙烯干洗剂除去衣服上油污,发生的是物理变化 B、向葡萄酒中添加适量 , 可起到杀菌抗氧化的作用 C、用84消毒液或双氧水消毒住宅可减少病毒滋生 D、蒸馏“地沟油”可获得“生物柴油”,“生物柴油”属于烃类有机物
-
4、乙烯的产量可以衡量一个国家石油化工的发展水平,某小组利用下列装置制备乙烯并进行实验,其中能达到预期目的的是




A.制备乙烯
B.净化乙烯
C.收集乙烯
D.验证乙烯与溴发生反应
A、A B、B C、C D、D -
5、从化学视角了解岭南文化.下列说法错误的是A、湛江湖光岩湖水湛蓝无比,湖水中含有的是正四面体形结构 B、粤剧服装绚丽多彩,丝绸的主要成分是蛋白质 C、“一骑红尘妃子笑,无人知是荔枝来”,荔枝中的果糖与葡萄糖是同分异构体 D、“化州橘红”能润肺止咳,水泡橘红的过程涉及萃取原理
-
6、中国首个自主研制的火星探测器“天问一号”成功实现火星捕获,迈出了中国行星探测的第一步.下列说法正确的是A、航天防热涂层中的酚醛树脂是通过加聚反应制得的 B、温控系统中的镁铝合金熔点比纯铝高 C、在探测器“落”“巡”任务中发挥作用的纳米气凝胶能产生丁达尔效应 D、新型铝基碳化硅复合材料中的增强体是分子晶体
-
7、农耕文明是中华文明的重要载体.下列农具的材料属于高分子的是
选项
A
B
C
D
材料




名称
石制碌轴
木制水转筒车
青铜杵臼
汉代铁锄
A、A B、B C、C D、D -
8、黄金按质量分数分级,纯金为。合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是
 A、I为金 B、Ⅱ中的配位数是12 C、Ⅲ中最小核间距 D、I、Ⅱ、Ⅲ中,与原子个数比依次为、、
A、I为金 B、Ⅱ中的配位数是12 C、Ⅲ中最小核间距 D、I、Ⅱ、Ⅲ中,与原子个数比依次为、、 -
9、化合物Ⅶ是制备抗菌药的中间体,实验室以芳香化合物Ⅰ为原料制备Ⅶ的一种合成路线如下:
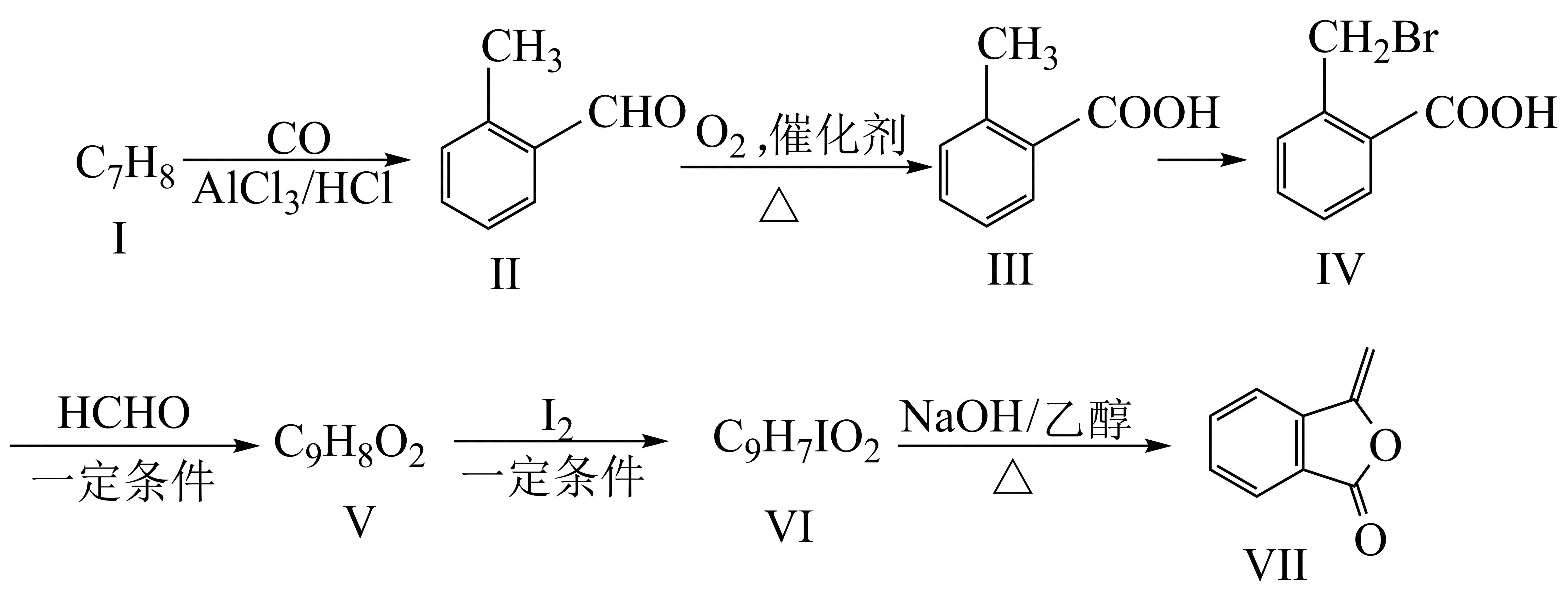
已知:

回答下列问题:
(1)、化合物Ⅰ的名称为;化合物Ⅳ含有的官能团的名称是。(2)、化合物Ⅴ的结构简式为;化合物Ⅵ→化合物Ⅶ的反应类型为。(3)、化合物Ⅱ→化合物Ⅲ的化学方程式为。(4)、芳香化合物Ⅹ是化合物Ⅳ的同分异构体,同时满足如下条件的化合物Ⅹ的结构有种(不考虑立体异构);条件:a)含有的官能团的种类和数目与化合物Ⅳ的相同;b)苯环上有两个取代基
其中,核磁共振氢谱有四组峰的结构简式(任写一种)。
(5)、根据上述信息,写出以溴乙烷为原料制备聚-2-丁烯的合成路线 (无机试剂任选,需注明反应条件)。 -
10、2021年全世界前沿新材料领域取得新的进展。推动了高技术产业变革,钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:(1)、钛的核外电子排布式是 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛元素的检验方法如图:

可与形成配离子 , 其原因是。
(3)、二氧化钛()是一种常用的、具有较高催化活性和稳定性的光催化剂,也常用于污水处理。纳米催化的一个实例如图所示:
化合物乙的分子中采取杂化方式成键的原子数目是个。
(4)、氮化钛晶体的晶胞结构如图所示,则氮化钛晶体化学式为 , 该晶体结构中与N原子距离最近且相等的N原子有个;该晶胞的密度 , 则晶胞结构中两个氮原子之间的最近距离为。(为阿伏加德罗常数的数值,只列计算式)
-
11、铁是地球上分布最广泛的金属之一,约占地壳质量的5%,仅次于氧、硅、铝,位居地壳含量第四位。蛋白琥珀酸铁(CaHbOcNdFe)口服液可以用来治疗缺铁性贫血的治疗。请回答以下相关问题:(1)、写出基态铁原子的价层电子排布式。(2)、给出蛋白琥珀酸铁含有的C、N、O三种元素的第一电离能从小到大排序 , 并解释原因。(3)、将C、N、O三种元素最简单氢化物按照键角从大到小排序。(4)、已知O、S、Se、Te在元素周期表中位于同主族,将这四种元素的最简单氢化物按照沸点从大到小排序。(5)、琥珀酸的结构如图所示,写出琥珀酸分子中σ键与π键的个数比。
 (6)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的分子式。(7)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,铁原子的半径为rpm,给出铁晶胞密度的表达式 g•cm-3。
(6)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的分子式。(7)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,铁原子的半径为rpm,给出铁晶胞密度的表达式 g•cm-3。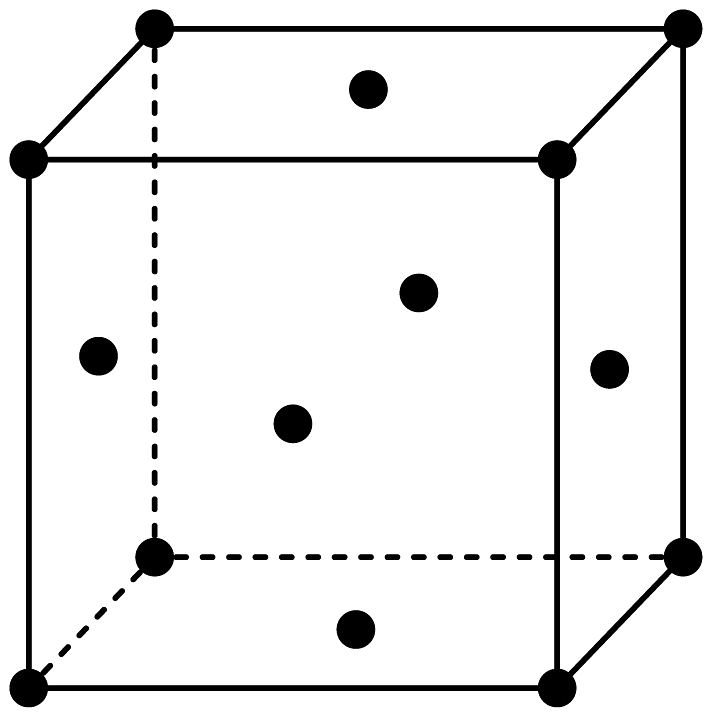
-
12、将下列反应产生的气体通入如图所示的装置,所选试剂不能达到实验目的的是

选项
操作
目的
试剂a
试剂b
A
往电石中滴加饱和食盐水
验证乙炔的性质
溶液
酸性溶液
B
混合苯、液溴、铁粉
验证苯的取代反应
无
溶液
C
加热1-溴丁烷与的乙醇溶液
验证反应产生了烯烃
无
溴的溶液
D
往中滴加醋酸
验证酸性:碳酸>苯酚
饱和溶液
苯酚钠溶液
A、A B、B C、C D、D -
13、阿莫西林是常见的抗生素,其结构如图所示,下列说法错误的是
 A、阿莫西林与溶液共热时最多可消耗 B、阿莫西林的分子式为 C、阿莫西林与反应时最多消耗 D、阿莫西林能与浓溴水反应
A、阿莫西林与溶液共热时最多可消耗 B、阿莫西林的分子式为 C、阿莫西林与反应时最多消耗 D、阿莫西林能与浓溴水反应 -
14、设为阿伏加德罗常数值.下列有关叙述正确的是A、甲烷中的氢原子被氯原子完全取代,需要氯气分子数为 B、甘油(丙三醇)中含有羟基数为 C、乙烯和丙烯混合气体中的氢原子数为 D、标准状况下,含有的共价键数为
-
15、自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是
 A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)
A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长) -
16、下列说法正确的是A、
 的一溴代物和
的一溴代物和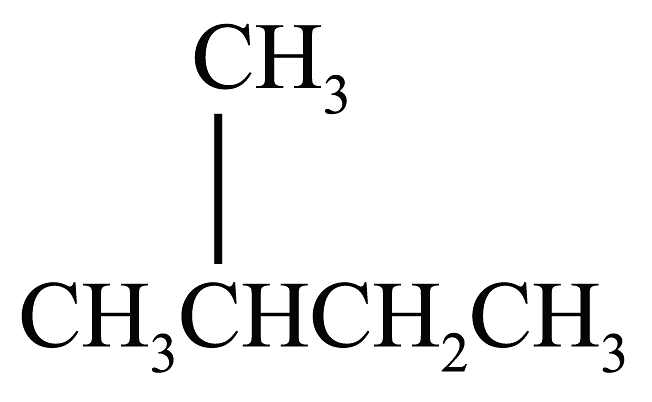 的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物
的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物 的名称是2,3,4一三甲基-2-乙基戊烧
D、
的名称是2,3,4一三甲基-2-乙基戊烧
D、 和
和 互为同系物
互为同系物
-
17、石棉具有高度耐火性、电绝缘性和绝热性,是重要的防火、绝缘和保温材料,其化学式为 , 其组成也可写成余化物形式:。下列说法正确的是A、组成元素均位于元素周期表的p区 B、的熔点比的高 C、ⅣA族元素单质的晶体类型相同 D、基态硅原子核外电子有8种不同的空间运动状态
-
18、下列说法正确的是A、基态Cr原子的价层电子:3d54s1 , 违反能量最低原理 B、基态C原子的电子排布式:1s22s22px12pz1 , 违反能量最低原理 C、基态C原子的价层电子排布图:
 ,违反泡利原理
D、基态Fe3+的3d电子排布图:
,违反泡利原理
D、基态Fe3+的3d电子排布图: ,违反洪特规则
,违反洪特规则
-
19、溶于浓溶液中可得到配合物。下列说法错误的是A、提供空轨道 B、中心离子的配位数是4 C、含有键数目为 D、向溶液中逐滴滴加浓溶液至过量,先形成蓝色沉淀,后沉淀溶解
-
20、依据元素周期律,下列判断不正确的是A、原子半径:Mg<Na<K B、第一电离能:Li<Be<B C、电负性:N<O<F D、热稳定性:SiH4<PH3<HCl