相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、化学与生活密切相关,下列说法正确的是A、维生素C用作食品的抗氧化剂是因其易被氧化 B、阿司匹林不宜长期大量服用是因其在水中微溶 C、苯甲酸钠可作为食品防腐剂是由于其含碳量高 D、人们需摄入纤维素因其在体内会水解成葡萄糖
-
2、“蛮腰绰约,立城郭之高标”。下述广州塔建造用材,属于硅酸盐材料的是A、制作塔柱外斜交网状外框筒的钢材 B、拼接高空观景厅外透明幕墙的玻璃 C、塔内电缆材料里的交联聚乙烯塑料 D、塔顶金属枪杆表面防腐涂层的锌粉
-
3、在生产、生活中金属腐蚀所带来的损失非常严重,下列有关金属腐蚀与防护的说法正确的是A、生铁浸泡在食盐水中会发生析氢腐蚀 B、钢铁发生吸氧腐蚀的正极的电极反应式为 C、在轮船的底部镶嵌不易腐蚀的铜块,可以提高船体的使用寿命,利用了牺牲阳极法 D、将钢铁闸门与电源正极相连的防腐措施属于外加电流法
-
4、下列离子方程式中,正确的是A、稀硫酸滴在铁片上: B、稀盐酸滴在石灰石上: C、稀硫酸与氢氧化钡溶液混合: D、铜片插入硝酸银溶液中:
-
5、非天然氨基酸是一种重要的药物中间体,其合成路线之一如下:
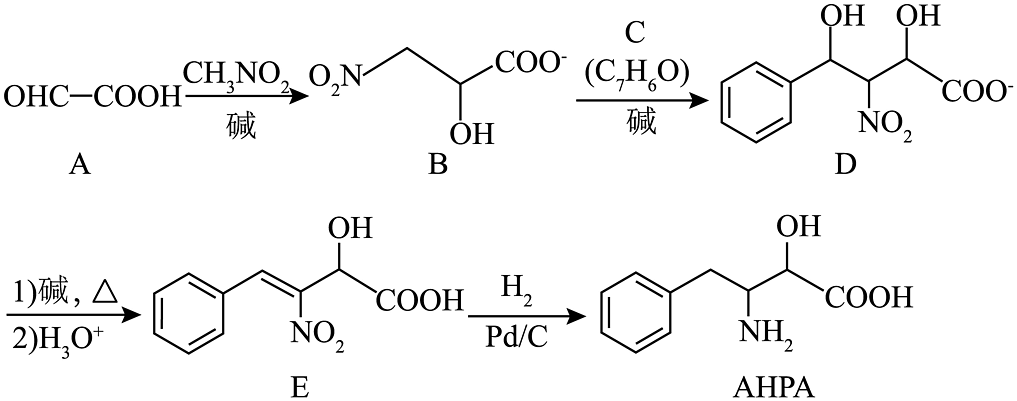 (1)、写出A含有的官能团的名称。(2)、原子利用率为 , C的结构简式为。(3)、E中碳原子的杂化方式有。(4)、根据的机构特征,分析其化学性质,完成下表
(1)、写出A含有的官能团的名称。(2)、原子利用率为 , C的结构简式为。(3)、E中碳原子的杂化方式有。(4)、根据的机构特征,分析其化学性质,完成下表反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
浓氢溴酸、加热
(5)、写出同时满足下列条件的的同分异构体的结构简式。①含苯环且苯环只有一个取代基;
②红外光谱显示含氧官能团只有和;
③核磁共振氢谱显示有6组峰,峰面积比为。
(6)、参照上述合成路线,设计以苯甲醛( )为主要原料制备
)为主要原料制备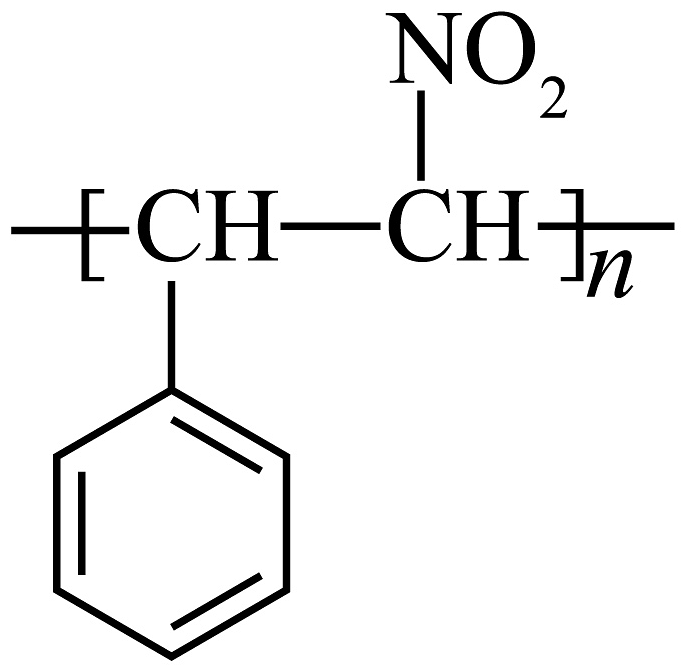 的合成路线(其他原料、试剂任选)。
的合成路线(其他原料、试剂任选)。 -
6、2030年全球新能源动力电池镍消费量将达到2020年全球镍产量的近。碱式碳酸镍在工业上可作为制备其他含镍化合物的原料。工业上由某含镍废渣精矿(主要成分为)为原料制备碱式碳酸镍的流程如下图所示。

已知:①时,相关离子开始沉淀和完全沉淀的如表所示。
离子
开始沉淀时的
6.4
2.2
4.4
完全沉淀时的
8.4
3.5
6.7
②时,。
回答下列问题:
(1)、滤渣I的主要成分为(填化学式)。(2)、“除杂1”时应利用加入的溶液凋节溶液的范围为。(3)、“除杂2时发生反应的离子方程式为 , 时,该反应的化学平衡常数为;实验测得此工序中加入的物质的量与“除杂1”所得溶液中的物质的量之比、反应温度对除杂2”所得滤渣中铜镍比的关系分别如左图和右图所示:
则最佳的加入的物质的量与“除杂1”所得溶液中的物质的量之比和反应温度分别为。
(4)、“萃取”和“反萃取”的最终目的是富集获得含有(填化学式)的水溶液。(5)、“沉镍”时应控制温度为 , 反应除生成外,还有一种无色气体生成,该气体为分子(填“极性”或“非极性”)。(6)、碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池充电的工作原理为:(M表示储氢金属或合金),该电池充电过程中阴极的电极反应式为。(7)、镍和砷可以形成多种化合物,红砷镍矿主要成分的晶胞结构如下图所示,该砷化镍的化学式为。
-
7、常用于制取硝酸、硝基化合物等,但同时也是空气污染物。(1)、工业制硝酸时,需将转化为 , 现有以下两种途径:
I.①;
Ⅱ.②。
③。
若已知④。计算可得。途径Ⅱ与途径I相比,优势在于。
(2)、反应②的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
对总反应速率影响较大的步骤的活化能为 , 该步骤的化学方程式是。
(3)、某温度下向容器中按照体积比充入和 , 控制压强为 , 反应达到平衡状态时体系中的体积分数为0.6。①的平衡转化率为。
②在化学平衡体系中,用各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数。此温度下反应的压强平衡常数(列出计算式即可)。
(4)、制硝酸的工业尾气中含有 , 将尾气与适量空气混合后通入到浓氨水中,可生成 , 反应的化学方程式为。 -
8、白银(Ag)是高新技术产业的基础材料之一、从一种光盘金属层中回收少量白银(金属层中其它金属含量过低,对实验的影响可忽略)的流程如下:

下列叙述不正确的是
A、“氧化”阶段需在80℃条件下进行,可用水浴加热 B、“操作1”所用到的玻璃仪器是玻璃棒、烧杯、漏斗 C、若“还原”过程通过原电池来实现,则N2为正极产物 D、“还原”过程中参加反应的n[Ag(NH3)]∶n[N2H4·H2O]=4∶1 -
9、化学兴趣小组采用次氯酸钙与稀盐酸反应制取氯气,并探究了氯气的性质。实验装置如图所示,下列说法正确的是
 A、湿润的pH试纸先变红后褪色,说明Cl2有酸性和漂白性 B、f处的现象是出现红色沉淀 C、g处变为橙色,h处变为黄色,说明元素非金属性:Cl>Br>I D、等量Cl2分别单独缓慢通过g、h、i试管完全反应后,生成的氧化产物物质的量之比为1∶1∶1
A、湿润的pH试纸先变红后褪色,说明Cl2有酸性和漂白性 B、f处的现象是出现红色沉淀 C、g处变为橙色,h处变为黄色,说明元素非金属性:Cl>Br>I D、等量Cl2分别单独缓慢通过g、h、i试管完全反应后,生成的氧化产物物质的量之比为1∶1∶1 -
10、鸢尾酮的分子结构如图所示,下列说法错误的是
 A、α-鸢尾酮与某种酚互为同分异构体 B、1 molα-鸢尾酮最多可与3 mol H2加成 C、α-鸢尾酮能发生银镜反应 D、α-鸢尾酮分子中有2个手性碳
A、α-鸢尾酮与某种酚互为同分异构体 B、1 molα-鸢尾酮最多可与3 mol H2加成 C、α-鸢尾酮能发生银镜反应 D、α-鸢尾酮分子中有2个手性碳 -
11、某溶液可能含有等浓度的下列某些离子: , 取溶液分别进行如下实验:
①加入酸化的溶液产生白色沉淀;
②加入淀粉溶液,呈蓝色;
③加入溶液产生白色沉淀,加热后产生有刺激性气味的气体。
下列说法错误的是
A、由①②可知一定有 B、若将①中的试剂换成盐酸酸化的溶液,不影响成分的判断 C、③中的离子反应方程式为 D、不能确定有无 -
12、下列叙述正确的是A、“白石英,生华阴及泰山”,石英为硅酸盐 B、实验室现需的溶液 , 应称取晶体来配制。 C、若配制的稀硫酸,需用量筒量取密度为、质量分数为的浓硫酸体积为 D、同温同压时,等质量的气体,体积关系
-
13、下列实验操作,不能达到实验目的是
选项
实验操作
实验目的
A
向少许蔗糖中滴入浓硫酸,并不断用玻璃棒搅拌
验证浓硫酸的脱水性
B
向苯中滴加浓溴水,并加入FeBr3作催化剂
验证苯的溴代反应
C
向Na2SO3粉末中滴入足量浓盐酸,并加入BaCl2溶液
检验Na2SO3粉末是否变质
D
浸透了石蜡油的石棉中加入碎瓷片,加热,并将产生的气体通入酸性高锰酸钾溶液中
检验石蜡的分解产物中含有烯烃
A、A B、B C、C D、D -
14、下列离子方程式的书写正确的是A、与溶液反应 B、明矾溶液中加入溶液至过量: C、碱性条件下,用溶液与反应制备新型净水剂: D、氯碱工业制备氯气:
-
15、下列各组离子一定能大量共存的组合是
①在含有大量溶液中:
②常温下的溶液:
③常温下的溶液中:
④在澄清透明的水溶液中:
⑤常温下的溶液:
⑥常温下的溶液中:
A、①②⑥ B、②④⑤ C、④⑤⑥ D、①②③ -
16、设为阿伏加德罗常数的值。下列说法正确的是A、呋喃(
 )中含有的键数目为
B、时,的溶液中含有的数目为
C、密闭容器中,和充分反应,生成物中原子数为
D、与足量的完全反应,转移的电子数目为
)中含有的键数目为
B、时,的溶液中含有的数目为
C、密闭容器中,和充分反应,生成物中原子数为
D、与足量的完全反应,转移的电子数目为
-
17、下列有关物质的性质与用途具有对应关系的是A、NH3具有还原性,可用作制冷剂 B、FeCl3溶液具有酸性,可用于刻蚀铜制品 C、Al(OH)3具有弱碱性,可用作胃酸中和剂 D、SO2具有氧化性,可用于漂白纸张
-
18、科教兴国,“可上九天揽月,可下五洋捉鳖”。对下列成就所涉及的化学知识的表述正确的是A、“C919”飞机身使用的复合材料——碳纤维和环氧树脂均为有机高分子材料 B、“鲲龙”水陆两栖飞机实现海上首飞,其所用燃料航空煤油是石油分馏产品 C、“墨子号”卫星的成功发射实现了光纤量子通信,光纤的主要成分为晶体硅 D、研制的高效率钙钛矿太阳能电池,其能量转化形式:太阳能→化学能
-
19、我国是一个拥有五千年文化传承的文明古国,文物是传承文化的重要载体。下列对文物的说法正确的是


A.可选用作为红色颜料
B.制作兵马俑的黏土的主要成分为硅酸盐


C.丝绸可用溶液进行浸泡、洗涤
D.制作西汉皇后之玺的玉石为天然有机高分子材料
A、A B、B C、C D、D -
20、农作物感染致病菌后,会诱发多种作物疾病,给农业生产造成巨大经济损失。化合物H是一种研制中的农用抗菌剂,其合成路线如下:

回答下列问题:
(1)、B的化学名称为;生成C时还生成一种无机物,其化学式为。(2)、C的ACD/3D结构模型显示分子中所有原子位于同一平面,说明C中碳、氮原子的轨道杂化类型为;D也是平面型分子,其分子中碳、氮原子形成大π键的p电子数为。(3)、E的结构简式为;生成F的反应类型为。(4)、G可由 与反应制备(同时生成两种无机气体),该反应的化学方程式为。 (5)、参照上述物质转化信息,以甲苯和苯胺为主要原料制备
与反应制备(同时生成两种无机气体),该反应的化学方程式为。 (5)、参照上述物质转化信息,以甲苯和苯胺为主要原料制备 , 写出合成路线(其它试剂任选)。
, 写出合成路线(其它试剂任选)。