相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、室温下,下列实验探究方案能达到相应探究目的的是
选项
探究方案
探究目的
A
用电导率传感器分别测定等体积的CH3COOH溶液和盐酸的电导率,比较溶液的导电性强弱
探究CH3COOH是否为弱电解质
B
向圆底烧瓶中加入2.0gNaOH、15mL无水乙醇、碎瓷片和5mL1-溴丁烷,微热。将产生的气体通入酸性KMnO4溶液中,观察现象
探究1-溴丁烷的消去产物
C
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,观察溶液颜色变化
探究H2O2与Fe3+的氧化性强弱
D
以Zn、Fe为电极,以酸化的3%NaCl溶液作电解质溶液,连接成原电池装置,过一段时间,从Fe电极区域取少量溶液于试管中,检验是否存在Fe2+
探究金属的电化学保护法
A、A B、B C、C D、D -
2、根据下列图示所得出的结论正确的是
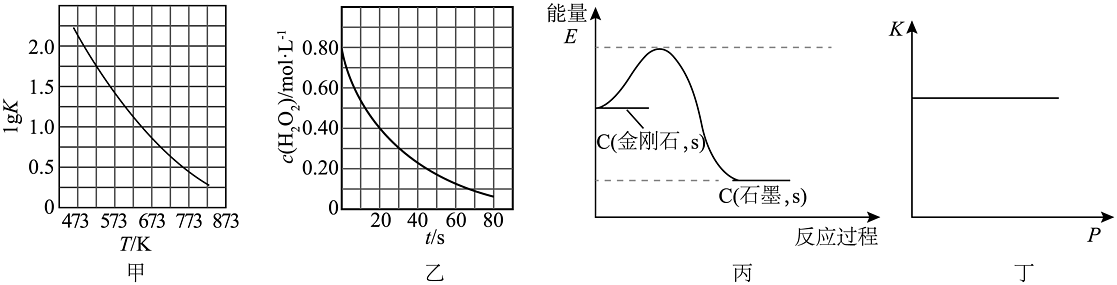 A、图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0 B、图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C、图丙为C(金刚石,s)=C(石墨,s)△H=-1.9kJ·mol-1反应过程的能量变化曲线,说明金刚石比石墨稳定 D、图丁是一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应反应前后气体体积一定不变
A、图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0 B、图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C、图丙为C(金刚石,s)=C(石墨,s)△H=-1.9kJ·mol-1反应过程的能量变化曲线,说明金刚石比石墨稳定 D、图丁是一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应反应前后气体体积一定不变 -
3、活性Fe3O4-x催化反应H2(g)+(aq)=HCOO-(aq)+H2O(l)的部分机理如图所示。下列说法正确的是
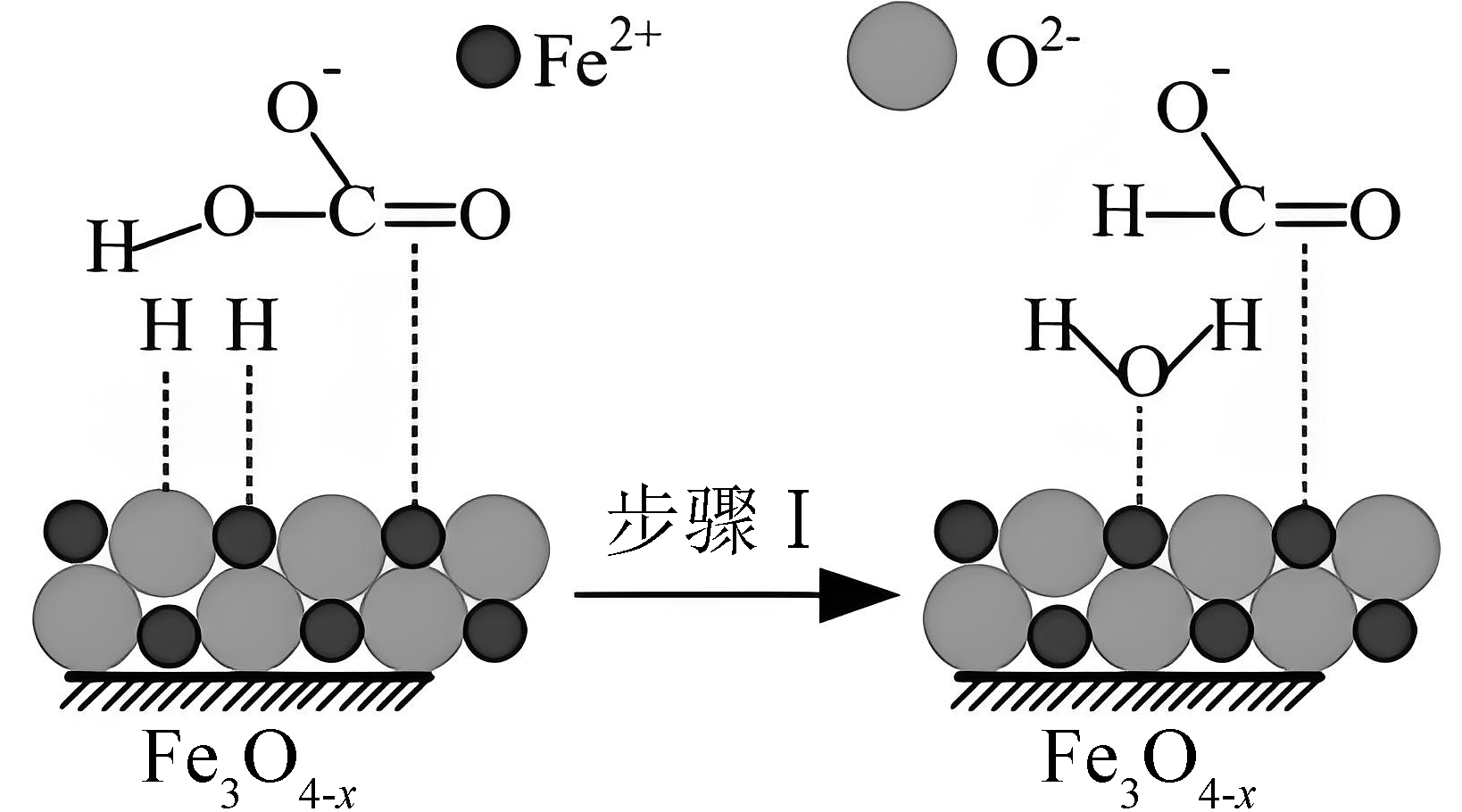 A、该反应的△H>0 B、该反应平衡常数K= C、反应前后碳原子被还原 D、步骤I中,吸附在Fe2+表面的H+与中的羟基结合生成水
A、该反应的△H>0 B、该反应平衡常数K= C、反应前后碳原子被还原 D、步骤I中,吸附在Fe2+表面的H+与中的羟基结合生成水 -
4、在给定条件下,下列物质转化或方程式正确的是A、工业制漂白粉:MnO2Cl2Ca(ClO)2 B、工业制FeCl3:Cl2HCl FeCl3 C、KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3+4OH-=2+3Cl-+5H2O D、电解饱和食盐水:2Cl-+2H+H2↑+Cl2↑
-
5、阅读下列材料,完成下面小题。
催化反应广泛存在,如植物光合作用、合成氨、CH4和H2O重整制H2和CO、工业尾气中NH3的无害化处理、SO2的催化氧化[SO2(g)和O2(g)生成1molSO3(g)放出98.3kJ的热量]等。催化剂有选择性,如酸性条件下锑电催化还原CO,生成HCOOH的选择性大于CO。非均相催化通常指催化剂与反应物处于不同聚集状态的催化反应,反应在催化剂表面进行,主要包括吸附、反应、脱附等过程。
(1)、下列说法不正确的是A、植物光合作用过程中,酶能增大该反应的活化分子百分数 B、H2O2制O2反应中,Fe3+能加快化学反应速率 C、酸性条件下锑电催化还原CO2生成两种产物的速率:v(CO)>v(HCOOH) D、铁触媒催化合成氨的反应属于非均相催化(2)、下列化学反应表示不正确的是A、CH4和H2O催化重整制H2和CO:CH4+H2OCO+3H2 B、工业尾气中NH3的无害化处理:4NH3+5O24NO+6H2O C、锑电催化还原CO2生成HCOOH的阴极反应:CO2+2e-+2H+=HCOOH D、SO2的催化氧化:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ/mol(3)、下列有关反应描述正确的是A、合成氨温度选择400~500℃的重要原因之一是铁触媒在该温度范围内活性大 B、浓硫酸催化下,CH3CH218OH与CH3COOH的酯化反应产物中可检测到 C、乙醛催化加氢反应中,H2在催化剂Ni表面吸附过程的△S>0 D、SO2转化为SO3时,加入催化剂能减小该反应的焓变 -
6、在世界首创的人工合成淀粉反应中使用了多种生物酶。下列有关酶的说法不正确的是A、酶通常是一种羧酸 B、酶的催化条件通常较温和 C、酶催化反应具有效率高的特点 D、酶在重金属盐作用下会失去活性
-
7、实验室模拟侯氏制碱法制备 , 下列装置与原理均正确的是
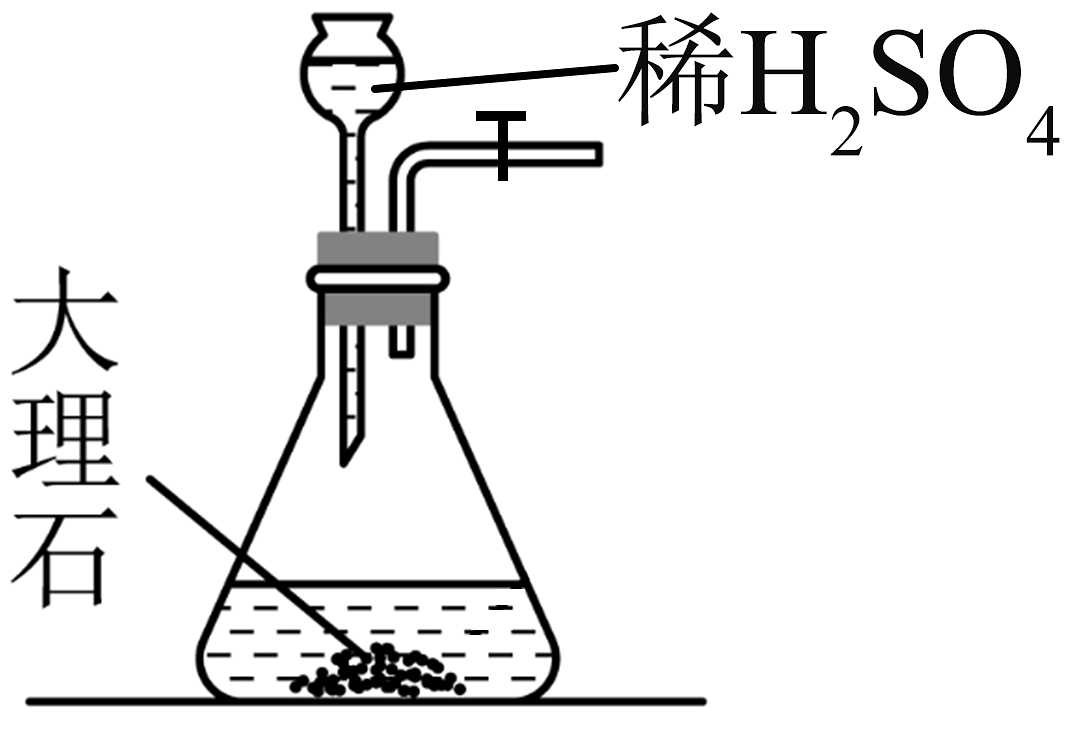

A.制取
B.制取
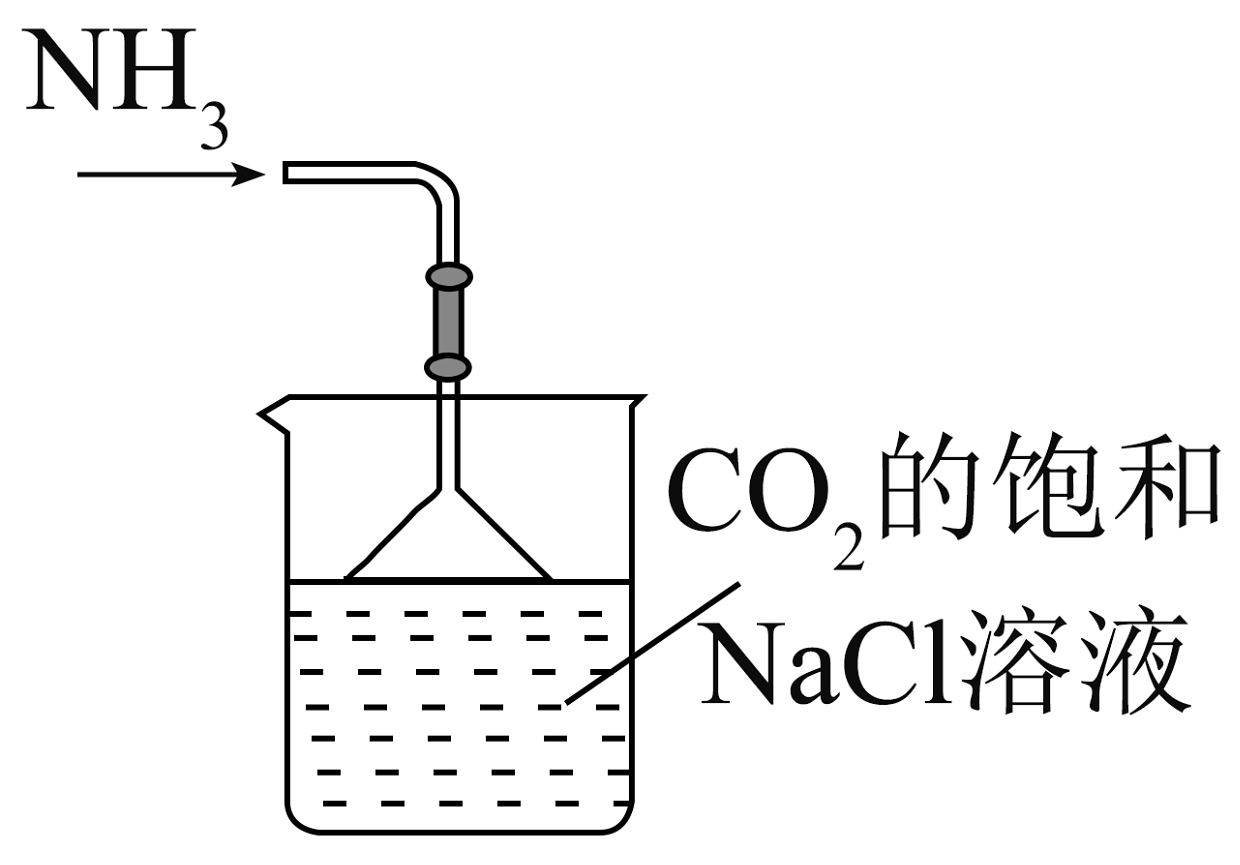

C.制取
D.制取
A、A B、B C、C D、D -
8、淮安十四五规划提出建设“美丽淮安”。下列做法不应该提倡的是A、大力发展化石能源经济 B、积极鼓励植树造林 C、将二氧化碳转化为化工产品 D、养成低碳生活习惯
-
9、高铁酸钠(Na2FeO4)是一种新型水处理剂,Na2FeO4只能在强碱性条件下稳定存在,主要用于饮用水处理。制备高铁酸钠有多种方法,其中一种方法的实验流程如下:

请回答下列问题。
(1)、过程1所得NaClO溶液中需要加入NaOH固体,其目的是。(2)、过程2中所发生反应的化学方程式为。(3)、过程3中所发生反应的离子方程式如下:_____ClO-+___Fe3++___OH-→_____+_____Cl-+____H2O
①请将上述离子方程式配平 , 并用双线桥表示电子转移的方向和数目。
②一个完整的氧化还原反应往往可以拆成两个半反应,一个为“氧化半反应”,另一个为“还原半反应”,两个半反应可以通过叠加得到总反应。如Zn+Cu2+=Zn2++Cu的氧化半反应为Zn-2e-=Zn2+ , 还原半反应为Cu2++2e-=Cu。则上述离子方程式对应的氧化半反应为(请将化学计量数化为最简整数比)。
(4)、高铁酸钠处理水的原理如图所示。Na2FeO4是一种多功能水处理剂的原因为。
-
10、某学习小组探究潮湿的与反应的产物,进行如图实验:

请回答:
(1)、试剂X是其作用是。装置中,盛放的仪器名称;该实验中收集氯气用的是法。(2)、写出氯气进入装置E发生反应的化学方程式。(3)、装置C中潮湿的与以等物质的量反应,生成、气体和NaCl,试写出该反应化学方程式。(4)、若将上述装置中的C、D、E部分换成如图所述装置,其中Ⅰ与Ⅲ是干燥的有色布条,Ⅱ和D中装入的物质是干燥剂(干燥剂不吸收),E中盛装NaOH溶液,请回答下列问题:一段时间后,可观察到的现象是 , 对比Ⅰ与Ⅲ中现象的差异可得出的结论是。 (5)、标准状况下,将17.4克与足量的浓盐酸溶液共热产生的体积为升(标准状况)。写出计算过程。
(5)、标准状况下,将17.4克与足量的浓盐酸溶液共热产生的体积为升(标准状况)。写出计算过程。 -
11、物质的量是一个联系宏观和微观的重要物理量。设NA为阿发加德罗常数的值,回答下列问题。(1)、同温同压下,A2气体与B2气体化合,生成AxBy气体(其中x、y都为整数),已知反应前后气体的密度不变,则AxBy的分子式为。(2)、已知Mm+的电子数为a,M的质量数为A,则2molM的中子数为。(3)、对于反应Zn+2HCl=ZnCl2+H2↑,将6.5gZn放入200mL2mol/L的盐酸中充分反应后,溶液中大量存在的离子有(用离子符号表示)。(4)、某混合物由NaCl、MgCl2、AlCl3组成,已知Na、Mg、Al三种元素的质量之比为46:12:27,则含1.2molCl-的该混合物中,MgCl2的质量为。(5)、将0.2mol/LNaCl和0.1mol/LCaCl2溶液等体积混合(忽略混合后溶液体积的变化),则该混合溶液中c(Cl-)=mol/L。(6)、针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取次氯酸钠(NaClO)含量为14.9g/L的84消毒液1mL加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为mol/L。(7)、有0.4g铁的氧化物,用足量CO在高温下将其还原,把生成的CO2全部通入足量的澄清石灰水中得到0.75g固体沉淀物,这种铁的氧化物的化学式为。(8)、将工业废渣中的铁元素提取,经过一系列步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁元素的质量分数:准确称取样品3.000g,置于250mL雒形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Fe3+和Sn2+以物质的量1:1反应,将Fe3+转化为Fe2+),充分反应后,除去过量的SnCl2.用5.000×10-2mol/LK2Cr2O7溶液滴定至终点(反应过程中与Fe2+以物质的量1:6反应生成Cr3+和Fe3+外,消耗K2Cr2O7溶液22.00mL。计算该样品中铁元素的质量分数(写出计算过程)。
-
12、废旧CPU中的金(Au)、银(Ag)和铜(Cu)回收的部分流程如下:

已知:HAuCl4=H++。下列说法正确的是
A、“酸溶”时加入的硝酸可以换成硫酸 B、“过滤”所得滤液直接弃用 C、用浓盐酸和NaNO3也可以溶解金 D、用过量Zn粉将1molHAuCl4完全还原为Au,参加反应的Zn为1.5mol -
13、下列说法正确的是A、已知:H3RO2+NaOH(足量)=NaH2RO2+H2O,则H3RO2为一元酸 B、氯化钠溶液在电流作用下电离出钠离子和氯离子 C、醋酸铵(CH3COONH4)是弱酸和弱碱生成的盐,所以它是弱电解质 D、用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色,该溶液一定是钠盐溶液
-
14、下列有关实验操作、现象和结论都正确的是A、向某溶液中加入氯化钡溶液有白色沉淀产生,再加过量稀盐酸,沉淀不消失,则原溶液中一定含有 B、向KI的酸性溶液中滴加几滴NaNO2溶液,再滴加淀粉液后变蓝色,可以证明此条件下的氧化性比I2强 C、将钠投入到硫酸铜溶液中,有红色的固体生成,说的Na的还原性强于Cu D、向一定浓度的CuSO4溶液中通入适量H2S气体,出现黑色沉淀,可以证明氢硫酸的酸性比H2SO4强
-
15、实验室模拟捕捉回收CO2 , 假设需要480mL1.000mol·L-1NaOH溶液,现进行溶液配制。下列说法正确的是A、用托盘天平称量19.2gNaOH固体 B、在转移溶液后,可以不用洗涤玻璃棒 C、容量瓶洗涤后没有干燥,不影响所配溶液浓度 D、如果加水定容时超过刻度线,用滴管将多余溶液吸出,不影响所配溶液浓度
-
16、某科研团队报道了一种新“光合作用”,将二氧化碳转化为甲烷,其催化机理如图所示。设NA为阿伏加德罗常数的值。下列说法正确的是
 A、44gC18O2中含中子数为26NA B、La2O2没有参加反应 C、CO2转化为CH4利用了CO2的还原性 D、该历程的总反应方程式为CO2+4H2CH4+2H2O
A、44gC18O2中含中子数为26NA B、La2O2没有参加反应 C、CO2转化为CH4利用了CO2的还原性 D、该历程的总反应方程式为CO2+4H2CH4+2H2O -
17、实验室用MnO2等原料制取少量KMnO4的实验流程如下。下列说法正确的是
 A、“熔融”时,应先将MnO2和KClO3混合加热一段时间后再加入KOH B、“过滤”时,可采用搅拌加快分离速率 C、可通过对滤液蒸发结晶获得KMnO4粗品 D、制得的KMnO4粗品可能会含有K2CO3 , 可向粗品中滴加硫酸观察是否有气泡来检验是否含K2CO3
A、“熔融”时,应先将MnO2和KClO3混合加热一段时间后再加入KOH B、“过滤”时,可采用搅拌加快分离速率 C、可通过对滤液蒸发结晶获得KMnO4粗品 D、制得的KMnO4粗品可能会含有K2CO3 , 可向粗品中滴加硫酸观察是否有气泡来检验是否含K2CO3 -
18、下列关于物质的性质与用途不具有对应关系的是A、NaHCO3溶液具有弱碱性,可用于治疗胃酸过多 B、过氧化钠具有漂白性,可用作呼吸面具的供氧剂 C、钠的还原性强,可用于冶炼金属钛 D、铁粉能与O2反应,可用作食品保存的脱氧剂
-
19、在给定条件下,下列选项所示的物质间转化均能实现的是A、Ca(ClO)2溶液HClOO2 B、饱和食盐水NaNa2O2 C、FeFeCl2Fe(OH)2 D、饱和食盐水NaHCO3Na2CO3
-
20、废旧镀锌铁皮除去锌后,可用于制备磁性Fe3O4纳米粒子,工艺流程如下图。

下列有关说法不正确的是
A、“碱洗”是为了去除废旧镀锌铁皮表面的油污 B、“氧化”时氧化剂和还原剂的物质的量之比1:2 C、“氧化”后的溶液中金属阳离子主要有Fe2+、Fe3+、Na+ D、用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应