相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、利用硝酸工业的尾气(含、)获得的部分工艺流程如图:
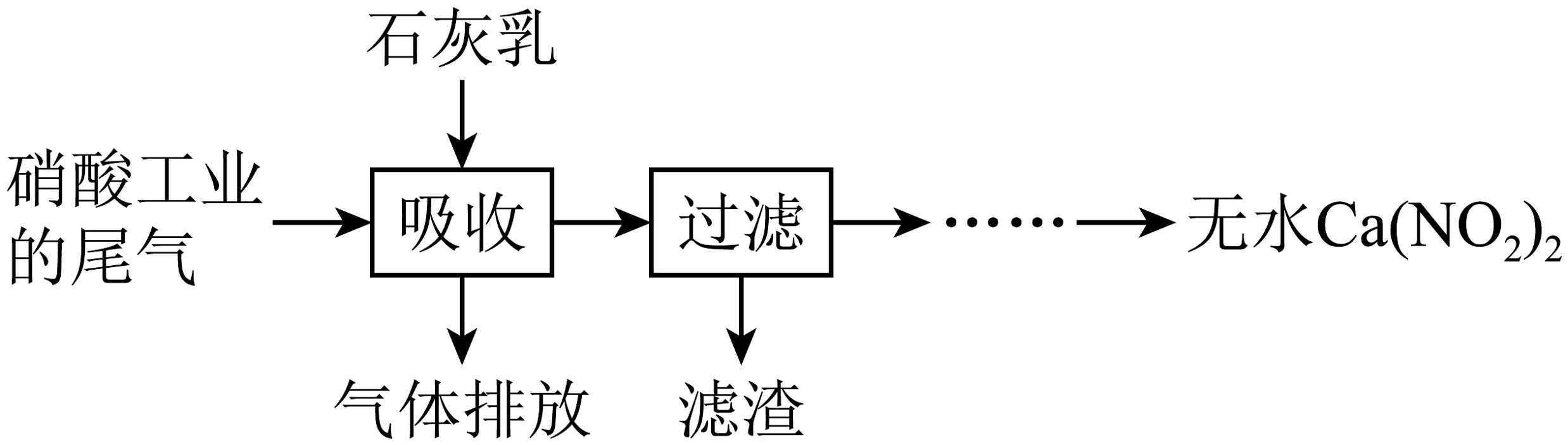
下列说法不正确的是
A、反应的 B、若尾气中产品中含量升高 C、为使尾气中被充分吸收,尾气与石灰乳采用气液逆流接触吸收 D、在酸性溶液中分解的离子方程式为 -
2、下列化学反应表示正确的是A、少量通入溶液中: B、向饱和食盐水中通入氨气和过量二氧化碳: C、用惰性电极电解饱和溶液: D、稀硫酸与稀氢氧化钾溶液发生反应:
-
3、氯气可用来制备将氢氧化铁氧化为高铁酸根离子的氧化剂,下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
 A、用装置甲制取Cl2 B、用装置乙除去Cl2中少量HCl C、用装置丙分离MnO2和MnCl2溶液 D、用装置丁蒸干MnCl2溶液制MnCl2·4H2O
A、用装置甲制取Cl2 B、用装置乙除去Cl2中少量HCl C、用装置丙分离MnO2和MnCl2溶液 D、用装置丁蒸干MnCl2溶液制MnCl2·4H2O -
4、下列比较关系正确的是A、第一电离能:N>O B、还原性:HBr>HI C、碱性:Al(OH)3>Mg(OH)2 D、离子半径:Na+>F-
-
5、工业上由、和可制备。下列说法中正确的是A、的电子式为 B、的空间结构为直线形 C、中元素的化合价为+4价 D、中含有非极性共价键
-
6、我国科学家已经实现了从CO2到淀粉]n的全合成,下列有关说法正确的是A、CO2为碱性氧化物 B、淀粉结构中含有 C、全合成属于化学变化 D、全合成过程中CO2作还原剂
-
7、高血脂能引起动脉粥样硬化、冠心病、胰腺炎等疾病,已成为现代人健康的杀手之一,如图是一种治疗高血脂的新药J的合成路线:

已知:①
 ;②
;② 。
。回答下列问题:
(1)、A是一种芳香烃,其名称为 , B→C的反应条件为 , C→D的反应类型为。(2)、写出C与E反应的化学方程式。(3)、已知有机物H分子式为C10H20O3 , 写出其结构简式。(4)、有机物D分子中最多有个原子共平面。(5)、化合物W的相对分子质量比E大14,W的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①属于芳香族化合物;②遇FeCl3溶液显紫色;③能发生银镜反应;④核磁共振氢谱有5组吸收峰,且峰面积比为2:2:2:1:1。
-
8、
Ⅰ.有机化合物A是一种重要的化工中间体,A~F在一定条件下的转化关系如图所示。

回答下列问题:
(1)A→B反应的试剂及条件为。
(2)C中官能团的名称为。
(3)A→D的过程中,可生成一种高分子副产物,该副产物的结构简式为。
(4)写出E在碱性条件下与新制氢氧化铜反应的化学方程式:。
(5)通常条件下,向F中加入酸性高锰酸钾溶液可转化为A,你认为这种方法是否正确(填“是”或“否”),请说明理由。
Ⅱ.聚碳酸酯(PC)是一种具有良好抗冲击性能和光学性能的工程塑料。以异山梨醇和碳酸二甲酯为原料可以制得聚碳酸酯。
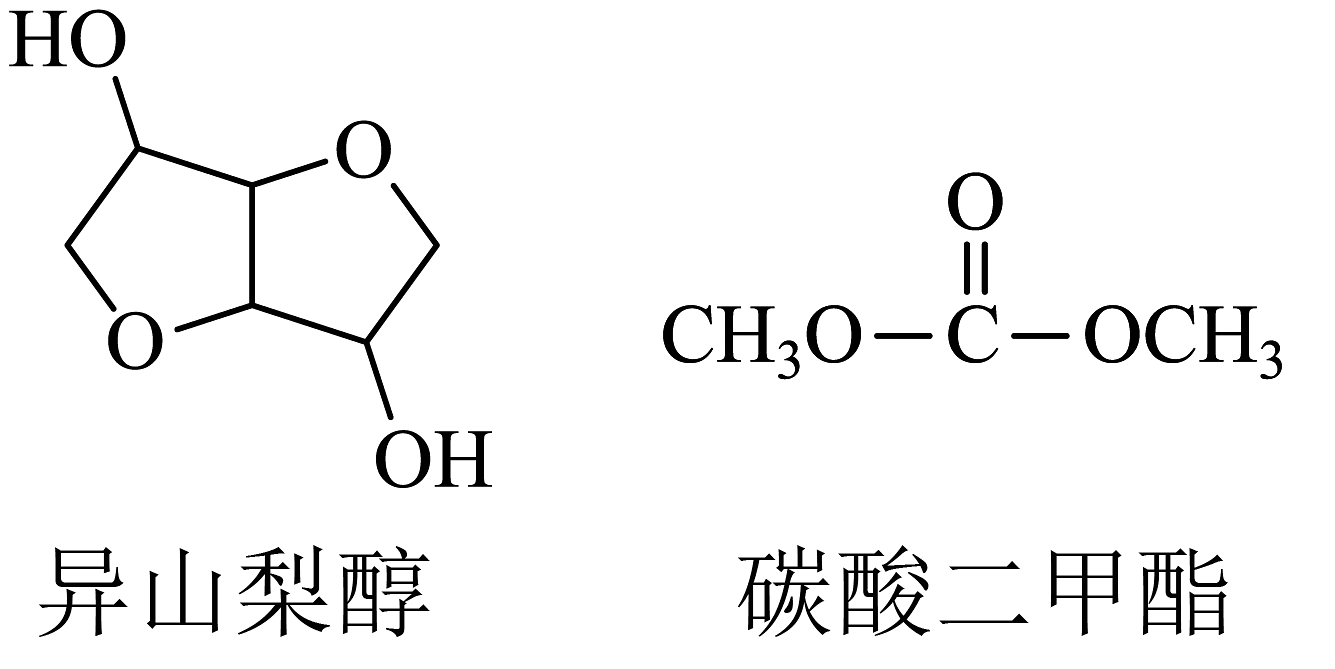
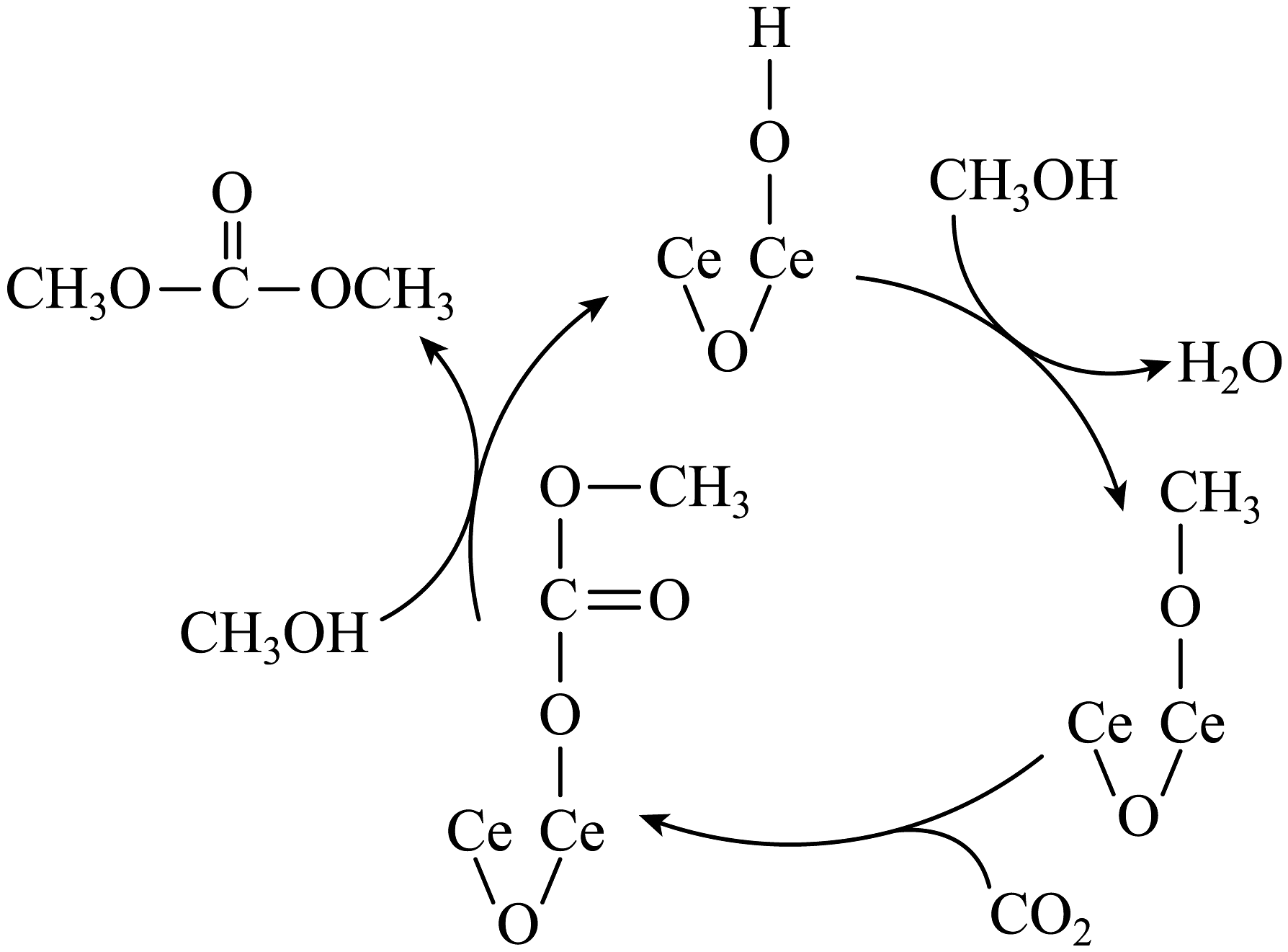
(6)在催化剂表面上,一种合成碳酸二甲酯的反应机理如图,请写出合成碳酸二甲酯的总反应方程式。
(7)异山梨醇和碳酸二甲酯合成聚碳酸酯的路线如下:
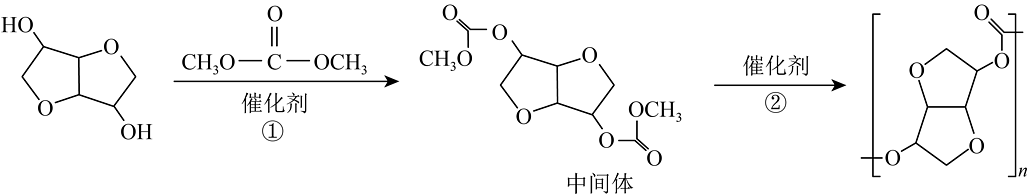 , 反应①中若1mol异山梨醇充分反应,得到的产物除1mol中间体外还有 , ②的反应类型为反应。
, 反应①中若1mol异山梨醇充分反应,得到的产物除1mol中间体外还有 , ②的反应类型为反应。 -
9、从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
 。 (1)、甲的分子式为 , 乙中含氧官能团的名称为。(2)、由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
。 (1)、甲的分子式为 , 乙中含氧官能团的名称为。(2)、由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应①的反应类型为 , 设计步骤①的目的是 , 反应②的化学方程式为。
-
10、回答下列问题:(1)、某烃A的蒸气密度是同条件下氢气密度的64倍,则A的分子式可能为 , 若A中含有6个甲基,且不可能是烯烃与氢气的加成产物,则A的名称是。(2)、已知1mol烃B中含42mol电子,且C、H两种元素的质量比为5∶1,则其分子式为 , 该烃分子中的一个氢原子被溴原子取代后,一共可形成种结构。(3)、0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol,若烃A与HBr加成后只得到一种产物,则A的结构简式为(任写一种)。(4)、工程塑料ABS树脂(结构简式如下),合成时用了三种单体(已知单体A中含有氰基,单体S中含有苯环)。写出三种单体的结构简式:A;B;S。其中B与足量溴的四氯化碳溶液反应后生成产物的结构简式为:。
 (5)、与
(5)、与 互为同分异构体,且一氯代物只有两种的芳香烃的结构简式为。 (6)、向苯酚钠溶液中通入少量的CO2 , 溶液将变浑浊,请写出反应的化学方程式。
互为同分异构体,且一氯代物只有两种的芳香烃的结构简式为。 (6)、向苯酚钠溶液中通入少量的CO2 , 溶液将变浑浊,请写出反应的化学方程式。 -
11、下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
现象
结论
A
向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡再加入0.5mL有机物Y,加热
未出现砖红色沉淀
Y中不含醛基
B
向碳酸钠中加入醋酸溶液,将产生的气体通入苯酚钠溶液中
溶液变浑浊
碳酸的酸性强于苯酚
C
卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液
产生白色沉淀
卤代烃Y中含有氯原子
D
向电石中滴加饱和食盐水,产生的气体通入酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色
产生的气体中含有乙炔
A、A B、B C、C D、D -
12、离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1—乙基—3—甲基咪唑四氟硼酸盐离子液体结构如图所示,下列相关叙述错误的是
 A、该离子液体中C杂化方式为sp2和sp3 B、阴离子呈正四面体形,存在共价键和配位键 C、阳离子中σ键数目是π键数目的10倍 D、该离子液体与水能够形成氢键
A、该离子液体中C杂化方式为sp2和sp3 B、阴离子呈正四面体形,存在共价键和配位键 C、阳离子中σ键数目是π键数目的10倍 D、该离子液体与水能够形成氢键 -
13、蓝印花布是以蓝草中提取的靛蓝为染料。靛蓝是一种古老的蓝色染料,染色过程中涉及反应:

下列有关有机物的性质说法正确的是
A、靛白和靛蓝分子中苯环上的一氯代物均为4种 B、靛蓝既能与盐酸反应,又能与氢氧化钠溶液反应 C、1mol靛蓝最多可以与发生加成反应 D、靛白能发生加成、取代、消去、氧化反应 -
14、下列关于有机物结构对性质影响的说法不合理的是A、乙醇分子中乙基是推电子基团,氧氢键极性比水中的弱,钠与乙醇反应比与水反应慢 B、醛基中氧的电负性大,碳氧双键中电子偏向氧原子,与HCN加成时H连在氧原子上 C、卤代烃分子中卤原子电负性大于碳原子,碳卤键极性强,易断裂,易发生取代反应 D、受推电子基团的影响,乙酸的酸性强于甲酸
-
15、用括号内的试剂和方法除去下列各种物质的少量杂质,不正确的是A、苯中含有甲苯(酸性高锰酸钾溶液、NaOH溶液,分液) B、乙酸乙酯中含有乙酸(饱和碳酸钠溶液,分液) C、苯中含有苯酚(浓溴水,过滤) D、溴乙烷中含有乙醇(水,分液)
-
16、下列各化合物中,能发生加成、酯化、消去、氧化、还原等五种反应的是A、CH3-CH=CH-CHO B、
 C、HOCH2-CH2-CH=CH-CHO
D、
C、HOCH2-CH2-CH=CH-CHO
D、
-
17、下列说法中正确的是A、乙烯能使溴水和酸性KMnO4溶液褪色,两者的反应原理相同 B、邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替出现的结构 C、相同物质的量的乙烯和甲烷完全燃烧消耗的氧气的量相同 D、乙醇、乙酸均能与Na反应放出H2 , 二者分子中官能团相同
-
18、下列有关有机物的性质与应用对应关系正确的是A、乙二醇易溶于水,可用作汽车防冻液 B、乙醛有还原性,可用于制银镜 C、乙炔有可燃性,可用于制导电聚乙炔 D、苯的密度比水小,可用于萃取碘水中的碘
-
19、下列说法正确的是A、聚丙烯的结构简式:
 B、丙烷的球棍模型:
B、丙烷的球棍模型: C、对硝基甲苯的结构简式:
C、对硝基甲苯的结构简式: D、乙炔的电子式:H:C:C:H
D、乙炔的电子式:H:C:C:H
-
20、共轭二烯烃是一类特殊的烯烃,是常见的有机合成原料。以下是以共轭二烯A为原料制备化合物Ⅰ的合成路线(部分反应的条件省略)。
 (1)、用系统命名法为A命名。(2)、反应①的反应类型为________。A、氧化反应 B、聚合反应 C、取代反应 D、加成反应(3)、请写出化合物H的含氧官能团的名称。(4)、下列化合物F可能的结构简式中,最合理的是。
(1)、用系统命名法为A命名。(2)、反应①的反应类型为________。A、氧化反应 B、聚合反应 C、取代反应 D、加成反应(3)、请写出化合物H的含氧官能团的名称。(4)、下列化合物F可能的结构简式中,最合理的是。A.
 B.
B. C.
C. (5)、下列说法正确的是________。(不定项)A、化合物A与B都存在顺反异构体 B、化合物C与G含有的不对称碳原子的个数相同 C、化合物E与G都可以形成分子内氢键 D、化合物E与H互为同分异构体(6)、请写出反应②不使用Cu为催化剂、氧化的原因。(7)、根据题意,化合物H可以由A与J经过一步反应制得,请写出J的结构简式。(8)、请写出一种满足下列条件的化合物E的同分异构体。
(5)、下列说法正确的是________。(不定项)A、化合物A与B都存在顺反异构体 B、化合物C与G含有的不对称碳原子的个数相同 C、化合物E与G都可以形成分子内氢键 D、化合物E与H互为同分异构体(6)、请写出反应②不使用Cu为催化剂、氧化的原因。(7)、根据题意,化合物H可以由A与J经过一步反应制得,请写出J的结构简式。(8)、请写出一种满足下列条件的化合物E的同分异构体。①能与溶液发生显色反应,但不与浓溴水反应生成沉淀。
②分子中有4种化学环境不同的氢原子。
(9)、由化合物A也可以合成化合物B:
请写出化合物K制得B的反应方程式。设计由A合成K的合成路线(必要的有机及无机试剂任选)。(合成路线可表示为:AB目标产物)