相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、化合物F是一种心血管药物,其合成路线如下:
 (1)、C中含氧官能团的名称为。(2)、化合物E中有个手性碳原子。(3)、若A经过步骤得到的产物中有一种C的同分异构体,该产物的结构简式为。(4)、写出同时满足下列条件的A的一种同分异构体的结构简式:。
(1)、C中含氧官能团的名称为。(2)、化合物E中有个手性碳原子。(3)、若A经过步骤得到的产物中有一种C的同分异构体,该产物的结构简式为。(4)、写出同时满足下列条件的A的一种同分异构体的结构简式:。酸性条件下水解生成两种产物;两种产物均含有4种不同化学环境的氢原子,且苯环上的一氯代物均只有2种。
(5)、写出以 和
和 为原料制备
为原料制备 的合成路线流程图 (无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图 (无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
2、以电炉钛渣(主要成分为 , 含少量等)为原料制备催化剂的流程如下:
 (1)、原料
(1)、原料
①晶胞如图-1所示,其中的配位数(与金属离子距离最近且相等的的个数)比大,则处于晶胞体心的离子是。
②常温下,根据计算得到6的溶液中约为 , 实际测得6的溶液中远大于 , 且存在稳定的离子,可能的原因是。
(2)、浸取用浓度均为6的和混合溶液浸取电炉钛渣,中、元素的浸出率随时间的变化如图-2所示。已知:能与反应转化为和;能与生成微溶的。

①浸取时,发生反应的离子方程式为。
②实验表明,用浓度均为6的和混合溶液浸出电炉钛渣的速率高于用12溶液浸出的速率,其原因是。
③为提高元素浸出速率,加料完成后,可采取的措施是。
(3)、加氨加入氨水的目的是。
(4)、催化甲醇水溶液光解制 , 同时可得到、等产物(如图-3所示)。光催化剂的表观量子产率()为60%。实验测得催化剂吸收的光子数为 , 溶液中产生的物质的量为 , 根据以上数据计算生成的物质的量为(不考虑其它产物,写出计算过程)。
-
3、利用作催化剂,可将废气中的转化为硫单质,涉及的反应主要有:
反应
反应
将的混合气体以一定流速通过反应管,其他条件不变,出口处的转化率及S的选择性随温度的变化如图所示。下列说法正确的是
 A、低于300℃时,反应的速率大于反应 B、硫单质的产率随温度的升高而下降 C、300℃时,出口处的气体中的体积分数约为30% D、增大体系压强,S单质的平衡选择性增大
A、低于300℃时,反应的速率大于反应 B、硫单质的产率随温度的升高而下降 C、300℃时,出口处的气体中的体积分数约为30% D、增大体系压强,S单质的平衡选择性增大 -
4、室温下,测定溶液中浓度的流程如下:

已知。下列说法正确的是
A、0.1溶液中: B、“沉淀”后得到的上层清液中: C、溶解得到的酸性溶液中: D、滴定终点时的溶液中: -
5、室温下,下列实验方案能达到探究目的的是
选项
实验方案
探究目的
A
向2浓度均为0.1的和混合溶液中滴加2滴0.1的溶液,观察产生沉淀的颜色
判断与的大小
B
分别向和溶液中滴加几滴酚酞试液,观察溶液颜色
判断和结合能力的强弱
C
向滴有酚酞的溶液中滴加过量氯水,观察溶液颜色
验证氯水的酸性
D
将浓硫酸与反应生成的气体,通入品红溶液中,观察溶液颜色
验证浓硫酸的强氧化性
A、A B、B C、C D、D -
6、利用丹皮酚(X)合成一种药物中间体(Y)的流程如下:

下列有关化合物X、Y的说法不正确的是
A、可以用溶液鉴别X和Y B、该反应属于取代反应 C、反应前后的质量不变 D、X的沸点比 的低
的低
-
7、冶金废水(主要含)通过“电解-碳化”制备的装置如图所示。下列说法不正确的是
 A、M极上产生黄绿色气体 B、电解前后,N极区溶液的基本不变 C、电解总反应为: D、1通过阳离子交换膜时,理论上共产生44.8L的气体
A、M极上产生黄绿色气体 B、电解前后,N极区溶液的基本不变 C、电解总反应为: D、1通过阳离子交换膜时,理论上共产生44.8L的气体 -
8、阅读下列材料,完成下列3个小题。
碳族元素及其化合物在自然界广泛存在且具有重要应用。甲烷是清洁能源,燃烧热大(890.3),完全燃烧生成 , 催化加氢可制;是一种杀菌剂;电解还原可制得半导体材料晶体 , 四氯化锗()水解可得到;醋酸铅[]易溶于水,难电离,醋酸铅溶液可用于吸收气体。
(1)、下列说法正确的是A、晶体属于分子晶体 B、1中含有σ键数为3 C、的空间构型为平面正方形 D、中的C原子和中的原子杂化方式相同(2)、下列化学反应表示正确的是A、甲烷的燃烧: B、电解还原制高纯的阴极反应: C、水解制: D、醋酸铅溶液吸收气体:(3)、下列有关反应的说法正确的是A、反应的 B、反应的平衡常数表达式 C、反应的(表示键能) D、反应在高温、高压和催化剂条件下进行可提高H2的平衡转化率 -
9、光卤石[]可作为提取金属镁的矿物原料。下列说法正确的是A、原子半径: B、第一电离能: C、沸点: D、碱性:
-
10、实验室称量一定质量的固体,并用于测定盐酸的浓度。下列相关原理、装置及操作不正确的是
 A、称量 B、溶解 C、加指示剂 D、滴定
A、称量 B、溶解 C、加指示剂 D、滴定 -
11、反应可实现工业副产品资源再利用。下列说法正确的是A、O元素位于周期表ⅥA族 B、电子式为
 C、基态的电子排布式为
D、中既含极性键又含非极性键
C、基态的电子排布式为
D、中既含极性键又含非极性键
-
12、下列用于水处理的物质,主要成分属于有机物的是A、活性炭 B、聚丙烯滤膜 C、明矾 D、二氧化氯
-
13、由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
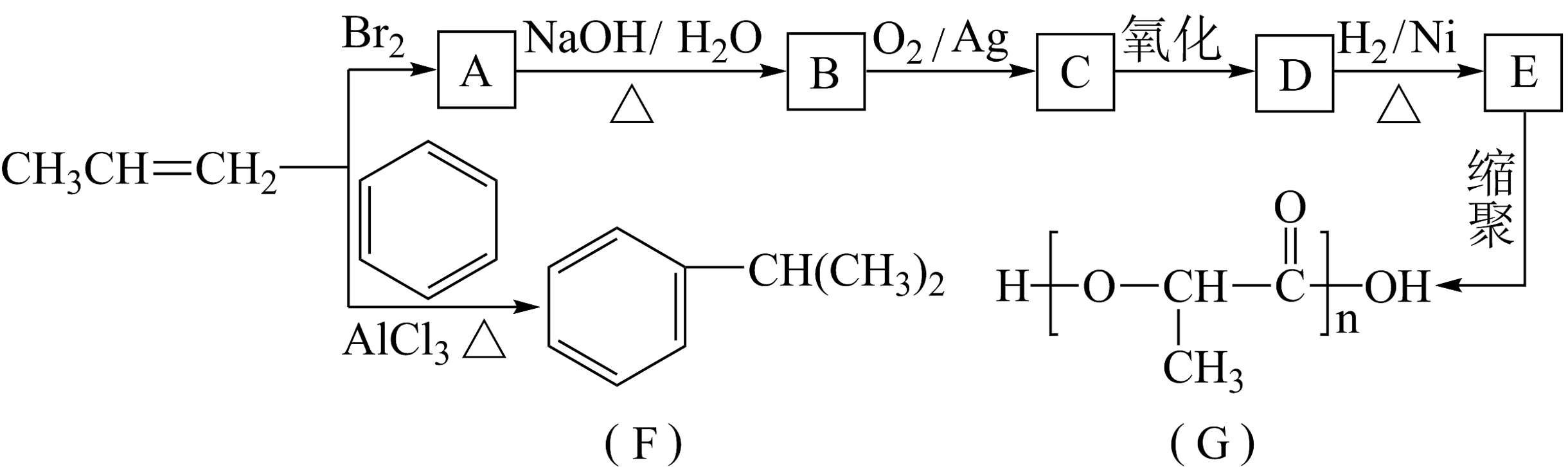 (1)、C中含氧官能团的名称是。(2)、生成F的反应类型:。(3)、B转化为C的化学方程式为。(4)、F的芳香同分异构体有种,其中核磁共振氢谱中显示峰面积比为3:1的同分异构体的结构简式为。(5)、写出由
(1)、C中含氧官能团的名称是。(2)、生成F的反应类型:。(3)、B转化为C的化学方程式为。(4)、F的芳香同分异构体有种,其中核磁共振氢谱中显示峰面积比为3:1的同分异构体的结构简式为。(5)、写出由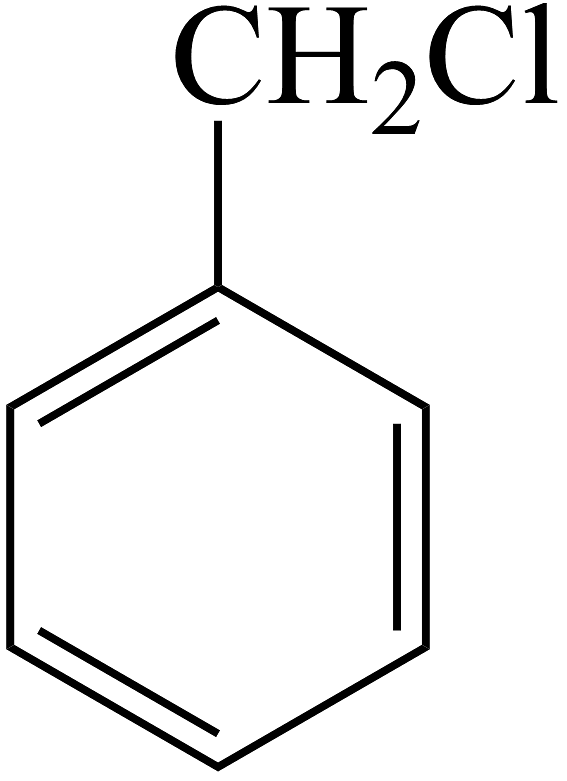 合成
合成 (合成路线常用表示方法为)。
(合成路线常用表示方法为)。 -
14、铬(Cr)、锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:(1)、基态铬原子的价层电子排布式为。(2)、含铬化合物CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为析。
A.
 B.
B. C.
C. (3)、已知金属锰有多种晶型,型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原子数为。
(3)、已知金属锰有多种晶型,型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原子数为。A.
 B.
B. C.
C. D.
D. (4)、[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2 , DMSO中硫原子的杂化轨道类型为 , ClO的空间构型是。(5)、①NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为1,1,1),则C的离子坐标参数为。
(4)、[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2 , DMSO中硫原子的杂化轨道类型为 , ClO的空间构型是。(5)、①NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为1,1,1),则C的离子坐标参数为。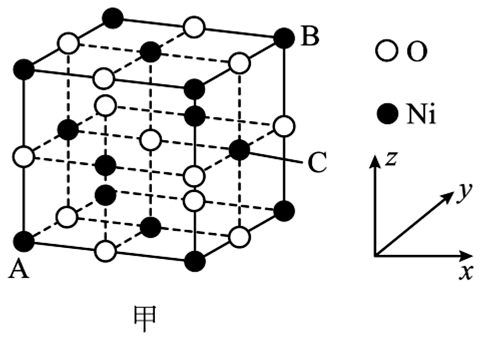
②一定温度下,NiO可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列(O2-之间相切),Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA , 每平方米面积上具有该单分子层的质量为g(用含a、NA的代数式表示)。

-
15、有机物a是一种重要的化工原料,其分子式为C5H10 , 结构简式为(H3C)2C=CH—CH3 , 有机物a在一定条件下能发生如图所示的反应,其中b为高分子化合物。

已知:
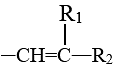 —COOH+
—COOH+ (R1、R2为烃类基团)(1)、a的名称是。(2)、b的结构简式为。(3)、下列关于b的说法正确的是(填标号)。
(R1、R2为烃类基团)(1)、a的名称是。(2)、b的结构简式为。(3)、下列关于b的说法正确的是(填标号)。A.为混合物 B.能使酸性高锰酸钾溶液褪色 C.0.1molb完全燃烧可消耗7.5molO2
(4)、a→d的反应类型为。(5)、有机物a与酸性高锰酸钾溶液反应的有机产物除了H3C-CO-CH3 , 还有。(6)、a的一种同分异构体具有顺反异构,写出其顺式结构:。(7)、已知不对称烯烃加成时氢原子首先加到碳碳双键上含氢较多的碳上:根据信息写出a→c的化学方程式:。 -
16、某届奥运会上,有个别运动员因服用兴奋剂被取消参赛资格。如图是检测出兴奋剂的某种同系物X的结构,下列关于X的说法正确的是
 A、1molX与NaOH溶液反应最多消耗4molNaOH B、X能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键 C、1molX与足量的饱和溴水反应,最多消耗4molBr2 D、1molX与足量H2反应最多消耗6molH2
A、1molX与NaOH溶液反应最多消耗4molNaOH B、X能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键 C、1molX与足量的饱和溴水反应,最多消耗4molBr2 D、1molX与足量H2反应最多消耗6molH2 -
17、环辛四烯
 、立方烷
、立方烷 、苯乙烯
、苯乙烯 分子式均为C8H8 , 下列对这三种化合物的叙述中正确的是 A、环辛四烯的七氯代物有2种 B、苯乙烯最多能与1molH2发生加成反应 C、三者均属于不饱和烃 D、苯乙烯中的所有碳原子可能共平面
分子式均为C8H8 , 下列对这三种化合物的叙述中正确的是 A、环辛四烯的七氯代物有2种 B、苯乙烯最多能与1molH2发生加成反应 C、三者均属于不饱和烃 D、苯乙烯中的所有碳原子可能共平面 -
18、下列实验操作、现象、结论均正确的是
实验操作
现象
结论或目的
A
向等体积乙醇与水中分别加入等质量金属钠
都产生具有可燃性的气体
乙醇中羟基H原子与水中H原子的活性一样
B
将光亮的铜丝在酒精灯火焰上加热,立即伸入无水乙醇中
铜丝先变黑后恢复成原来的颜色
乙醇被氧化,铜作氧化剂
C
常温下,将二氧化碳通入苯酚钠溶液
溶液变浑浊
制得苯酚,同时生成碳酸氢钠
D
将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液
产生淡黄色沉淀
检验溴乙烷中的溴元素
A、A B、B C、C D、D -
19、绥阳金银花是贵州特产之一,有抗菌、解热、增强免疫等功效,其所含咖啡酰奎尼酸结构如图所示。下列说法正确的是
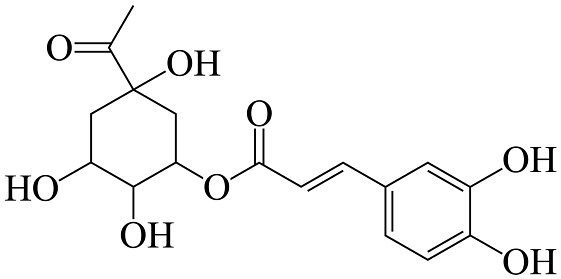 A、分子中所有碳原子有可能在同一平面内 B、1mol该有机物最多与3molNa反应 C、分子中碳原子的杂化类型有sp、sp2、sp3三种 D、该有机物遇氯化铁溶液会发生显色反应,有四个手性碳原子
A、分子中所有碳原子有可能在同一平面内 B、1mol该有机物最多与3molNa反应 C、分子中碳原子的杂化类型有sp、sp2、sp3三种 D、该有机物遇氯化铁溶液会发生显色反应,有四个手性碳原子 -
20、如图为几种晶体或晶胞的结构示意图,下列说法错误的是

 A、晶胞A的化学式是LaNi4 B、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 C、碘单质是分子晶体,碘单质在CCl4中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:金刚石>MgO>碘单质
A、晶胞A的化学式是LaNi4 B、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 C、碘单质是分子晶体,碘单质在CCl4中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:金刚石>MgO>碘单质