-
1、为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾(FeSO4·7H2O),其工艺流程如下图。

回答下列问题:
(1)、滤液1中含有的阴离子有。(2)、“反应1”中得到Al(OH)3的离子方程式是。(3)、滤液3长期露置于空气中可能会引入杂质(填离子符号),验证是否存在该杂质离子的灵敏试剂是(填试剂名称)。(4)、若有ag合金废料,热分解2得到的Al2O3的质量为bg,则合金废料中Al的质量分数是;Al与碱液的反应中氧化剂是 , 并写出该氧化剂的电子式是。 -
2、家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,回答下列问题。
铝镁咀嚼片
【药品名】铝镁咀嚼片
【成分】氢氧化镁、氢氧化铝、二甲基硅油
【适应症】胃酸过多引起的胃痛、烧心等胃胀气的治疗
食用盐
【配料表】精制盐、碘酸钾
【碘含量(以计)】21mgkg-39mgkg
【保质期】36个月
(1)、标签中涉及到的元素Al在周期表中的位置是。(2)、标签中涉及到的元素位于第三周期的有种,原子半径由大到小的排序是。(3)、氢氧化铝治疗胃酸过多时,发生反应的化学方程式是。(4)、食用盐的主要成分为氯化钠,氯化钠含有的化学键是;碘酸钾在水溶液中的电离方程式是;碘酸钾和碘化钾在酸性溶液中能发生反应生成使淀粉变蓝的物质,写出该反应的离子方程式并用单线桥法标出电子转移的方向和数目。 -
3、1869年,俄国化学家门捷列夫制作了第一张元素周期表。下表是元素周期表的一部分,表中所列的字母分别代表某-化学元素。回答下列问题:
 (1)、单质e、f、g分别与足量的盐酸反应产生相同体积的气体,反应最快的是(填化学式),参与反应的e、f、g的质量比是。(2)、g和j形成的化合物溶液中滴加氨水至过量,看到的现象是。(3)、a与b形成的化合物M中a的质量分数为25%,写出该化合物M的结构式。(4)、h、i、j的简单氢化物的稳定性最弱的是(填化学式)。(5)、火箭发动机曾经利用c2a4作燃料,a2d2作助燃剂,产物环保无污染,写出二者反应的化学方程式。(6)、设计实验证明非金属性j>k:。
(1)、单质e、f、g分别与足量的盐酸反应产生相同体积的气体,反应最快的是(填化学式),参与反应的e、f、g的质量比是。(2)、g和j形成的化合物溶液中滴加氨水至过量,看到的现象是。(3)、a与b形成的化合物M中a的质量分数为25%,写出该化合物M的结构式。(4)、h、i、j的简单氢化物的稳定性最弱的是(填化学式)。(5)、火箭发动机曾经利用c2a4作燃料,a2d2作助燃剂,产物环保无污染,写出二者反应的化学方程式。(6)、设计实验证明非金属性j>k:。 -
4、利用绿矾制备还原铁粉的工业流程如下,下列说法正确的是( )
 A、“转化”步骤中理论上消耗的NH4HCO3与FeSO4·7H2O的物质的量之比为1:1 B、干燥过程若在空气中进行,会有少量FeCO3被氧化为FeOOH,发生反应的化学方程式为2FeCO3+O2+H2O=2FeOOH+2CO2 C、“焙烧”操作应在蒸发皿中进行 D、“焙烧”中氧化剂和还原剂的物质的量之比为1:2:
A、“转化”步骤中理论上消耗的NH4HCO3与FeSO4·7H2O的物质的量之比为1:1 B、干燥过程若在空气中进行,会有少量FeCO3被氧化为FeOOH,发生反应的化学方程式为2FeCO3+O2+H2O=2FeOOH+2CO2 C、“焙烧”操作应在蒸发皿中进行 D、“焙烧”中氧化剂和还原剂的物质的量之比为1:2: -
5、下列实验装置能达到实验目的的是( )
A
B
C
D

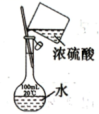


验证C的非金属性强于Si
浓硫酸的稀释
除二氧化碳中的氯化氢气体
制备NaHCO3
A、A B、B C、C D、D -
6、配制450mL1.00mol/L的NaOH溶液,下列说法不正确的是( )
 A、上述实验操作的顺序为:④②①③ B、将NaOH固体在烧杯中溶解后,立即转移到容量瓶中 C、实验中可用④称量20.0gNaOH固体 D、③操作时,若俯视刻度线,配得的NaOH溶液浓度偏高
A、上述实验操作的顺序为:④②①③ B、将NaOH固体在烧杯中溶解后,立即转移到容量瓶中 C、实验中可用④称量20.0gNaOH固体 D、③操作时,若俯视刻度线,配得的NaOH溶液浓度偏高 -
7、下列关于元素周期表及周期律的叙述,其中不正确的有( )
①两原子的核外电子排布完全相同,则其物理性质一定相同
②K在氧气中剧烈燃烧,产物是K2O,其水溶液是一种强碱
③砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
④稀有气体元素原子的最外层都排有8个电子
⑤氟元素原子的核外电子排布示意图为
 , 则
, 则 的化学性质与氟元素原子相似
的化学性质与氟元素原子相似⑥非金属元素呈现的正化合价不超过该元素原子核外最外层电子数
A、2个 B、3个 C、4个 D、5个 -
8、设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、25℃101kPa,2.24LSO2分子中含有的氧原子数小于0.2NA B、22gCO2和N2O混合气体中含有电子数为11 NA C、常温下,将7.1gCl2通入水中,转移的电子数为0.1NA D、1L0.1mol/L的HCl溶液中含氢原子数大于0.1NA
-
9、下列有关金属及其化合物的说法正确的是( )A、FeSO4溶液若变质,可加入Cu复原 B、FeO不稳定,在空气中受热迅速转化为Fe2O3 C、金属元素在自然界中都以化合态形式存在 D、将mg组成不同的铝钠合金分别投入足量盐酸中,铝的质量分数越大,放出H2越多
-
10、根据下列实验操作和现象所得到的结论正确的是( )
选项
操作和现象
结论
A
向某钠盐溶液中加入盐酸,产生的无色无味气体能使澄清石灰水变浑浊
原溶液为碳酸钠溶液
B
亚磷酸(H3PO3)中加入过量NaOH溶液生成NaHPO3
H3PO3属于二元酸
C
足量Fe在少量Cl2中燃烧,铁有剩余
铁在少量氯气中燃烧生成FeCl2
D
在硫酸酸化的KMnO4溶液中加入Na2S溶液,再滴加BaCl2溶液,产生白色沉淀
将S2-氧化成
A、A B、B C、C D、D -
11、现有短周期主族元素X、Y,Z、R、T,X与Y可形成X2Y、X2Y2型化合物,R的一种原子可以用于测定文物的年代,Z是短周期中金属性最强的元素,Z与T形成化学式为Z2T的化合物,五种元素的原子半径与原子序数的关系如图所示。下列说法正确的是( )
 A、Y与Z形成的化合物阴阳离子个数比是1:1 B、1molZ2Y2与足量的RY2反应,转移电子数为2NA C、含氧酸酸性:T>R D、X2Y、X2Y2的化学键类型不完全相同
A、Y与Z形成的化合物阴阳离子个数比是1:1 B、1molZ2Y2与足量的RY2反应,转移电子数为2NA C、含氧酸酸性:T>R D、X2Y、X2Y2的化学键类型不完全相同 -
12、碘元素的一种核素可用于治疗肿瘤。下列说法正确的是( )A、1mol有的中子数为53NA B、和互为同素异形体 C、含有碘元素的物质均可使淀粉变蓝 D、1个原子的质量g
-
13、一种具有磁性的“纳米药物”如图所示,可利用磁性引导该药物到达人体内的病变部位。该技术可大大提高治疗效果。下列有关说法正确的是( )
 A、该药物具有磁性与Fe3O4外壳有关,Fe3O4为红棕色粉末 B、Fe3O4可通过Fe与水蒸气在高温下反应制得 C、二氧化硅属于酸性氧化物,可溶于水生成硅酸 D、该药物分散于水中得到的分散系可以产生丁达尔效应
A、该药物具有磁性与Fe3O4外壳有关,Fe3O4为红棕色粉末 B、Fe3O4可通过Fe与水蒸气在高温下反应制得 C、二氧化硅属于酸性氧化物,可溶于水生成硅酸 D、该药物分散于水中得到的分散系可以产生丁达尔效应 -
14、下列各组物质的性质比较正确的是( )A、微粒半径:S2->S>Na+>H+ B、氢化物的水溶液的酸性:HF>H2S>Hl C、碱性:NaOH>Mg(OH)2>Ca(OH)2>KOH D、熔点:F2>Cl2>Br2>I2
-
15、常温下,在溶液中不能大量共存的离子组是( )A、Fe2+、K+、、Cl- B、Mg2+、Na+、Br-、 C、Ag+、H+、、I- D、Ba2+、、Cl-、
-
16、下列化学用语正确的是( )A、用电子式表示CO2的形成:
 B、S2-的结构示意图:
B、S2-的结构示意图: C、溴化钠的电子式:
C、溴化钠的电子式: D、HClO的结构式:H—Cl—O
D、HClO的结构式:H—Cl—O
-
17、2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念。下列说法正确的是( )A、本届亚运会的火炬燃料是零碳甲醇,甲醇属于电解质 B、火炬“薪火”的火焰呈黄色,是因为发生了化学变化 C、亚运会纪念章“琮琮”是由锌合金镀金制成的,锌合金熔点低于锌 D、吉祥物“江南忆”机器人所采用芯片的主要成分为硅,属于金属材料
-
18、燃油汽车的尾气处理是汽车行业研究的重点之一,其中涉及部分反应如下:
ⅰ.
ⅱ.
ⅲ.
回答下列问题:
(1)、。(2)、反应ⅱ的速率方程可表示为 , , 其中、分别为正、逆反应的速率常数(只与温度有关)。①反应ⅱ的平衡常数(用含、的代数式表示)。
②下图中有两条线为正、逆反应速率常数的对数()与温度的线性关系,其中能表示与温度关系的曲线为(填“a”“b”“c”或“d”,下同),能表示与温度关系的曲线为。
 (3)、一定温度下,向某1 L刚性密闭容器中加入0.2 mol NO(g)和0.2 mol CO(g),只发生反应ⅱ,10 min时达到平衡状态,此时生成CO2(g)的物质的量为0.1 mol。
(3)、一定温度下,向某1 L刚性密闭容器中加入0.2 mol NO(g)和0.2 mol CO(g),只发生反应ⅱ,10 min时达到平衡状态,此时生成CO2(g)的物质的量为0.1 mol。①0~10 min内该反应的反应速率。
②容器内压强不再发生变化(填“能”或“不能”)说明反应达到平衡状态,原因为。
③该温度下反应ⅱ的平衡常数。
-
19、氨是重要的化工原料。回答下列问题:(1)、Ⅰ.某混合溶液始终满足 , 通过调节溶液的pOH[],和的变化曲线如下图。

①随pOH变化的曲线为(填“L1”或“L2”)。
②。
③若a点为氨水和NH4Cl溶液等体积混合所得,则混合前NH4Cl溶液的物质的量浓度为(填选项字母)。
A. B. C.(2)、Ⅱ.工业上合成氨的原理为 。提高H2平衡转化率的具体措施为(任写两条);若按投入密闭容器进行反应,平衡时二者转化率关系:(填“>”“=”或“<”)。
(3)、一定条件下,用铁粉作催化剂,合成氨的部分历程如下图,“*”表示吸附在催化剂表面。
①催化剂能改变合成氨的(填“活化能”或“反应热”)。
②上述反应历程中决速步骤的方程式为。
(4)、工业上将合成氨设计为原电池如下图,其中钯电极A上的电极反应式为。
-
20、氯碱工业指的是工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2),并以它们为原料生产一系列化工产品。氯碱工业是最基本的化学工业之一。(1)、Ⅰ.电解饱和氯化钠溶液的装置如下图。
高浓度食盐水的投料口为(填“a”或“b”),制取的浓氢氧化钠溶液应从(填“c”或“d”)口输出。 (2)、X应与电源的(填“正极”或“负极”)相连。(3)、上述装置中总反应的离子方程式为。(4)、Ⅱ.实验室测定氯碱工业所得NaOH溶液浓度的实验步骤如下。
(2)、X应与电源的(填“正极”或“负极”)相连。(3)、上述装置中总反应的离子方程式为。(4)、Ⅱ.实验室测定氯碱工业所得NaOH溶液浓度的实验步骤如下。步骤1:量取10.00 mL氯碱工业所得NaOH溶液,加水稀释并最终配制成1000 mL溶液;
步骤2:量取20.00 mL所配溶液于锥形瓶,加入少量酚酞备用;
步骤3:用 HCl溶液滴定至终点后记录数据并计算。
滴定过程中仪器的选择及读数如下图。

步骤2中量取所配溶液时应选用滴定管(填“A”或“B”)。
(5)、步骤3中消耗HCl溶液的体积为。(6)、滴定至终点时的实验现象为。(7)、氯碱工业所得NaOH溶液浓度为;滴定过程中若未用HCl溶液润洗滴定管,则最终测得NaOH溶液的浓度会(填“偏大”“偏小”或“无影响”)。