-
1、下图是利用滴定管进行实验,对于滴定实验过程,下列说法错误的是( )
 A、滴定管润洗后,润洗液应从滴定管下口流出 B、用0.1000mol·L-1NaOH溶液滴定20.00mLHA溶液过程中,若使用酚酞作指示剂,会产生系统误差,测得HA溶液浓度会偏大 C、除去碱式滴定管胶管内气泡时,将尖嘴垂直向下,挤压胶管内玻璃球 D、该滴定管可以盛装酸性高锰酸钾溶液
A、滴定管润洗后,润洗液应从滴定管下口流出 B、用0.1000mol·L-1NaOH溶液滴定20.00mLHA溶液过程中,若使用酚酞作指示剂,会产生系统误差,测得HA溶液浓度会偏大 C、除去碱式滴定管胶管内气泡时,将尖嘴垂直向下,挤压胶管内玻璃球 D、该滴定管可以盛装酸性高锰酸钾溶液 -
2、我国科学家在一颗距离地球100光年的行星上发现了不可思议的“水世界”,引起了全球科学界的轰动。下列有关说法错误的是( )A、温度升高,水的电离平衡正向移动,c(H+)增大,但溶液仍然保持中性 B、室温下,pH=4的盐酸溶液中,c水(H+)=5×10-9mol·L-1 C、由水电离出的c水(H+)=c水(OH-)时,溶液不一定呈中性 D、向水中加入固体后(溶液温度不变),水的电离程度减小
-
3、A、B、C、D、E 五种元素在周期表中的相对位置如图所示,下列说法正确的是( )
A
B
C
D
E
A、C的简单离子是它所在周期元素中离子半径最小的离子 B、D和E两元素的氧化物对应水化物的酸性E>D C、B是周期表中电负性最强的元素 D、该五种元素中第一电离能由大到小进行排序为:B>A>E>D>C -
4、氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为:N2(g)+3H2(g)⇌2NH3(g) ∆H,工业上可利用氨气等制取硝酸。有关工业合成氨的反应下列有关说法正确的是( )A、其它条件不变,升高温度,可提高活化分子百分数,加快反应速率 B、反应的∆H=3E(N-N)+3E(H-H)-6E(N-H) (E表示键能) C、2mol N—H断裂同时有1mol H-H形成,说明达该条件下的平衡状态 D、将氨气液化并移走,可提高原料的平衡转化率及平衡时的反应速率
-
5、已知制备光气COCl2的反应为CO(g)+Cl2(g)⇌COCl2(g) ∆H<0,将等物质的量的CO(g)和Cl2(g)充入密闭容器中,平衡体系中,平衡混合物的平均摩尔质量M()在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
 A、温度:T1<T2 B、平衡常数:Ka=Kb<Kc C、Cl2的平衡转化率:c>b>a D、b点时,若M=66g·mol-1 , 则CO的平衡转化率为50%
A、温度:T1<T2 B、平衡常数:Ka=Kb<Kc C、Cl2的平衡转化率:c>b>a D、b点时,若M=66g·mol-1 , 则CO的平衡转化率为50% -
6、某兴趣小组进行了如下实验:向酸化的H2O2溶液中同时加入KI溶液、维生素C和淀粉溶液,发现一段时间后溶液变蓝。查阅资料可知体系中存在两个主要反应:
反应ⅰ:H2O2+2I-+2H+=I2+2H2O
反应ⅱ:C6H8O6(维生素C)+I2=C6H6O6+2I-+2H+
下列说法不正确的是( )
A、反应速率:反应ⅰ<反应ⅱ B、可得氧化性强弱:H2O2>I2>C6H6O6 C、溶液的pH始终保持不变 D、溶液最终变蓝,说明所加n(H2O2)>n(C6H6O6) -
7、MnO2-CeO2催化剂能催化NH3脱除烟气中的NO,反应方程为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),其机理如图所示。下列说法正确的是( )
 A、该反应∆S<0 B、该反应的平衡常数 C、步骤Ⅰ可描述为NH3吸附到MnO2表面与表面吸附氧反应生成—NH2和H2O,同时MnO2被还原为Mn2O3;烟气中的NO和—NH2反应生成N2和H2O D、该反应中每消耗1mol O2 , 转移电子的数目约为4×6.02×1023
A、该反应∆S<0 B、该反应的平衡常数 C、步骤Ⅰ可描述为NH3吸附到MnO2表面与表面吸附氧反应生成—NH2和H2O,同时MnO2被还原为Mn2O3;烟气中的NO和—NH2反应生成N2和H2O D、该反应中每消耗1mol O2 , 转移电子的数目约为4×6.02×1023 -
8、根据下列图示所得出的结论正确的是( )
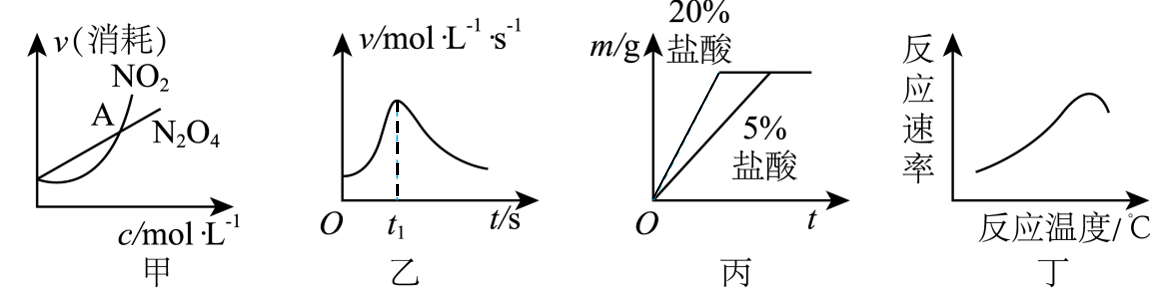 A、图甲表示恒温恒容条件下,2NO2(g)⇌N2O4(g)中各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 B、图乙是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高 C、图丙表示取规格相同的铝片,分别放入等质量20%、5%的稀盐酸中,生成氢气的质量与反应时间的关系曲线 D、图丁可以表示酶催化反应的反应速率随反应温度的变化
A、图甲表示恒温恒容条件下,2NO2(g)⇌N2O4(g)中各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 B、图乙是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高 C、图丙表示取规格相同的铝片,分别放入等质量20%、5%的稀盐酸中,生成氢气的质量与反应时间的关系曲线 D、图丁可以表示酶催化反应的反应速率随反应温度的变化 -
9、NF3是微电子工业中一种优良的等离子蚀刻气体,在空气中性质稳定。其中N—F键能为283 kJ·mol , 测得断裂氮气、氟气中的化学键所需的能量如图:

下列说法错误的是( )
A、相同条件下,N2化学性质比F2更稳定 B、氮气和氟气的能量总和比NF3低 C、N2(g)+3F2(g)⇌2NF3(g) ∆H=-287.6kJ·mol-1 D、NF3在大气中性质比较稳定,不易发生化学反应 -
10、三氯蔗糖(结构如图所示),又名蔗糖素,其甜度约为蔗糖的600倍,具有热量低、安全性高等优点,可供糖尿病患者食用,被认为是几乎完美的甜味剂。下列说法正确的是( )
 A、氯元素的和轨道形状均为球形 B、氧元素的能级的轨道数相同 C、基态碳原子的L层没有成对电子 D、基态氯原子的价电子排布式为3s23p6
A、氯元素的和轨道形状均为球形 B、氧元素的能级的轨道数相同 C、基态碳原子的L层没有成对电子 D、基态氯原子的价电子排布式为3s23p6 -
11、创造美好幸福生活离不开化学。下列有关叙述正确的是( )A、硅光电池工作时能量转化:光能→化学能→电能。 B、杭州第19届亚运会主火炬首次采用“零碳甲醇”为燃料,“零碳甲醇”燃烧不产生CO2。 C、成都大运会上璀璨的焰火与电子的跃迁有关 D、我国西周时期发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理
-
12、已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g),在610K时,将0.10molCO2与0.40molH2S充入1L的空钢瓶中,反应平衡后水的物质的量分数为0.02。(1)、计算H2S的平衡转化率a= (写出计算过程)。(2)、计算浓度平衡常数K=。(写出计算过程)。
-
13、二氧化碳、甲烷是地球大气中的主要温室气体,它们能吸收地面反射的太阳辐射,使地球表面变暖,因此,对二氧化碳、甲烷的高效利用有着举足轻重的作用。回答下列问题:(1)、已知下列反应
①CH4(g)+H2O(g)CO(g)+3H2(g) △H1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2
则二氧化碳重整甲烷反应:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3=。
(2)、恒温恒容密闭容器中,反应CH4(g)+CO2(g)2CO(g)+2H2(g)达到平衡状态的标志是____。A、容器内的压强保持不变 B、c(CH4):c(CO2):c(CO):c(H2)=1:1:2:2 C、混合气体的平均分子量保持不变 D、混合气体的颜色保持不变 E、单位时间内断裂C-H键和形成H-H键的数目之比为2:1(3)、反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数的表达式为。(4)、T℃时,向恒容密闭容器中投入CH4和CO2各1mol,发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得容器内的气体压强随时间的变化如下表所示(气态物质分压=总压×气态物质的物质的量分数,不考虑其他副反应):时间/min
0
10
20
30
50
60
总压/kPa
100
118
132
141
148
148
①在0~20min内,平均反应速率v(CO)=kPa/min。
②若在恒温恒压密闭容器中进行上述反应,CH4的转化率将(填增大、减小、不变)。
-
14、电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。(1)、已知部分弱酸的电离常数如下表:
弱酸
CH3COOH
HCN
H2CO3
电离常数(25℃)
Ka = 1.8×10-5
Ka=4.3×10-10
Ka1=5.0×10-7 Ka2=5.6×10-11
①常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3 , 其物质的量浓度由大到小的顺序是(填编号)。
②将少量CO2通入NaCN溶液,反应的离子方程式是。
③室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是 , 溶液中c(CH3COO-)/c(CH3COOH) =
(2)、室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.100mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
① d点所示的溶液中离子浓度由大到小的顺序依次为。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=(用溶液中的其它离子浓度表示)。
-
15、CoC2O4是制备氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO、CaO、MgO碳及有机物等)制取CoC2O4的工艺流程如下:
 (1)、为了加快“碱浸”速率,可采用的方法有(写一种即可)。“浸出液”的主要成分是(填化学式)。(2)、“钴浸出”过程中Co3+转化为Co2+ , 反应的离子方程式为。(3)、“除杂1”过程中,在40~50℃加入H2O2 , 写出加入H2O2反应的主要离子方程式为。(4)、“除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则滤液中c(Mg2+)为[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2) =1.05×10-10]。(5)、萃取剂对金属离子的萃取率与pH的关系如图所示,经过萃取可除去Mn2+ , 需控制溶液的pH范围是____(填字母)。
(1)、为了加快“碱浸”速率,可采用的方法有(写一种即可)。“浸出液”的主要成分是(填化学式)。(2)、“钴浸出”过程中Co3+转化为Co2+ , 反应的离子方程式为。(3)、“除杂1”过程中,在40~50℃加入H2O2 , 写出加入H2O2反应的主要离子方程式为。(4)、“除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则滤液中c(Mg2+)为[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2) =1.05×10-10]。(5)、萃取剂对金属离子的萃取率与pH的关系如图所示,经过萃取可除去Mn2+ , 需控制溶液的pH范围是____(填字母)。 A、1.0~2.0 B、2.0~3.0 C、3.0~3.5
A、1.0~2.0 B、2.0~3.0 C、3.0~3.5 -
16、铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
Ⅰ.铁元素的检验
 (1)、Ⅰ.铁元素的检验
(1)、Ⅰ.铁元素的检验
“操作”是指。上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的(填写仪器名称)。
 (2)、取待测液少许,滴加K3[Fe(CN)6]溶液,观察到有蓝色沉淀生成;另取待测液少许,滴加(填化学式)溶液,观察到溶液变为红色,由此可得出结论(填字母序号)。
(2)、取待测液少许,滴加K3[Fe(CN)6]溶液,观察到有蓝色沉淀生成;另取待测液少许,滴加(填化学式)溶液,观察到溶液变为红色,由此可得出结论(填字母序号)。a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
(3)、Ⅱ.铁元素含量的测定利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤Ⅰ:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀H2SO4溶液,用0.0020mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①用KMnO4标准溶液滴定至终点的标志是。
②黑木耳中铁的含量为mg/100g(即每100g黑木耳中含铁元素的质量)。
-
17、25℃下,向20 mL 0.1 mol·L-1H2A溶液中滴加0.1 mol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是( )
 A、H2A属于强酸 B、c(HA-)/c(H2A)随着V[NaOH(aq)]的增大而减小 C、V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol/L D、V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
A、H2A属于强酸 B、c(HA-)/c(H2A)随着V[NaOH(aq)]的增大而减小 C、V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol/L D、V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) -
18、俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,反应过程如下图:

下列说法正确的是( )
A、2molH2(g)与1molO2(g)所具有的总能量比2molH2O(g)所具有的总能量低 B、一定条件下,反应2H2(g)+O2(g)=2H2O(g)能自发进行 C、火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g)△H=-483.6kJ/mol D、H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 -
19、下列研究目的和示意图相符的是( )
选项
A
B
C
D
研究目的
密闭容器中,压强对反应:2SO2(g)+O2(g)2SO3(g)的影响
固定容积的密闭容器中,温度对反应:N2(g)+3H2(g)2NH3(g) ΔH<0的影响
等质量Na、K分别与足量水反应
固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g)CO2(g)+H2(g)的影响
示意图



 A、A B、B C、C D、D
A、A B、B C、C D、D -
20、Al-Ag2O电池用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是( )
 A、电子由Al电极通过外电路流向Ag2O/Ag电极 B、电池负极附近溶液pH下降 C、溶液中OH-向Al电极移动 D、Al极反应式为:Al-3e-+3OH-=Al(OH)3
A、电子由Al电极通过外电路流向Ag2O/Ag电极 B、电池负极附近溶液pH下降 C、溶液中OH-向Al电极移动 D、Al极反应式为:Al-3e-+3OH-=Al(OH)3