-
1、在酸性条件下,黄铁矿()催化氧化反应的离子方程式为: , 实现该反应的物质间转化如图。下列分析不正确的是( )
 A、在酸性条件下,黄铁矿催化氧化中NO做催化剂 B、反应Ⅱ中做氧化剂,被氧化 C、反应Ⅰ中做氧化剂 D、反应Ⅲ的离子方程式为 , 该反应不是氧化还原反应
A、在酸性条件下,黄铁矿催化氧化中NO做催化剂 B、反应Ⅱ中做氧化剂,被氧化 C、反应Ⅰ中做氧化剂 D、反应Ⅲ的离子方程式为 , 该反应不是氧化还原反应 -
2、侯氏制碱法的工业流程如图:

下列说法不正确的是( )
A、“沉淀池”的饱和食盐水中先通入足量CO2 , 再通入NH3 B、从“母液”中可获得副产品NH4Cl C、循环利用的物质X是CO2 D、用AgNO3溶液和稀硝酸检验Na2CO3中是否含有NaCl -
3、以化合价为纵坐标,物质类别为横坐标的图像称为价类二维图.在地壳中的金属含量仅次于铝的某元素价类二维图如图所示,下列说法错误的是( )
 A、a与水常温下几乎不发生反应,但在高温下可发生置换反应 B、和可分别与水发生反应生成和 C、e在潮湿的空气中容易转变为 D、的某种盐可以用作净水剂
A、a与水常温下几乎不发生反应,但在高温下可发生置换反应 B、和可分别与水发生反应生成和 C、e在潮湿的空气中容易转变为 D、的某种盐可以用作净水剂 -
4、下列实验装置及实验结果合理的是( )




图1
图2
图3
图4
A、实验室用图1所示装置制备少量氧气 B、实验室用图2所示装置测定氯水的pH C、实验室用图3所示装置制备少量Fe(OH)2 , 先打开止水夹a,一段时间后再关闭a D、实验室用图4所示装置证明非金属性强弱:Cl>C>Si -
5、绿水青山是习总书记构建美丽中国的伟大构想,对水质净化是水质检验员的主要工作之一,也是实现绿水青山的重要任务之一.某水质检验员在研究对饮用水消毒时,发现其原理为: , 设为阿伏加德罗常数的值,对于该反应下列说法正确的是( )A、完全反应,生成氢氧化铁胶粒数目小于 B、参加反应,生成氧气 C、反应中被氧化 D、为常见的氧化剂,氧化性强于
-
6、NA是阿伏加德罗常数的值,下列说法不正确的是( )A、由H218O与D216O组成的4.0g混合物含中子数为2NA B、16.8g铁丝在足量O2中燃烧时转移的电子数为0.9NA C、50g质量分数为46%的乙醇水溶液中含有的氧原子总数为2NA D、标准状况下,1.12LH2与等体积的Cl2混合,混合气体中含有的分子总数为0.1NA
-
7、下列离子方程式书写正确的是( )A、向澄清石灰水中通入过量二氧化碳: B、向稀硫酸中投入铁粉: C、钠与水反应: D、鸡蛋壳(主要成分为)与醋酸反应:
-
8、下列离子能大量共存的是( )A、滴加KSCN溶液显红色的溶液中:NH、K+、Cl-、I- B、能与Al反应产生H2的溶液:K+、NH、NO、HCO C、使石蕊变红的溶液中可能大量存在:Na+、NO、SO、Fe2+ D、无色透明的溶液:Na+、Ca2+、ClO-、Cl-
-
9、下列化学用语正确的是( )A、硫原子的结构示意图:
 B、的电子式为
B、的电子式为 C、在水溶液中电离方程式:
D、形成过程
C、在水溶液中电离方程式:
D、形成过程
-
10、下列物质分类的正确组合是( )
选项
酸性氧化物
酸
碱
盐
电解质
A
干冰
硫酸氢钠
氢氧化钾
氯化铁
氨水
B
二氧化硫
氢硫酸
烧碱
碳酸钙
胆矾
C
一氧化碳
硫酸
氢氧化铜
熟石灰
碘酒
D
三氧化硫
硝酸
纯碱
生石灰
碱式碳酸铜
A、A B、B C、C D、D -
11、二十大报告提出要实施“科教兴国”战略,作为基础学科,加快建设科技强国需要化学的全面参与,近几年来,我国在科学技术领域取得成就离不开化学的支撑。对下列成就所涉及的化学知识判断错误的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷的金属性强于钾 B、奋斗号潜水器采用的钛合金具有重量轻、耐高温、强度大等特点 C、冬奥会“飞扬”火炬所采用燃料H2为氧化性气体 D、神舟十四号固体燃料氧气发生器通过化学反应来制造氧气
-
12、氮的相关化合物在化工生产中占有重要地位。(1)、N2O4与NO2之间存在反应N2O4(g)⇌2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
 ①由图推测该反应的∆H0(填“>”或“<”),理由为。
①由图推测该反应的∆H0(填“>”或“<”),理由为。②a点对应的温度下,已知N2O4的起始压强为90kPa,平衡后总压强为kPa,该温度下反应的平衡常数Kp=kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)、化工废水中常常含有以二甲胺((CH3)2NH)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。反应原理是:①Cl-在阳极转化为Cl2;②Cl2在碱性溶液中歧化为ClO-;③ClO-将二甲胺氧化为N2 , CO32-和H2O。

①写出电解池中阴极发生反应的方程式。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是。
③当阴极区收集到6.72L (标况下)H2时,阳极区收集到N2的体积(标况下)是L。
-
13、氯化亚铜(CuCl)是一种重要化工原料,难溶于水,在潮湿空气中易水解氧化。回答下列问题:(1)、向CuSO4与NaCl的混合溶液中通入SO2即可制得CuCl,制备过程中主要发生了以下三步反应,请写出第三步的化学反应方程式:
CuSO4+4NaCl(过量)=Na2[CuCl4]+Na2SO4
2Na2[CuCl4]+SO2+2H2O=2NaH[CuCl3]+H2SO4+2NaCl
。(2)、CuCl在含一定浓度Cl-溶液中会部分溶解,存在如下平衡:2CuCl(s)⇌Cu++CuCl2- ∆H<0,溶液中c(Cu+)和c(CuCl2-)的关系如图所示:
①上述反应在B点的平衡常数K=。
②使图中的A点变为B点的措施可以是。
(3)、利用CuCl难溶于水的性质,可以除去水溶液中的Cl-。①除Cl-的方法是向含Cl-的溶液同时加入Cu和CuSO4 , 该反应的离子方程式为。
②若用Zn替换Cu可加快除Cl-速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是。
(4)、产品纯度的测定:准确称取氯化亚铜产品2.3900g,溶于过量的FeCl3溶液中得250mL待测液,从中量取25.00mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用0.1000mol·L-1硫酸铈Ce(SO4)2标准溶液滴定至终点,共完成三次滴定,每次消耗Ce(SO4)2溶液体积见下表。产品中CuCl的质量分数为%。(已知:CuCl+Fe3+=Cu2++Fe2++Cl- , Fe2++Ce4+=Fe3++Ce3+)1
2
3
消耗硫酸铈标准溶液的体积(mL)
23.85
24.35
23.95
若未用标准溶液润洗滴定管,则会使测定结果(填“偏大”、“偏小”或“不变”)。
-
14、二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。(1)、一种脱除和利用水煤气中CO2方法的示意图如下:

①在某温度下,吸收塔中的K2CO3溶液吸收一定量的CO2后,溶液的pH等于10,则此时溶液中c(CO32-):c(HCO3-)=(该温度下H2CO3的Ka1=4.6×10-7 , Ka2=5.0×10-11)。②再生塔中产生CO2的化学方程式为
(2)、科学家提出由CO2制取C的太阳能工艺如图所示。
已知“重整系统”发生的反应中 , 则“重整系统”发生反应的化学方程式为。
(3)、用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量如图所示: ①该反应在自发进行(填“低温”或“高温”)。
①该反应在自发进行(填“低温”或“高温”)。②b代表的物质是。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举2项)。
④温度下CO2的平衡转化率为。
-
15、 化学反应中常伴随着能量的变化。回答下列问题:(1)、S8分子可形成单斜硫和斜方硫,转化过程为:S(s,单斜)S(s,斜方)∆H= -0.398kJ·mol-1 , 则S(单斜)与S(斜方)相比,较稳定的是 , 基态S原子的原子核外电子有种空间运动状态,其能量最高的电子电子云轮廓图为形。(2)、Cu的价层电子排布式为 , 位于在周期表区(填s、p、d或ds)。(3)、下列属于氧原子激发态的轨道表示式的有(填字母)。
a.
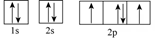 b.
b.
c.
 d.
d.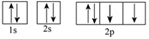 (4)、已知稀溶液中:H+(aq)+OH-(aq)=H2O(l) ∆H= -57.3 kJ·mol-1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量(填“>”“<”或“=”)57.3kJ。(5)、1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化如图所示:
(4)、已知稀溶液中:H+(aq)+OH-(aq)=H2O(l) ∆H= -57.3 kJ·mol-1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量(填“>”“<”或“=”)57.3kJ。(5)、1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化如图所示:
①若在反应体系中加入催化剂,反应速率增大,E1(填“增大”“减小”或“不变”)。
②写出NO2和CO反应的热化学方程式。
(6)、标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:①
②
③
写出乙烷(C2H6)标准摩尔生成焓的焓变∆H=(用含∆H1、∆H2、∆H3的式子表示)。
-
16、常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中不正确的是( )
 A、曲线MP表示c(SO42-)的变化 B、BaSO4固体恰好完全溶解时,溶液中离子浓度关系为c(CO32-)>c(SO42-)>c(Ba2+)>c(OH-) C、BaSO4的Ksp为1×10-10 D、若要使反应BaSO4+CO32- ⇌BaCO3+SO42-正向进行,需满足
A、曲线MP表示c(SO42-)的变化 B、BaSO4固体恰好完全溶解时,溶液中离子浓度关系为c(CO32-)>c(SO42-)>c(Ba2+)>c(OH-) C、BaSO4的Ksp为1×10-10 D、若要使反应BaSO4+CO32- ⇌BaCO3+SO42-正向进行,需满足 -
17、某水样中含一定浓度的CO32-、HCO3-和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( )
 A、该水样中c(CO32-)=0.01mol•L-1 B、a点处c(H2CO3)+c(H+)=c(OH-) C、曲线上任意一点存在c(CO32-)+c(HCO3-)+c(H2CO3)=0.03mol•L-1 D、当V(HCl)≤20.00mL时,溶液中c(HCO3-)基本保持不变
A、该水样中c(CO32-)=0.01mol•L-1 B、a点处c(H2CO3)+c(H+)=c(OH-) C、曲线上任意一点存在c(CO32-)+c(HCO3-)+c(H2CO3)=0.03mol•L-1 D、当V(HCl)≤20.00mL时,溶液中c(HCO3-)基本保持不变 -
18、我国某大学科研团队提出用多孔泡沫铁、高度膨化的纳米泡沫碳(CFs)和添加了NH4Cl的FeSO4溶液构建独特的“摇椅式”全铁离子电池,电池结构如图(阴离子未标出)。下列说法错误的是( )
 A、NH4Cl可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为112g
A、NH4Cl可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为112g -
19、下列有关平衡移动的说法错误的是( )A、将2mL0.5mol·L-1 CuCl2溶液加热,溶液由蓝绿色变黄绿色,说明CuCl2溶液中[Cu(H2O)4]2+(蓝色)+4Cl- ⇌[CuCl4]2-(黄色)+4H2O是吸热过程 B、向2 mL0.1mol·L-1K2Cr2O7溶液加几滴6 mol/L硫酸,溶液橙色加深,说明增大c(H+)使平衡Cr2O72-+H2O⇌2CrO42-+2H+逆向移动 C、恒温恒容密闭容器,通入2mol SO2和1mol O2 , 反应达到平衡后,再向其中通入1mol氦气,平衡不移动。 D、加水稀释0.1mol·L-1的醋酸溶液,CH3COOH电离程度变大,从c(H+)变大
-
20、下列有关实验的操作、现象和结论都正确的是( )
选项
实验操作
现象
结论
A
测定等物质的量浓度的Na2CO3和NaClO的pH
Na2CO3>NaClO
酸性:H2CO3<HClO
B
向浓度均为0.10mol/L的KCl和KI混合溶液中滴加少量AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
向FeCl3+3KSCN⇌Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体
溶液血红色变浅
增大生成物浓度,平衡逆向移动
D
用pH试纸测量同浓度的CH3COOH、HClO的pH,比较溶液pH大小
HClO的pH比CH3COOH大
说明CH3COOH酸性比HClO强
A、A B、B C、C D、D