-
1、下列物质的性质与用途具有对应关系的是( )A、呈现黄绿色,可用于水体的杀菌消毒 B、苯具有可燃性,可用于萃取水中的 C、具有还原性,可用作葡萄酒的抗氧化剂 D、浓硫酸具有强氧化性,可用于干燥
-
2、实验室制取时,下列装置不能达到相应实验目的的是( )A、制备
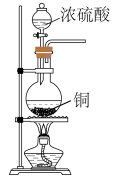 B、检验
B、检验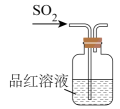 C、干燥
C、干燥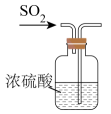 D、收集
D、收集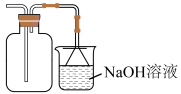
-
3、氯碱工业的原理为: , 下列说法正确的是( )A、的结构示意图:
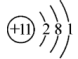 B、的空间填充模型:
B、的空间填充模型: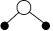 C、中既有离子键也有共价键
D、的电子式:
C、中既有离子键也有共价键
D、的电子式: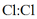
-
4、下列物质属于电解质的是( )A、氯化钠 B、蔗糖 C、 D、
-
5、我国提出了将在2030年前实现“碳达峰”,2060年前实现“碳中和”的目标,彰显大国的责任与担当。“碳达峰”“碳中和”中的“碳”指的是( )A、二氧化碳 B、碳元素 C、碳单质 D、含碳物质
-
6、高锰酸钾受热容易分解,在不同温度下,发生如下反应:
请回答:
(1)、取 12.64gKMnO4固体, 加热至 700℃, 一段时间后剩余固体的质量为 11.04g, 剩余固体中的 MnO2质量为g。(2)、取(1) 剩余固体与足量的浓盐酸在加热条件下充分反应生成Cl2 , 产物中锰元素以Mn2+存在, 则 Cl2的物质的量为mol。 -
7、硫的化合物有重要用途。硫代硫酸钠(Na2S2O3)可用于氰化物中毒的解毒、治疗荨麻疹等皮肤病,它在中性、碱性环境中稳定,在酸性较强的溶液中产生S和SO2 , 实验室可以利用下列装置制备Na2S2O3和焦亚硫酸钠( Na2S2O5)
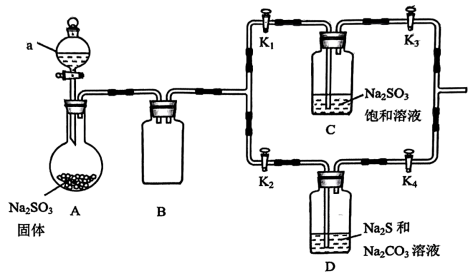 (1)、仪器a 的名称为 , a中试剂最好选择(填选项)。
(1)、仪器a 的名称为 , a中试剂最好选择(填选项)。A.浓盐酸 B.70%硫酸 C.稀硫酸
(2)、该装置中存在一处明显的缺陷是。(3)、关闭 K1、K3打开K2、K4 , 一段时间后, D中有Na2S2O3和CO2生成。写出该反应化学方程式。通入 D 中的 SO2不宜过量的原因是。 -
8、海水中的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了 70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、 碘、砹总称为卤素。(1)、氯在元素周期表中的位置是。(2)、下列关于卤族元素性质的比较,不正确的是____。A、酸性:HIO4>HBrO4>HClO4 B、原子半径: I>Br>Cl C、还原性:I->Br->Cl- D、非金属性: Cl>Br>I(3)、将氯气分别通入含下列离子的溶液中,离子浓度减小的是____。A、 B、 C、Mg2+ D、Fe3+(4)、氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是____。
 A、图1 表示氯水pH 随时间的变化 B、图2表示溶液中氯离子浓度随时间的变化 C、图 3 表示氯水的电导率随时间的变化 D、图4 表示液面上方氧气体积分数随时间的变化
A、图1 表示氯水pH 随时间的变化 B、图2表示溶液中氯离子浓度随时间的变化 C、图 3 表示氯水的电导率随时间的变化 D、图4 表示液面上方氧气体积分数随时间的变化 -
9、某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
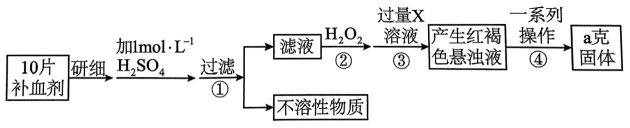
请回答下列问题:
(1)、用18.4mol·L-¹的浓硫酸、500mL容量瓶配制 480mL1.0 mol·L-¹的硫酸溶液,所需浓硫酸的体积为mL(计算结果精确到小数点后一位)。(2)、在下列配制过程示意图中,有错误的是(填写序号) 。 (3)、下列说法不正确的____。A、洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量瓶以减少误差 B、某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 C、定容时仰视观察,所配溶液浓度会偏低 D、容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可(4)、若最后称得红棕色固体的质量为ag,则每片补血剂中含硫酸亚铁的物质的量为mol。
(3)、下列说法不正确的____。A、洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量瓶以减少误差 B、某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 C、定容时仰视观察,所配溶液浓度会偏低 D、容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可(4)、若最后称得红棕色固体的质量为ag,则每片补血剂中含硫酸亚铁的物质的量为mol。 -
10、物质类别和元素价态是学习元素及其化合物性质的重要认识视角。如图是某元素M 的价类二维图。其中X是一种强碱,A为正盐,B能使湿润的红色石蕊试纸变蓝,通常条件下 Z是无色液体,D的相对分子质量比E小 16, 图中呈现了各物质的转化关系。
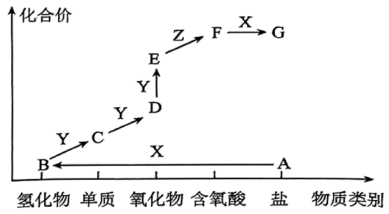 (1)、下列说法正确的是____。A、物质 A 中只含离子键 B、物质 B 可以和Y 反应直接转化为 E C、物质D、E均可以用向上排空气法收集 D、通过水可以除去 D 中含有的少量E(2)、请写出B在加热和有催化剂条件下与Y反应生成D的化学方程式。(3)、设计检验正盐 A 中阳离子的实验方案。
(1)、下列说法正确的是____。A、物质 A 中只含离子键 B、物质 B 可以和Y 反应直接转化为 E C、物质D、E均可以用向上排空气法收集 D、通过水可以除去 D 中含有的少量E(2)、请写出B在加热和有催化剂条件下与Y反应生成D的化学方程式。(3)、设计检验正盐 A 中阳离子的实验方案。 -
11、化学物质丰富多彩,在生产、生活、科研等方面都起着重要的作用。(1)、磁铁矿主要成分的化学式是; CO2的电子式。(2)、家庭厨卫管道常因留有菜渣、毛发而造成堵塞,可用管道疏通剂疏通。常用的管道疏通剂主要成分有铝粉和氢氧化钠,请用离子方程式表达其疏通原理。(3)、工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅。请写出化学方程式。
-
12、实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,硝酸可被还原为。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出,在反应结束后的溶液中逐滴加入5mol·L-¹NaOH溶液,所加 NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法正确的是( )
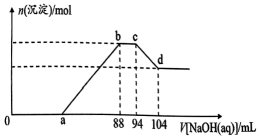 A、b点到c 点的反应为:H++OH-=H2O B、样品中铝粉和铁粉的质量之比为5:3 C、a 点对应NaOH 溶液的体积为40mL D、原硝酸溶液中硝酸的物质的量为 0.47mol
A、b点到c 点的反应为:H++OH-=H2O B、样品中铝粉和铁粉的质量之比为5:3 C、a 点对应NaOH 溶液的体积为40mL D、原硝酸溶液中硝酸的物质的量为 0.47mol -
13、在 120℃下, 将 Vml的CO2和 H2O(g), 通入足量的过氧化钠, 充分反应后发现电子转移为1mol,则下列说法正确的是( )A、整个过程中消耗过氧化钠为 156g B、充分反应后气体在 120℃的体积为0.4Vml C、组成过氧化钠的阴阳离子个数比为 1∶1 D、Vml的CO2和H2O(g) 质量可能为31g
-
14、某废催化剂含SiO2、 ZnS 和 CuS。某实验小组以该废催化剂为原料, 回收锌和铜,设计实验流程如图:
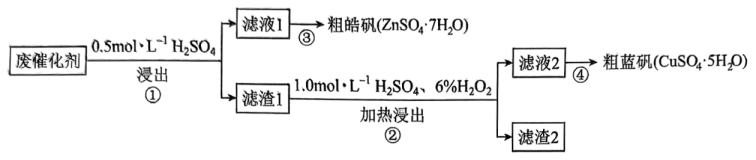
下列说法不正确的是( )
A、步骤①中产生的气体可用 NaOH 溶液进行吸收 B、步骤②中的加热操作需维持在较高温度下进行,以加快反应速率 C、滤渣 1 成分是 SiO2和 CuS, 滤渣 2成分可能为SiO2和 S D、步骤④的操作:将滤液2蒸发浓缩、冷却结晶、过滤、洗涤和干燥 -
15、若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析不正确的是( )
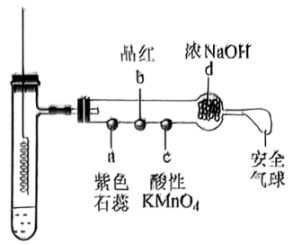 A、Cu与浓硫酸反应,H2SO4体现酸性和强氧化性 B、a处变红,说明SO2是酸性氧化物 C、b和c处均褪色,分别体现SO2的漂白性和还原性 D、试管底部出现白色固体,说明反应中无H2O生成
A、Cu与浓硫酸反应,H2SO4体现酸性和强氧化性 B、a处变红,说明SO2是酸性氧化物 C、b和c处均褪色,分别体现SO2的漂白性和还原性 D、试管底部出现白色固体,说明反应中无H2O生成 -
16、下列实验操作、现象、解释或结论都正确的是( )
选项
实验操作
实验现象
结论
A
用铂丝蘸取KCl溶液, 在酒精灯上灼烧
火焰呈黄色
K元素的焰色呈黄色
B
向 KBrO3溶液中加入少量CCl4 , 然后通入少量Cl2 , 充分振荡,静置
下层呈橙色
氧化性: Cl2>Br2
C
向装有 Fe(NO3) 2溶液的试管中加入稀硫酸
在管口观察到红棕色气体
酸性条件下 Fe2+还原生成NO,NO遇到空气产生红棕色 NO2
D
向某溶液中先滴加适量稀硝酸, 再滴加少量 BaCl2溶液
出现白色沉淀
原溶液中只含有 、、中的一种或几种
A、A B、B C、C D、D -
17、下列化合物不能用相应元素的单质直接化合而成的是( )
①CuS ②FeS ③Na2O2 ④Fe2S3 ⑤Cu2S ⑥FeCl2
A、②⑤⑥ B、①④⑥ C、③④⑤ D、③④⑥ -
18、短周期元素 W、X、Y、Z的原子序数依次增大,且W、X、Y+、Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是( )A、Y 元素在周期表中的位置为第三周期第ⅠA族 B、W、X、Z三种元素均能形成的多种同素异形体 C、W、X和Y 三种元素形成的化合物的水溶液呈中性 D、X 和其他三种元素均可形成至少2种二元化合物
-
19、常温下,下列各组微粒能大量共存的是( )A、 B、 C、 D、
-
20、设NA为阿伏加德罗常数的值,下列叙述中正确的是( )A、4gD2分子中共含有4NA个中子 B、常温常压下,18mL 水中所含的水分子数目约为 NA C、0.1molN2和0.3molH2充分反应后生成 NH3的分子数为0.2NA D、7.8gNa2O2与任何物质反应均转移0.1NA个电子