-
1、氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;能被溶液吸收生成配合物 , 减少环境污染。下列化学反应表示正确的是( )A、向硫酸铜中通入少量氨气: B、向稀硝酸中加入过量铁粉: C、氨气的燃烧热: D、硫酸铵溶液和氢氧化钡溶液反应:
-
2、氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;能被溶液吸收生成配合物 , 减少环境污染。能被溶液吸收生成 , 减少环境污染,下列说法正确的是( )A、提供孤电子对用于形成配位键 B、该配合物中阴离子空间构型为三角锥形 C、配离子为 , 中心离子的配位数为6 D、该配合物中所含非金属元素均位于元素周期表的p区
-
3、氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;能被溶液吸收生成配合物 , 减少环境污染。对于反应 , 下列有关说法不正确的是( )A、上述反应的平衡常数表达式 B、适当提高的浓度,可以加快反应速率,提高的转化率 C、断裂同时有断裂,说明达该条件下的平衡状态 D、其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
-
4、X、Y、Z、W都属于前4周期主族元素,基态X原子核外有7种运动状态不同的电子,基态Y原子的最外层电子数是其电子层数的3倍,Z是短周期金属性最强的元素,基态W原子的4p原子轨道上有5个电子。下列说法正确的是( )A、第一电离能:I1(Z)<I1(X)<I1(Y) B、原子半径由小到大的顺序:r(X)<r(Y)<r(Z) C、W元素在周期表中位于第四周期ⅦA族 D、X、Y的简单气态氢化物分子的键角:X<Y
-
5、实验室用如下图所示装置探究与溶液的反应(实验前先通入排除装置中的空气)。下列说法不正确的是( )
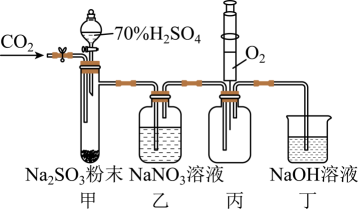 A、用装置甲产生 B、装置乙中无明显现象,则与未发生反应 C、装置丙中注入 , 产生红棕色气体,说明装置乙中发生了氧化反应 D、装置丁吸收尾气并防止空气进入装置丙
A、用装置甲产生 B、装置乙中无明显现象,则与未发生反应 C、装置丙中注入 , 产生红棕色气体,说明装置乙中发生了氧化反应 D、装置丁吸收尾气并防止空气进入装置丙 -
6、反应SiO2+4HF=SiF4↑+2H2O应用于玻璃雕刻。下列说法正确的是( )A、SiO2属于共价化合物 B、HF的电子式为
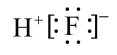 C、SiF4是由极性键形成的极性分子
D、H2O中氧原子基态价电子轨道表达式为
C、SiF4是由极性键形成的极性分子
D、H2O中氧原子基态价电子轨道表达式为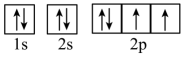
-
7、化学与生产、生活和社会息息相关,下列有关说法错误的是( )A、用于火箭发动机的碳化硅陶瓷是一种新型无机非金属材料 B、载人飞船采用了太阳能刚性电池阵,将太阳能转化为电能供飞船使用 C、合成氨的金属反应塔与外加电源的正极相连,并维持一定的电压可以防腐 D、运动员剧烈运动后,补充的运动饮料中含有糖类和一定浓度的NaCl、KCl等
-
8、自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的等会污染环境,需要加以治理。(1)、火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。
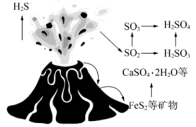
的结构式为。与和溶液反应转化为和 , 理论上转移电子的物质的量为。
(2)、工业上利用的转化制备硫酸,其模拟实验的部分装置如图所示。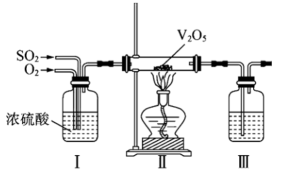
①装置I的作用是(写出两点)。
②装置III用于吸收制备硫酸,适宜的吸收剂是(填字母)。
A.溶液 B.水 C.浓硫酸
③装置II中待反应进行后撤走酒精灯,无需持续加热,原因是。若用、水在催化剂存在时吸收尾气中的 , 吸收完成后,随着氧化的进行,溶液的将(填“增大”“减小”或“不变”)。
(3)、可用作脱除气体的脱硫剂。脱硫和再生的反应机理如图所示。
写出“脱硫”时发生反应的化学方程式。
(4)、的“再生”是在时,用一定浓度的与反应实现(如上图所示)。温度略低于时,“再生”所得固体质量增加,原因是。 -
9、碱式次氯酸镁是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有等]制备碱式次氯酸镁的流程如下。
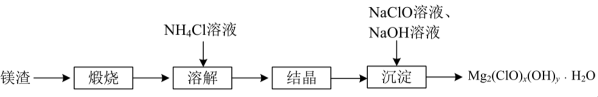 (1)、“煅烧”在700℃高温下进行,煅烧得到的同时,生成气体的化学式为。(2)、“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为。(3)、“沉淀”步骤制备时需控制约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为。用下图所示装置制备。将晶体与溶液、溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是溶液(填化学式)。
(1)、“煅烧”在700℃高温下进行,煅烧得到的同时,生成气体的化学式为。(2)、“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为。(3)、“沉淀”步骤制备时需控制约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为。用下图所示装置制备。将晶体与溶液、溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是溶液(填化学式)。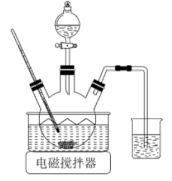 (4)、向的溶液中加入适量溶液、溶液,过滤,洗涤,干燥得到固体。为测定其组成,将所得固体溶于酸,再加入过量的溶液,充分反应生成和。测得生成的为。计算的化学式(写出计算过程)。
(4)、向的溶液中加入适量溶液、溶液,过滤,洗涤,干燥得到固体。为测定其组成,将所得固体溶于酸,再加入过量的溶液,充分反应生成和。测得生成的为。计算的化学式(写出计算过程)。 -
10、海水中有丰富的化学资源,可利用海水制盐和提溴。(1)、I海水晒盐获得的粗盐中含有其他盐和难溶性杂质,某兴趣小组在实验室中进行粗盐精制的模拟实验。实验过程如下:称取一定质量的粗盐,加水充分溶解,过滤;向滤液中依次加入稍过量的甲溶液、溶液、乙溶液,过滤;向滤液中加入足量盐酸,蒸发结晶,制得精盐。
加水溶解粗盐时,需控制所加入的水的质量。加入水的适宜用量是。(2)、乙溶液为溶液(填化学式)。实验中不取样出来进行分析,判断溶液加入量己“稍过量”的实验方法及现象是。(3)、某同学认为,若粗盐中含的质量为 , 正确进行上述实验操作制得精盐的质量将大于。判断其观点是否合理,并说明理由。(4)、II.从浓海水中提取溴的工艺如下图所示: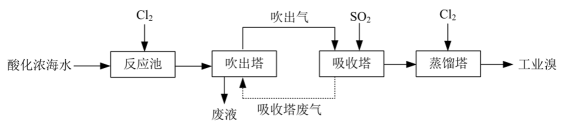
吸收塔中与反应的离子方程式为。
(5)、在反应池中,海水中的己转化为。设计后续步骤将先转化为又转化为 , 目的是。(6)、通入吸收塔的流量与产率关系如题图所示。当流量高于后,产率下降,原因是。
-
11、下表是元素周期表的一部分,请按要求回答问题:
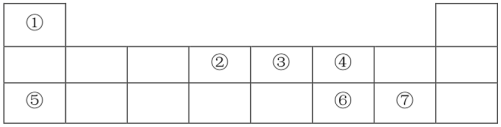 (1)、元素②在周期表中的位置为。元素④的一种原子内有10个中子,该原子是(用核素符号表示)。(2)、元素⑥、⑦的最高价氧化物的水化物中,酸性较强的是(填化学式)。(3)、元素⑤的单质着火不能用水来灭火,其原因是。(4)、肼(N2H4)由元素①、③组成,可与NO2气体反应生成N2和H2O,同时放出大量的热,故常用作火箭燃料。写出该反应的化学方程式,并用双线桥法标出该反应中电子转移的方向和数目:。
(1)、元素②在周期表中的位置为。元素④的一种原子内有10个中子,该原子是(用核素符号表示)。(2)、元素⑥、⑦的最高价氧化物的水化物中,酸性较强的是(填化学式)。(3)、元素⑤的单质着火不能用水来灭火,其原因是。(4)、肼(N2H4)由元素①、③组成,可与NO2气体反应生成N2和H2O,同时放出大量的热,故常用作火箭燃料。写出该反应的化学方程式,并用双线桥法标出该反应中电子转移的方向和数目:。 -
12、亚氯酸钠是一种高效漂白剂和氧化剂。溶液的实验室制备过程为:
反应①:在酸性条件下,还原制备;
反应②:在碱性条件下,与反应,得溶液。
下列说法正确的是( )
A、反应①中用提供酸性环境 B、反应①中参加反应的和的物质的量之比为 C、反应②中的可用代替 D、制备至少需要标准状况下气体 -
13、硫代硫酸钠中硫元素有0和两种价态,可将水中的余氯转化为 , 减小水中的氯对鱼的危害。易溶于水,不溶于乙醇,在酸性条件下易转化为硫单质和。一种制备的方法为向与混合溶液中通入气体。下列离子方程式书写正确的是( )A、少量与过量溶液反应: B、溶液与稀反应: C、溶液与足量氯水反应: D、溶液在空气中久置变浑:
-
14、硫代硫酸钠中硫元素有0和两种价态,可将水中的余氯转化为 , 减小水中的氯对鱼的危害。易溶于水,不溶于乙醇,在酸性条件下易转化为硫单质和。一种制备的方法为向与混合溶液中通入气体。关于及上述制备反应,下列说法正确的是( )A、具有还原性 B、中两种硫原子性质相同 C、将溶于水时加入乙醇可帮助其溶解 D、该方法制备时须通入过量的至溶液呈酸性
-
15、下列实验操作能达到实验目的的是( )
选项
实验目的
实验操作
A
检验溶液中的
向溶液中先加盐酸,再加溶液
B
干燥
将气体通过盛有浓的洗气瓶
C
吸收尾气中的
将气体通入盛有饱和食盐水的烧杯
D
测定氯水的
将氯水滴在试纸上,与标准比色卡对照
A、A B、B C、C D、D -
16、下列物质转化符合工业生产实际的是( )A、漂白粉 B、饱和食盐水固体 C、溶液 D、
-
17、淀粉试纸检验的原理为。下列说法正确的是( )A、中碘元素的化合价为+5 B、是氧化剂 C、发生氧化反应 D、每生成 , 转移电子
-
18、元素位于元素周期表的第三周期,下列说法正确的是( )A、原子半径: B、元素最高化合价: C、碱性: D、热稳定性:
-
19、配制溶液时,下列操作不符合规范的是( )A、溶解固体后冷却至室温 B、使用未经干燥的容量瓶 C、用蒸馏水洗涤烧杯内壁及玻璃棒 D、摇匀后发现液面下降再加水至刻度线
-
20、胶体的实验室制备方法如下: , 下列说法不正确的是( )A、该反应是复分解反应 B、反应后溶液呈酸性 C、胶体能净水是因为其具有吸附性 D、向溶液中滴入几滴饱和溶液,也可得到胶体