-
1、2022年10月18日《自然化学》发表我国科学家研究成果,发现AgCrS2(AMX2家族成员之一,A
 一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题: (1)、基态硫原子核外电子排布式为。(2)、氧族元素有氧、硫、硒、碲等元素,其中电负性最大的元素是 , 科学家用亚硒酸盐和硫酸盐跟踪固氨酶,研究反应机理。中硫的杂化轨道类型是 , 的空间结构模型为。(3)、配合物中铬的化合价为 , 配离子为 , 中心离子配位数为。(4)、ZnSe晶胞与ZnS晶胞相似(如图),ZnSe晶胞中部分原子的分数坐标为:A点(0,0,0),B点的坐标为 , 从该晶胞中找出距离B点Se2-最远的的位置(用分数坐标表示),该晶胞中晶胞中的个数为个,若晶胞中的边长为acm,阿伏加德罗常数的值为 , 请计算ZnSe晶胞的密度
一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题: (1)、基态硫原子核外电子排布式为。(2)、氧族元素有氧、硫、硒、碲等元素,其中电负性最大的元素是 , 科学家用亚硒酸盐和硫酸盐跟踪固氨酶,研究反应机理。中硫的杂化轨道类型是 , 的空间结构模型为。(3)、配合物中铬的化合价为 , 配离子为 , 中心离子配位数为。(4)、ZnSe晶胞与ZnS晶胞相似(如图),ZnSe晶胞中部分原子的分数坐标为:A点(0,0,0),B点的坐标为 , 从该晶胞中找出距离B点Se2-最远的的位置(用分数坐标表示),该晶胞中晶胞中的个数为个,若晶胞中的边长为acm,阿伏加德罗常数的值为 , 请计算ZnSe晶胞的密度
-
2、如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
 (1)、⑨号元素在周期表的位置是 , 其最高能层的电子占据的原子轨道电子云轮廓为形。(2)、第二周期所有元素中第一电离能介于①②之间的有种。由②③④形成的简单离子半径由小到大顺序是(填化学用语)。(3)、元素②⑧可形成原子个数比为1∶3的共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子的空间结构为 , 中心原子轨道杂化形式为 , 该分子为(填“极性分子”或“非极性分子”)。(4)、元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式 , 它的熔点高、硬度大、电绝缘性好、化学性质稳定,它的晶体类型是。(5)、下列有关性质的比较正确的是____(填标号)A、电负性:②>③ B、氢化物的稳定性:③>⑦ C、原子半径:⑤>④ D、氢化物的沸点:③>⑦(6)、⑩可形成的卤化物的熔点如下表:
(1)、⑨号元素在周期表的位置是 , 其最高能层的电子占据的原子轨道电子云轮廓为形。(2)、第二周期所有元素中第一电离能介于①②之间的有种。由②③④形成的简单离子半径由小到大顺序是(填化学用语)。(3)、元素②⑧可形成原子个数比为1∶3的共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子的空间结构为 , 中心原子轨道杂化形式为 , 该分子为(填“极性分子”或“非极性分子”)。(4)、元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式 , 它的熔点高、硬度大、电绝缘性好、化学性质稳定,它的晶体类型是。(5)、下列有关性质的比较正确的是____(填标号)A、电负性:②>③ B、氢化物的稳定性:③>⑦ C、原子半径:⑤>④ D、氢化物的沸点:③>⑦(6)、⑩可形成的卤化物的熔点如下表:卤化物
氟化物
氯化物
溴化物
熔点/℃
>1000
77.75
122.3
⑩的氟化物的熔点比氯化物熔点高很多的原因是。
-
3、乙烯和苯能够共同发生的反应类型有( )
①加成反应 ②消去反应 ③聚合反应 ④氧化反应
A、①④ B、②③ C、③④ D、①② -
4、工业上合成乙苯的反应如下。下列说法正确的是( )
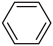 +CH2=CH2
+CH2=CH2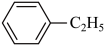 A、该合成反应属于取代反应 B、乙苯分子内的所有C、H原子可能共平面 C、乙苯的一溴代物有5种 D、苯、乙烯和乙苯均可使酸性高锰酸钾溶液褪色
A、该合成反应属于取代反应 B、乙苯分子内的所有C、H原子可能共平面 C、乙苯的一溴代物有5种 D、苯、乙烯和乙苯均可使酸性高锰酸钾溶液褪色 -
5、下列有关烷烃的叙述中,正确的是( )A、在烷烃分子中,可能会有碳碳双键 B、烷烃中除甲烷外,很多都能使紫色KMnO4溶液褪色 C、分子通式为的烃不一定是烷烃 D、烷烃跟卤素单质在光照条件下能发生取代反应
-
6、以下用于研究有机物的方法错误的是( )A、蒸馏法常用于分离提纯液态有机混合物 B、燃烧法是研究确定有机物成分的有效方法之一 C、核磁共振氢谱通常用于分析有机物的相对分子质量 D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
-
7、下列实验有关叙述正确的是( )
 A、用装置①来分离苯和溴苯的混合物 B、用装置②蒸馏工业乙醇可得到无水乙醇 C、重结晶提纯苯甲酸过程中要用到装置③进行分离操作 D、用装置④进行萃取操作,实验者用左手托住分液漏斗活塞,右手抵住玻璃塞,将分液漏斗按图所示双手用力振荡,使液体混合
A、用装置①来分离苯和溴苯的混合物 B、用装置②蒸馏工业乙醇可得到无水乙醇 C、重结晶提纯苯甲酸过程中要用到装置③进行分离操作 D、用装置④进行萃取操作,实验者用左手托住分液漏斗活塞,右手抵住玻璃塞,将分液漏斗按图所示双手用力振荡,使液体混合 -
8、下列说法正确的是( )A、结构示意图:
 B、
B、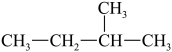 的名称为3-甲基丁烷
C、乙烯和1,3-丁二烯互为同系物
D、
的名称为3-甲基丁烷
C、乙烯和1,3-丁二烯互为同系物
D、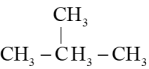 和
和 互为同系物
互为同系物
-
9、下列各组物质不属于同分异构体的是( )A、CH3CH2OH和CH3CHO B、
 和
和 C、
C、 和
和 D、正戊烷与异戊烷
D、正戊烷与异戊烷
-
10、下列物质的类别与所含官能团都正确的是( )A、
 酚类 -OH
B、
酚类 -OH
B、 羧酸 -CHO
C、
羧酸 -CHO
C、 醛类 -CHO
D、CH3-O-CH3醚类
醛类 -CHO
D、CH3-O-CH3醚类 
-
11、向由0.1molCoCl3·6H2O配成的溶液中加入足量AgNO3溶液,产生0.2mol沉淀。配合物CoCl3·6H2O的配位数为6,下列说法错误的是( )A、该配合物的中心离子是 B、该配合物的配体是H2O和 C、每1mol配离子中含有6NA个共价键 D、该配合物中存在的化学键有:共价键、配位键、离子键
-
12、下列各组物质的熔点均与所含化学键能有关的是( )A、CaO与CO2 B、NaCl与HCl C、SiC与Si D、Cl2与I2
-
13、纳米为无定形非晶态,白色粉末,颗粒尺寸小、微孔多、比表面积大、对紫外线反射能力强等特点。下列关于纳米的说法正确的是( )A、对光有各向异性 B、熔点与晶体相同 C、纳米具有自范性 D、可用X−射线衍射实验区分纳米与晶体
-
14、下列关于范德华力与氢键的叙述中正确的是( )A、范德华力比氢键的作用还要弱 B、范德华力与氢键共同决定物质的物理性质 C、范德华力与氢键的强弱都只与相对分子质量有关 D、任何物质中都存在范德华力,而氢键只存在于含有、、的物质中
-
15、下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )A、CO2和SO2 B、CH4和H2O C、BF3和NH3 D、HCl和HI
-
16、用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )A、NH 为正四面体形 B、CS2为直线形 C、CH2O为V形 D、PCl3为三角锥形
-
17、氨气分子的空间结构是三角锥形,而甲烷分子的空间结构是正四面体形,这是因为( )A、两种分子的中心原子的杂化轨道类型不同,中原子为杂化,而中原子是杂化 B、分子中氮原子形成3个杂化轨道,分子中碳原子形成4个杂化轨道 C、分子中中心原子上有一对未成键
 孤电子对,它对成键电子对的排斥作用较强
D、氨气是四原子化合物,甲烷为五原子化合物
孤电子对,它对成键电子对的排斥作用较强
D、氨气是四原子化合物,甲烷为五原子化合物
-
18、关于键长、键能和键角,下列说法不正确的是( )A、键长越长,键能越大,共价化合物越稳定 B、通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 C、键长: D、分子中的键角:
-
19、下列各组元素中,第一电离能大小次序不正确的是( )A、 B、 C、 D、
-
20、具有下列电子排布的原子中,半径最大的为( )A、1s22s22p63s1 B、1s22s22p63s23p64s1 C、1s22s22p63s2 D、1s22s22p63s23p64s2