-
1、在研究化学反应中的能量变化时我们通常做如图所示的实验:

在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片(或三合板)上,然后再加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌。
试回答下列问题:
(1)、实验中要立即用玻璃棒迅速搅拌的原因是什么?(2)、如果实验中没有看到“结冰”现象,可能的原因是什么?(回答出三个以上的原因)(3)、如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?(回答出两种方案)(4)、①实验中即使不“结冰”,将烧杯提起的时候,发现烧杯与玻璃片也“黏在一起了”,原因是什么?②试用简单的方法说明烧杯与玻璃片之间是因“结冰”而黏在一起的。
-
2、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH =-206.2kJ·mol-1
CH4(g)+ CO2(g) = 2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2H2S(g) = 2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1
(1)、以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。(2)、H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: 。(3)、H2O的热分解也可得到H2 , 高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是。
-
3、在2L密闭容器内,800℃时反应体系中,n(NO)随时间的变化如下表:
时间/s
0
1
2
3
4
5
0.020
0.010
0.008
0.007
0.007
0.007
(1)、如图中表示的变化的曲线是。用表示从0~2s内该反应的平均速率v=。 (2)、能说明该反应已达到平衡状态的是。
(2)、能说明该反应已达到平衡状态的是。a. b.容器内压强保持不变
c.容器内密度保持不变 d.
-
4、在2 L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质
时间
X
Y
Z
Q
起始/mol
0.7
1
2 min末/mol
0.8
2.7
0.8
27
3 min末/mol
0.8
已知2 min内v(Q)=0075 mol·L-1·min-1 , =0.5
(1)、试确定以下物质的相关量:起始时n(Y)= , n(Q)=;(2)、方程式中m= , n= , p= , q=;(3)、用Z表示2 min内的反应速率。 -
5、某温度下,(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 , 金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
 A、 B、加适量固体可使溶液由点变到点 C、两点代表的溶液中与乘积相等 D、、分别在、两点代表的溶液中达到饱和
A、 B、加适量固体可使溶液由点变到点 C、两点代表的溶液中与乘积相等 D、、分别在、两点代表的溶液中达到饱和 -
6、溶度积常数表达式符合Ksp=[c(Ax+)]2·c(By-)的是( )A、AgCl(s)Ag+(aq)+Cl-(aq) B、Na2S = 2Na++S2- C、Ag2S(s)2Ag+(aq)+S2-(aq) D、PbI2(s)Pb2+(aq)+2I-(aq)
-
7、在一定温度下,将等物质的量的CO和水蒸气通入恒容密闭容器中,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )A、正反应速率等于零 B、正反应速率大于逆反应速率 C、正反应速率等于逆反应速率 D、正反应速率小于逆反应速率
-
8、化学反应达到化学平衡的标志是( )A、逆反应停止进行 B、反应物与生成物的浓度相等 C、正反应与逆反应停止进行 D、正反应速率和逆反应速率相等
-
9、反应4A(s)+3B(g)=2C(g)+D(g),经2minB的浓度减小0.6mol/L。对此反应速率的正确表示是( )A、用A表示的反应速率是0.8mol/(L•s) B、分别用B、C、D表示反应的速率,其比值是3:2:1 C、在2min末时的反应速率,用反应物B来表示是0.3mol/(L•min) D、在这2min内用B和C表示的反应速率的值都是相同的
-
10、已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )A、C8H18(l) + O2(g)=8CO2(g) + 9H2O(l) ΔH=-48.40 kJ·mol-1 B、C8H18(l) + O2(g)=8CO2(g) + 9H2O(l) ΔH=-5 518 kJ·mol-1 C、C8H18(l) + O2(g)=8CO2(g) + 9H2O(l) ΔH=+5 518 kJ·mol-1 D、C8H18(l) + O2(g)=8CO2(g) + 9H2O(l) ΔH=+48.40 kJ·mol-1
-
11、化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
 A、1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ B、通常情况下,N2(g)和O2(g)混合能直接生成NO C、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 D、NO2是一种酸性氧化物,能与NaOH溶液反应生成盐和水
A、1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ B、通常情况下,N2(g)和O2(g)混合能直接生成NO C、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 D、NO2是一种酸性氧化物,能与NaOH溶液反应生成盐和水 -
12、氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是( )A、Q1+Q2<2Q3 B、Q1+Q2>Q3 C、Q1+Q2<Q3 D、Q1+Q2>2Q3
-
13、镍及其合金是常用的催化剂,在化学反应中广泛应用。(1)、基态镍原子的价电子排布式为。(2)、镍形成的团簇分子能提高还原为CO的活性。中碳原子的杂化方式为。(3)、在Ni和合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。

①常用银氨溶液检验5-羟甲基糠醛和呋喃二醇。制备银氨溶液的操作如下:向盛有溶液的洁净试管中滴加稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是。相对于的稀氨水,所得到的银氨溶液的pH(填“升高”“降低”或“不变”),其原因是。
②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是。
(4)、羰基镍[]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是 , 其中心原子镍的配位数为。(5)、Ni和Nb组成的合金的晶胞结构如图所示。
设表示阿伏加德罗常数的值,该晶体的密度为(列出计算式)。
-
14、茅苍术醇是一种有效的抗癌药物,其一种合成路线如图所示:
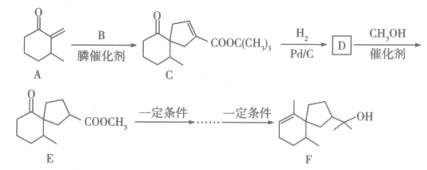
已知:①
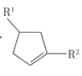 (、可以是烃基或含氧基团);
(、可以是烃基或含氧基团);②
请回答下列问题:
(1)、C中含氧官能团的名称为;F的分子式为(2)、B在酸性条件下发生水解反应生成和。①按系统命名法,的名称为。
②写出实验室由和反应生成B的化学方程式:(注明反应条件)。
③与在膦催化剂作用下生成一种五元环状有机物,该有机物的结构简式为。
(3)、写出下列反应的反应类型:C→D、D→E。(4)、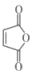 是合成哒嗪化合物的中间体,以1,3-丁二烯()为原料,补全合成
是合成哒嗪化合物的中间体,以1,3-丁二烯()为原料,补全合成 的路线:
的路线: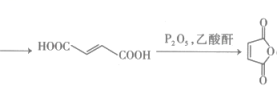 (无机试剂任选,反应条件无需写出,补写部分不超过四步)。
(无机试剂任选,反应条件无需写出,补写部分不超过四步)。 -
15、碳酸钠俗称纯碱,是一种重要的化工原料,在生活、生产和实验研究中均有广泛应用。某学习小组探究溶液与盐溶液反应的产物,进行如下实验。(1)、配制100mL的溶液。
①配制溶液过程中用托盘天平称量固体的质量为g。
②定容时,加蒸馏水不慎超过刻度线,处理的方法是。
(2)、通过下列实验探究溶液与盐溶液反应,记录实验现象如下表:装置
实验
试剂a
现象

甲
4mL溶液
产生白色沉淀
乙
4mL溶液
产生白色沉淀及大量气体
丙
4mL溶液
产生白色沉淀及大量气体
为了探究白色沉淀的成分,设计了热分解实验,其装置如图所示:

将实验乙、丙所得沉淀分别置于装置B中使样品完全分解,实验结束后,数据记录如下:
样品
加热前样品质量/g
加热后样品质量/g
装置C增重/g
装置D增重/g
实验乙样品
10.4
6.8
3.6
0
实验丙样品
22.4
16.2
1.8
4.4
①实验甲产生白色沉淀反应的离子方程式为。
②装置E的作用是。
③通过热分解实验可判断实验乙所得白色沉淀的成分为(填化学式),实验乙反应的离子方程式为。
④实验丙所得白色沉淀的化学式可表示为 , 则。
-
16、燃煤脱硫是科研工作者的重要研究课题,石灰法是其中之一,相关反应如下:
相关反应
平衡常数()
ⅰ
ⅱ
ⅲ
请回答下列问题:
(1)、、、之间的关系为(用含、的代数式表示);图中能表示随变化的直线为(填“Ⅰ”或“Ⅱ”)。 (2)、在某密闭容器中按一定比例充入、 , 并加入足量的 , 总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下的平衡转化率与混合气体的投料比之间的关系如图所示。
(2)、在某密闭容器中按一定比例充入、 , 并加入足量的 , 总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下的平衡转化率与混合气体的投料比之间的关系如图所示。
①温度 , 理由是。
②在温度下,该反应的平衡常数(用分数表示,是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
③其他条件不变,若向M点反应体系中充入一定量的(不参与反应),则的平衡转化率(填“增大”“减小”或“不变”),原因是。
-
17、纳米级硒化锰(MnSe)是一种半导体材料,难溶于水。以锰渣(主要成分是 , 含少量、CuO)为原料制备硒化锰的流程如图所示:

回答下列问题:
(1)、为了提高“酸溶”速率,宜采取的措施有(填两条)。(2)、滤渣1的主要成分之一是单质,“还原”得到的滤液中溶质为和。写出“还原”反应的离子方程式:。(3)、“氧化”中还原剂、氧化剂的物质的量之比为。(4)、滤渣2的主要成分是(填化学式)。常温下,。离子浓度时认为该离子已沉淀完全。“除铁”调节pH的最小值为。(5)、“合成”中分离MnSe的操作名称是。 -
18、25℃时,向一定浓度二元弱酸溶液[]中滴加NaOH溶液,滴加过程中,溶液中、、的分布系数与pH的关系如图所示。已知分布系数(其中X分别代表、、)。

下列叙述错误的是( )
A、时, B、c点时溶液中的物质的量恰好为0.1mol C、的化学平衡常数 D、b点溶液中水的电离受到促进 -
19、近日,中国科学院大连化学物理研究所研究员肖建平团队在合金催化剂上电催化一氧化氮还原反应合成氨研究方面取得新进展,模拟装置如图所示。

下列叙述正确的是( )
A、b极与电源负极连接,发生还原反应 B、工作时通过阴离子交换膜由b极向a极迁移 C、a极的电极反应式为 D、同温同压下,生成、气体R的体积相等 -
20、Y是一种降血脂药物,合成路线片段如图所示:

下列叙述正确的是( )
A、X中所有碳原子可能共平面 B、X能发生消去反应 C、Y中含有2个手性碳原子 D、1molY最多能与5mol发生加成反应