-
1、某化学兴趣小组模拟工业上用纯碱溶液与制备 , 并探究产品的性质和纯度。
已知:25℃时,的电离常数: , ;
的电离常数: , ;
的溶度积常数:。
Ⅰ.性质探究
(1)、若用与盐酸反应制备干燥时,净化、收集和尾气处理所需装置的接口连接顺序为 , 其中饱和溶液中发生反应的离子方程式为。 (2)、该小组同学用试管取2mL0.5mol/L溶液,逐滴加入2mL0.5mol/L溶液,振荡,溶液由黄色变为红褐色,未观察到气体和沉淀生成。
(2)、该小组同学用试管取2mL0.5mol/L溶液,逐滴加入2mL0.5mol/L溶液,振荡,溶液由黄色变为红褐色,未观察到气体和沉淀生成。①甲同学认为发生了相互促进的水解反应,生成了胶体,用激光笔照射试管,预期的现象为。
②若上述水解过程存在反应: , 则25℃时该反应的化学平衡常数K=(代入数据列出计算式)。
③乙同学认为可能同时发生反应: , 并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加溶液,观察现象。
A.KSCN B. C. D.
(3)、Ⅱ.含量探究已知所得产物含有少量(无其他杂质),25℃时相同质量的和分别溶于等量的水后,体积基本相同。
①25℃时质量分数相同的两种溶液,溶液的pH溶液。
A.大于 B.小于 C.等于 D.无法判断
②丙同学设计实验探究实验产品是否符合化工行业标准。
查阅资料 合格品的行业标准是质量分数高于93%。
提出假设 实验产品中质量分数高于93%。
实验方案 常温下完成下述实验:
步骤1:用100.0mL水溶解0.7g和9.3g , 测得;
步骤2: , 测得;
数据分析:ab(填“>”、“<”或“=”)。
实验结论 假设成立。
-
2、我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除,装置如下图。其中电极分别为ZnO@石墨烯(石墨烯包裹ZnO)和石墨烯。下列有关说法不正确的是( )
 A、ZnO@石墨烯电极连接光伏电池的负极 B、石墨烯区电极反应: C、协同转化的总反应式: D、金属导线上每转移1mol电子,和被去除的总体积约11.2L(标准状况)
A、ZnO@石墨烯电极连接光伏电池的负极 B、石墨烯区电极反应: C、协同转化的总反应式: D、金属导线上每转移1mol电子,和被去除的总体积约11.2L(标准状况) -
3、标准状态下,反应的历程示意图如下。下列说法不正确的是( )
 A、 B、历程Ⅱ中Cl是催化剂 C、历程Ⅰ的活化能为 D、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ
A、 B、历程Ⅱ中Cl是催化剂 C、历程Ⅰ的活化能为 D、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ -
4、化合物是良好的电和热绝缘体,组成元素原子序数均小于20,且在前四个周期均有分布。仅X和M同族,电负性:;Y和Z同周期,Y的基态原子价层电子排布式为 , Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是( )A、原子半径: B、第一电离能: C、熔点: D、中的E的杂化方式:
-
5、连四硫酸钠()是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为: , 按如下装置制备足量并探究其性质。下列表述不正确的是( )
 A、Ⅱ中溶液由紫色变成红色 B、Ⅲ中溶液褪色说明有还原性 C、Ⅳ中溶液无明显变化 D、基于环保,本实验应连接尾气处理装置
A、Ⅱ中溶液由紫色变成红色 B、Ⅲ中溶液褪色说明有还原性 C、Ⅳ中溶液无明显变化 D、基于环保,本实验应连接尾气处理装置 -
6、设为阿伏加德罗常数的值。反应常用于监测含量是否达到排放标准。下列说法正确的是( )A、生成2.33g沉淀时,转移电子数目为0.04 B、标准状况下,22.4L中硫原子的孤电子对数为2 C、25℃时,的HCl溶液中含有的数目为0.1 D、晶体和晶体混合物共1 mol,则极性键数目为2
-
7、下列叙述Ⅰ和Ⅱ均正确,并且有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
极易溶于水
用液氨作制冷剂
B
铝的化学性质稳定
用铝槽存放和运载浓硫酸
C
具有稳定的半衰期
用对文物进行年代测定
D
具有氧化性
用作供氧剂
A、A B、B C、C D、D -
8、部分含Fe物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
 A、可存在f→d→e的转化 B、高温下a与反应制备c C、KSCN溶液可用于鉴别f和g D、a在g溶液中反应生成f
A、可存在f→d→e的转化 B、高温下a与反应制备c C、KSCN溶液可用于鉴别f和g D、a在g溶液中反应生成f -
9、实验室用和溶液制备碳酸亚铁的装置如图所示(夹持装置已省略),三颈烧瓶中产生白色沉淀及无色气体。下列说法不正确的是( )
 A、装置甲产生可排除装置中的空气 B、装置乙中盛装的试剂为饱和溶液 C、装置丙中发生反应的离子方程式: D、反应结束后,将丙中反应液静置、过滤、洗涤、干燥,可得到碳酸亚铁
A、装置甲产生可排除装置中的空气 B、装置乙中盛装的试剂为饱和溶液 C、装置丙中发生反应的离子方程式: D、反应结束后,将丙中反应液静置、过滤、洗涤、干燥,可得到碳酸亚铁 -
10、化合物M是合成受体拮抗剂的重要中间体。关于化合物M下列说法不正确的是( )
 A、有两种官能团 B、能发生氧化反应 C、能还原新制得到 D、1mol M最多能与4mol发生加成反应
A、有两种官能团 B、能发生氧化反应 C、能还原新制得到 D、1mol M最多能与4mol发生加成反应 -
11、加强劳动教育,锻造时代新人。下列劳动项目与所述化学知识没有关联的是( )
选项
劳动项目
化学知识
A
学农活动:用农用氢氧化镁调节土壤酸碱度
可与酸性物质反应
B
帮厨活动:用草木灰等制作松花蛋
草木灰等可使蛋白质变性凝固
C
户外劳动:用明矾净水
胶体有杀菌消毒作用
D
实践活动:用糯米酿制米酒
糯米中的糖分转化生成乙醇
A、A B、B C、C D、D -
12、高氯酸()是制备导弹和火箭的固体推进剂高氯酸铵()的原料之一,下图为一种惰性电极电解高纯次氯酸制备高氯酸的模拟装置。下列有关说法不正确的是( )
 A、b为电源的正极 B、电极M处发生氧化反应 C、从左到右穿过质子交换膜 D、电极N的电极反应式:
A、b为电源的正极 B、电极M处发生氧化反应 C、从左到右穿过质子交换膜 D、电极N的电极反应式: -
13、化学处处呈现美。下列说法正确的是( )A、环己烷呈现对称美,是正六边形平面结构 B、分子呈现“皇冠”结构,属于共价晶体 C、霓虹灯发出五颜六色的光,该过程属于化学变化 D、锌片在溶液中生成“银树”,反应中锌被氧化
-
14、实验室利用制备晶体,下列实验装置和操作能达到实验目的的是( )
 A、利用装置甲制备 B、利用装置乙制备 C、利用装置丙制备溶液 D、利用装置丁蒸发获得晶体
A、利用装置甲制备 B、利用装置乙制备 C、利用装置丙制备溶液 D、利用装置丁蒸发获得晶体 -
15、化学助力美好生活。下列说法正确的是( )A、“低碳餐具套装”取材于甘蔗渣,其主要成分为纤维素 B、海底电缆使用的光纤主要成分是 , 都以晶体形态存在 C、石墨烯在新能源电池的研发中有重要作用,石墨烯与石墨互为同位素 D、C919大飞机发动机叶片使用了钛铝合金,钛铝合金的硬度小于单质铝
-
16、化学和生活、科技、社会发展息息相关。下列说法正确的是( )A、“神舟十三号”逃逸系统复合材料中的酚醛树脂属于天然高分子材料 B、杭州亚运会场馆使用的“碲化镉”光伏发电系统将化学能转化为电能 C、“深海一号”母船海水浸泡区镶上铝基是利用了牺牲阳极的金属防腐原理 D、“三元催化器”将汽车尾气中NO和CO转化为和 , 有利于实现碳中和
-
17、文房四宝是中国独有的书法绘画工具。下列文房四宝中主要由硅酸盐材料组成的是( )



A.湖州的“湖笔”
B.黄山的“徽墨”
C.宣城的“宣纸”
D.肇庆的“端砚”
A、A B、B C、C D、D -
18、某研究小组通过以下路线合成抗肿瘤药物阿贝西利(Abemaciclib)

已知:
①
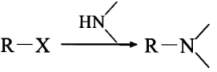
②
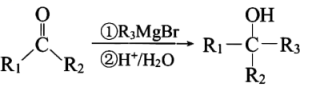 (1)、化合物A的含氧官能团的名称是。(2)、化合物H的结构简式是。(3)、下列说法正确的是____。A、化合物B的碱性比苯胺(
(1)、化合物A的含氧官能团的名称是。(2)、化合物H的结构简式是。(3)、下列说法正确的是____。A、化合物B的碱性比苯胺( )的强
B、D→E的反应类型为消去反应
C、化合物E和F可通过红外光谱区别
D、化合物
)的强
B、D→E的反应类型为消去反应
C、化合物E和F可通过红外光谱区别
D、化合物 与足量加成后的产物中有3个手性碳原子
(4)、写出B→D的化学方程式。(5)、写出满足下列条件D的同分异构体的结构简式(不考虑顺反异构)。
与足量加成后的产物中有3个手性碳原子
(4)、写出B→D的化学方程式。(5)、写出满足下列条件D的同分异构体的结构简式(不考虑顺反异构)。①分子中含有苯环,所有卤原子直接连在苯环上,氮原子不与苯环直接相连;
②谱和IR谱分析表明:有3种不同化学环境的氢原子,存在氮氮双键结构。
(6)、 是制备
是制备 的重要原料,请利用以上相关信息,以
的重要原料,请利用以上相关信息,以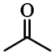 和为原料,设计合成
和为原料,设计合成 的路线(用流程图表示,无机试剂任选)。
的路线(用流程图表示,无机试剂任选)。 -
19、高锰酸钾()为紫黑色固体小颗粒,易溶于水,是一种强氧化剂。
查阅资料:①锰酸钾()为墨绿色晶体,其水溶液呈深绿色,这是锰酸根()
的特征颜色。其在浓的强碱溶液中可稳定存在,碱性减弱时易发生歧化反应。
②一些物质溶解度随温度变化单位:
物质
0
20
40
60
70
80
28
34.2
40.1
458
47.2
51.3
2.8
6.4
12.6
22.2
——
——
某实验小组设计如下实验步骤用制备
I.高锰酸钾的制备

II.高锰酸钾的提取
III.高锰酸钾的纯度测定
①准确称取样品 , 用容量瓶配成溶液;②称取高纯度固体 , 全部置于锥形瓶中,再加入溶液和纯净水后盖上表面皿,于水浴加热振荡全部溶解;③用以上溶液趁热滴定。重复②~③,滴定3次。请回答:
(1)、装置a的名称是 , 其作用①是平衡气压使液体按一定的速率顺利流下;②是。(2)、装置A中漂白粉可用____代替。A、 B、 C、 D、 (3)、上述装置存在一处缺陷导致产率降低,改进的方法是。(4)、步骤Ⅱ为了获得杂质较少的晶体,从下列选项中选出合理的操作并排序:将装置B中的溶液转移至蒸发皿中→→→→→干燥→晶体
(3)、上述装置存在一处缺陷导致产率降低,改进的方法是。(4)、步骤Ⅱ为了获得杂质较少的晶体,从下列选项中选出合理的操作并排序:将装置B中的溶液转移至蒸发皿中→→→→→干燥→晶体a.用少量冰水洗涤 b.先用冰水洗涤,再用乙醇洗涤 c.小火蒸发至析出大量晶体,停止加热
d.小火蒸发至溶液表面出现晶膜,停止加热 e.减压过滤 f.趁热过滤 g.缓慢降温结晶
(5)、下列说法正确的是____。 A、步骤I装置C中应盛放浓 B、轻轻摇动装置B,若容器内壁未见暗绿色,说明反应完全 C、步骤III中的可用或代替 D、一次平行操作滴定前与滴定后(终点)读数如右图,则本次消耗的溶液体积为(6)、某次滴定,称取固体质量 , 消耗溶液体积 , 计算该次滴定实验测得的高锰酸钾含量是(精确到小数点后两位)。
A、步骤I装置C中应盛放浓 B、轻轻摇动装置B,若容器内壁未见暗绿色,说明反应完全 C、步骤III中的可用或代替 D、一次平行操作滴定前与滴定后(终点)读数如右图,则本次消耗的溶液体积为(6)、某次滴定,称取固体质量 , 消耗溶液体积 , 计算该次滴定实验测得的高锰酸钾含量是(精确到小数点后两位)。 -
20、研发二氧化碳利用技术,降低空气中二氧化碳含量是当今研究热点。(1)、已知常温常压下的燃烧放热 , 请写出表示燃烧热的热化学方程式。(2)、1雨水中含有来自大气的 , 溶于水中的进一步和水反应,发生电离:
① ②
时,反应②的平衡常数为K,溶液中的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为 , 当大气压强为 , 大气中的物质的量分数为x时,溶液中浓度为(用题中的字母表示,忽略的电离)。
(3)、目前和已经被用作工业捕碳剂,它们与可发生如下反应:反应I:
反应Ⅱ:
为研究温度对捕获效率的影响,在某温度下,将一定量的溶液置于密闭容器中,并充入一定量的气体(用氨气作为稀释剂),在t时刻,测得容器中气体的浓度。然后分别在温度为下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得气体浓度,得到趋势图(见图1)。则:

①请解释容器内气体浓度呈现如图1所示的变化趋势的原因。
②反应Ⅱ在温度为时,溶液随时间变化的趋势曲线如图2所示,当时间达到时,将该体系升温至 , 请在图2中画出时刻至平衡时,溶液的变化总趋势曲线。
(4)、研究表明,气体可被电还原。在电解质水溶液中,三种不同催化剂(a、b、c)上电还原为的反应进程中(被还原为的反应可同时发生),相对能量变化如图。
下列说法正确的是____。
A、电解质水溶液的酸性越强,越有利于气体电化学还原 B、a催化剂条件下,电还原的活化能约为 C、c催化剂条件下,电还原的活化能小于电还原的活化能,更容易发生的电还原 D、电还原为从易到难的顺序为c、a、b