-
1、六氟磷酸盐离子液体可用于有机合成的溶剂和催化剂,其结构如图所示,下列说法错误的是( )
 A、阳离子中碳原子有和两种杂化方式 B、阴、阳离子体积较大,离子之间作用力较弱,晶体的熔点较低 C、该物质中存在的化学键类型:离子键、共价键 D、所有原子均符合8电子稳定结构
A、阳离子中碳原子有和两种杂化方式 B、阴、阳离子体积较大,离子之间作用力较弱,晶体的熔点较低 C、该物质中存在的化学键类型:离子键、共价键 D、所有原子均符合8电子稳定结构 -
2、用表示阿伏加德罗常数的值。下列叙述正确的是( )A、甲基所含有的电子数是个 B、标准状况下,的原子总数为个 C、中含有的碳碳双键数一定为 D、常温下,乙烯和丙烯的混合物中原子总数为个
-
3、苯甲酸是一种常用的食品防腐剂。某实验小组设计粗苯甲酸(含有少量和泥沙)的提纯方案如下:下列说法不正确的是( )
 A、操作I中依据苯甲酸的溶解度估算加水量 B、操作Ⅱ需要趁热的原因是防止冷却析出 C、操作Ⅲ缓慢冷却结晶可减少杂质被包裹 D、检验操作Ⅳ产物是否纯净可用硝酸酸化的
A、操作I中依据苯甲酸的溶解度估算加水量 B、操作Ⅱ需要趁热的原因是防止冷却析出 C、操作Ⅲ缓慢冷却结晶可减少杂质被包裹 D、检验操作Ⅳ产物是否纯净可用硝酸酸化的 -
4、硒化锌是一种重要的半导体材料,图甲为其晶胞结构,图乙为晶胞的俯视图。已知a点的坐标点的坐标。下列说法不正确的是( )
 A、基态的电子排布式为 B、的配位数为4 C、c点离子的坐标为 D、若换为 , 则晶胞棱长发生改变
A、基态的电子排布式为 B、的配位数为4 C、c点离子的坐标为 D、若换为 , 则晶胞棱长发生改变 -
5、下列说法中错误的是( )A、水汽化和水分解两个变化过程中都破坏了共价键 B、酸性强弱:三氟乙酸>三氯乙酸>乙酸 C、基态碳原子核外有三种能量不同的电子 D、区分晶体和非晶体最可靠的科学方法是对固体进行X射线衍射实验
-
6、实验室制取乙炔并验证其性质的装置如下图(溶液均足量)。下列说法合理的是( )
 A、电石中的仅含离子键 B、饱和食盐水可加快乙炔生成的速率 C、试管中反应: D、试管中溶液褪色说明乙炔具有还原性
A、电石中的仅含离子键 B、饱和食盐水可加快乙炔生成的速率 C、试管中反应: D、试管中溶液褪色说明乙炔具有还原性 -
7、有机物的结构可用键线式表示,如可表示为
 。下列关于两种有机化合物 A 和B的说法中错误的是( )
。下列关于两种有机化合物 A 和B的说法中错误的是( ) A、有机物A分子所有碳原子均在同一平面上 B、有机物B的化学式为 C、有机物A的二氯取代产物有4种 D、等物质的量的和与完全加成消耗的量相同
A、有机物A分子所有碳原子均在同一平面上 B、有机物B的化学式为 C、有机物A的二氯取代产物有4种 D、等物质的量的和与完全加成消耗的量相同 -
8、下列关系正确的是( )A、熔点:戊烷-二甲基戊烷-二甲基丁烷>丙烷 B、密度:苯 C、同质量的物质燃烧耗量:丙炔>乙烷>甲烷 D、同物质的量物质燃烧耗量:己烷>苯甲酸苯
-
9、下列有关晶体的说法正确的是( )
 A、冰晶体中,每个水分子与相邻的4个水分子以氢键相连接,含的冰中,最多可形成氢键 B、在晶体中,每个同时吸引8个的配位数为8 C、每个晶胞中含6个和6个
A、冰晶体中,每个水分子与相邻的4个水分子以氢键相连接,含的冰中,最多可形成氢键 B、在晶体中,每个同时吸引8个的配位数为8 C、每个晶胞中含6个和6个 -
10、下列说法正确的是( )A、烷烃的通式为 , 随的增大,碳元素的质量分数逐渐减小 B、
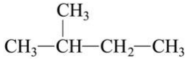 和
和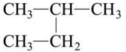 互为同分异构体
C、丙烷的空间模型为
互为同分异构体
C、丙烷的空间模型为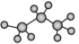 D、分子式为和分子式为的烷烃的一氯代物的数目可能相同
D、分子式为和分子式为的烷烃的一氯代物的数目可能相同
-
11、下列化学用语或表述正确的是( )A、的结构式: B、的VSEPR模型:
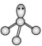 C、的离子结构示意图:
C、的离子结构示意图: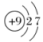 D、激发态的B原子轨道表示式:
D、激发态的B原子轨道表示式: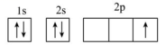
-
12、中国在航天技术和人工智能领域的发展取得了举世瞩目的成就,它们与化学有着密切联系,下列有关说法错误的是( )A、航天员宇航服中的聚酯纤维为有机高分子材料 B、我国研制的垂直结构“硅—石墨烯—锗晶体管”中所含C、Si、Ge均为主族元素 C、“天和”核心舱电推进系统中的腔体采用了氮化硼(BN)陶瓷,氮化硼含共价键 D、光导纤维、玻璃均属于新型无机非金属材料
-
13、α-甲基苯乙烯(AMS)在有机合成中用途广泛,以下是用苯为原料合成AMS并进一步制备香料龙葵醛的路线:
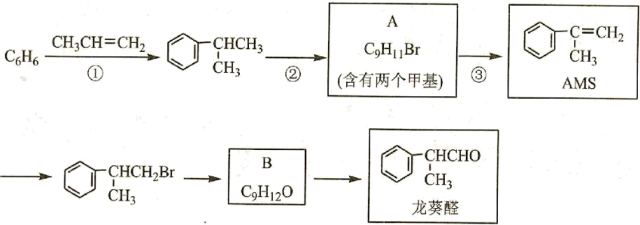 (1)、 反应①的反应类型是;B中含氧官能团的名称为。(2)、写出反应③的方程式。(3)、检验龙葵醛中官能团可选择的试剂是。(4)、写出由B制备龙葵醛的化学反应方程式。(5)、AMS 可以自身聚合,写出该高聚物的结构简式: 。(6)、B在一定条件下也可以直接制备AMS,反应所需条件为。(7)、写出符合下列条件的A的一种同分异构体的结构简式。
(1)、 反应①的反应类型是;B中含氧官能团的名称为。(2)、写出反应③的方程式。(3)、检验龙葵醛中官能团可选择的试剂是。(4)、写出由B制备龙葵醛的化学反应方程式。(5)、AMS 可以自身聚合,写出该高聚物的结构简式: 。(6)、B在一定条件下也可以直接制备AMS,反应所需条件为。(7)、写出符合下列条件的A的一种同分异构体的结构简式。i.分子中含有3个甲基 ii.苯环上的一取代物只有1种
-
14、铁是地球上分布最广泛的金属之一,约占地壳质量的5%,仅次于氧、硅、铝,位居地壳含量第四位。蛋白琥珀酸铁(CaHbOcNdFe)口服液可以用于缺铁性贫血的治疗。请回答以下相关问题:(1)、Fe元素位于周期表中区,基态铁原子的价层电子排布式为。(2)、纳米Fe因其表面活性常用作有机催化剂,如图所示:

①化合物M的熔沸点明显低于化合物N,其主要原因是。
②化合物N中C原子的杂化类型为。
③C、N、O的第一电离能由小到大的顺序为。
(3)、将C、N、O三种元素最简单氢化物按照键角从大到小排序。(4)、琥珀酸的结构如图所示,写出琥珀酸分子中σ键与π键的个数比。 (5)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与CO中的C原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的化学式。(6)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,NA表示阿伏加德罗常数,铁原子的半径为rpm,铁晶胞密度的表达式为 g•cm-3。(用含M、NA、r的代数式表示)
(5)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与CO中的C原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的化学式。(6)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,NA表示阿伏加德罗常数,铁原子的半径为rpm,铁晶胞密度的表达式为 g•cm-3。(用含M、NA、r的代数式表示)
-
15、钴及其化合物广泛应用于航天、电池、磁性合金等高科技领域,我国钴资源贫乏,再生钴资源的回收利用是解决钴资源供给的重要途径。一种利用含钴废料(主要成分为 , 含少量、有机物)制取的工艺流程如下:

已知该工艺条件下,有关金属离子开始沉淀和沉淀完全的 , 回答下列问题:
金属离子
开始沉淀的
7.5
1.8
3.4
9.1
6.5
沉淀完全的
9.5
3.2
4.7
11.1
8.5
(1)、“焙烧”的主要目的是。(2)、“浸取”过程中发生反应的离子方程式为。(3)、“沉淀”时先加入溶液,的作用主要是;再加入溶液调节为5.0,此时滤液中的。(4)、“萃取”用到的玻璃仪器主要有、烧杯,萃取原理可表述为:(水层)(有机层)(有机层)(水层)。已知萃取率随变化如下图所示,分析其变化原因。水相中含有的阳离子有。 (5)、“沉钴”可得到 , 反应的离子方程式为。
(5)、“沉钴”可得到 , 反应的离子方程式为。 -
16、近年来,改善环境是科学研究的重要课题,对实现碳循环及废气资源的再利用技术的发展都具有重要意义,请回答下列问题:(1)、CO催化加氢制 , 有利于减少有害气体CO。CO加氢制的总反应可表示为。该反应一般认为通过如下步骤来实现:
①
②
总反应的
(2)、一定条件下,和发生反应: , 设起始 , 在恒压下,反应达到平衡时的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是____。 A、若氢气的物质的量分数不再随时间而改变,则该反应达到平衡 B、加入合适的催化剂,该反应的平衡转化率和的值均增大 C、当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡 D、图中Z的大小a>3>b(3)、在T1℃时,往的某恒容密闭容器中充入和 , 发生反应 , 后该反应达到平衡,此时测得混合气体的总物质的量为起始总物质的量的1.5倍,则:
A、若氢气的物质的量分数不再随时间而改变,则该反应达到平衡 B、加入合适的催化剂,该反应的平衡转化率和的值均增大 C、当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡 D、图中Z的大小a>3>b(3)、在T1℃时,往的某恒容密闭容器中充入和 , 发生反应 , 后该反应达到平衡,此时测得混合气体的总物质的量为起始总物质的量的1.5倍,则:①内, , 的平衡转化率为%。
②该反应的平衡常数。
(4)、利用电催化可将同时转化为多种燃料,装置如图:
①铜电极上产生的电极反应式为。
②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4 , 此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为。
-
17、室温时,HCOOH和CH3COOH的电离常数分别为1.8×10-4和1.75×10-5.。将浓度和体积均相同的两种酸溶液混合后加水稀释,随加水量的变化,溶液中 HA 浓度(HA 表示混合溶液中的 HCOOH 或 CH3COOH)与溶液 pH的关系如图所示。下列叙述正确的是( )
 A、曲线X 代表 HCOOH B、稀释过程中,逐渐减小 C、当 pH=6时,c点所对应的溶液中 9.9×10-7mol·L-1 D、溶液中水电离出的H+物质的量浓度:a点=b点>c点
A、曲线X 代表 HCOOH B、稀释过程中,逐渐减小 C、当 pH=6时,c点所对应的溶液中 9.9×10-7mol·L-1 D、溶液中水电离出的H+物质的量浓度:a点=b点>c点 -
18、在离子晶体中,当时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 , 但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。下列说法不正确的是 ( )
 A、一个NaCl晶胞中含有4个 B、AgI晶体结构不同于NaCl的原因可能是和之间的化学键不是纯粹的离子键 C、NaCl晶体中阳离子位于阴离子堆积形成的正四面体空隙中 D、AgI晶体中的配位数为4
A、一个NaCl晶胞中含有4个 B、AgI晶体结构不同于NaCl的原因可能是和之间的化学键不是纯粹的离子键 C、NaCl晶体中阳离子位于阴离子堆积形成的正四面体空隙中 D、AgI晶体中的配位数为4 -
19、已知某有机物在0.25mol氧气中恰好完全燃烧,将反应生成的气体依次通过浓硫酸和碱石灰。浓硫酸增重5.4 g,碱石灰增重8.8g,下列有关说法不正确的是( )A、该有机物的同分异构体的质谱图完全一样 B、该有机物中存在氧元素 C、该有机物的分子式为C2H6O2 D、该有机物的核磁共振氢谱可能有2组峰
-
20、一种有机物催化剂由原子序数依次递增的前20号元素组成,结构式如下图。下列说法正确的是( )
 A、简单离子半径: B、简单气态氢化物稳定性: C、元素所在周期中,第一电离能大于的元素有2种 D、基态原子核外有5种不同能量的电子
A、简单离子半径: B、简单气态氢化物稳定性: C、元素所在周期中,第一电离能大于的元素有2种 D、基态原子核外有5种不同能量的电子