-
1、请根据硫元素的价类二维图,回答下列问题:
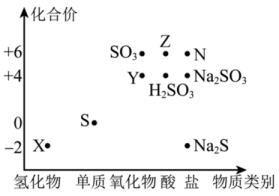 (1)、X对应的物质是 (填化学式)。(2)、宋代著名法医学家宋慈的
(1)、X对应的物质是 (填化学式)。(2)、宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2→Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误的是____(填字母)。 A、当银针变黑时,说明所检验的物质中可能有毒 B、银针验毒时,Ag被氧化 C、X在上述验毒反应中作还原剂 D、上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1(3)、Y转化为Z可以选择下列试剂。写出你所选试剂将Y转化为Z的离子方程式。
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2→Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误的是____(填字母)。 A、当银针变黑时,说明所检验的物质中可能有毒 B、银针验毒时,Ag被氧化 C、X在上述验毒反应中作还原剂 D、上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1(3)、Y转化为Z可以选择下列试剂。写出你所选试剂将Y转化为Z的离子方程式。A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
(4)、若N是CuSO4 , 某同学设计了甲和乙两种方法制备:甲: 乙:
①写出甲方法反应的化学方程式:。
②甲和乙方法更合理的是 (填“甲”或“乙”),理由是 (答两点)。
(5)、电化学法处理是目前研究的热点。利用过氧化氢吸收可消除污染,设计装置如图所示。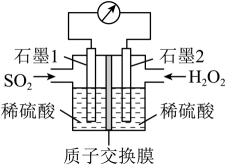
①石墨1电极处发生的电极反应式为。
②石墨2电极处发生的电极反应式为。
(6)、已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1 , 可通过下列装置定量分析空气中SO2的含量。
该组同学查阅资料得知测定原理为SO2+I2+2H2O = H2SO4+2HI,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为200 mL•s-1 , 则该地空气中的SO2含量是 mg•L-1(结果精确到0.001)。
-
2、I.元素的“价—类”二维图体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。

回答下列问题:
(1)、写出实验室利用两种固体物质加热制备物质R的化学方程式。(2)、物质R→Y是工业制硝酸的重要反应,其化学方程式是。(3)、写出物质E的浓溶液与碳单质反应的化学方程式:。(4)、写出物质Z与水反应的离子方程式: , 当反应消耗0.3mol物质Z时,转移电子数为。(5)、下列有关图中所示含N、S物质的叙述,正确的是____(填标号)。A、在催化剂的作用下,R可将Y、Z还原为X B、图中所示的物质中,只有W、D、E属于电解质 C、用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生 D、Z、C、F均能与NaOH溶液反应,都是酸性氧化物(6)、II.粗盐中含有泥沙及、、等杂质,其提纯过程一般经过以下流程: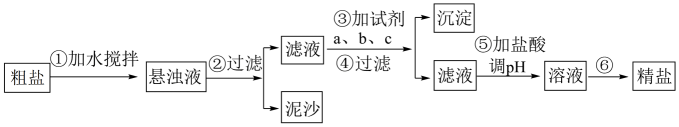
某兴趣小组按上述方案进行粗盐提纯实验,实验室提供了粗盐样品、稀盐酸、NaOH溶液、溶液、溶液等药品以及必备的实验仪器若干。请回答下列问题:
操作③按a、b、c顺序依次加入过量的试剂。若a为NaOH溶液,则c为。
(7)、加盐酸调溶液pH的目的是。 -
3、现有一定量的Cu和CuO混合物,向其中加入1.2L2.0mol/L稀硝酸,混合物完全溶解,同时生成8.96LNO(标准状况)。向所得溶液中加入一定体积2.0mol/LNaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得64.0g黑色固体(忽略溶液的体积变化)。下列说法正确的是( )A、与该混合物反应消耗的HNO3的物质的量为1.2mol B、该混合物中铜与氧化铜物质的量之比为1:3 C、加入NaOH溶液的体积是1L D、Cu2+沉淀完全后,溶液中c()为1.1mol/L
-
4、如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析正确的是( )
 A、如果a极通入 , b极通入 , 溶液作电解质溶液,则通的电极上的电极反应为 B、如果a极通入 , b极通入 , 溶液作电解质溶液,则通的电极上的电极反应为 C、如果a极通入 , b极通入 , 溶液作电解质溶液,则通的电极上的电极反应为 D、如果a极通入 , b极通入 , 溶液作电解质溶液,则溶液中的OH-向b极移动
A、如果a极通入 , b极通入 , 溶液作电解质溶液,则通的电极上的电极反应为 B、如果a极通入 , b极通入 , 溶液作电解质溶液,则通的电极上的电极反应为 C、如果a极通入 , b极通入 , 溶液作电解质溶液,则通的电极上的电极反应为 D、如果a极通入 , b极通入 , 溶液作电解质溶液,则溶液中的OH-向b极移动 -
5、有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述正确的是( )
 A、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a B、电极b是正极,O2-由电极a流向电极b C、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O D、当固体电解质中有1molO2-通过时,电子转移4mol
A、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a B、电极b是正极,O2-由电极a流向电极b C、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O D、当固体电解质中有1molO2-通过时,电子转移4mol -
6、2-丁烯有顺(
 )、反(
)、反( )两种异构体。T℃,异构体转化的能量关系如图所示,下列说法正确的是 ( )
)两种异构体。T℃,异构体转化的能量关系如图所示,下列说法正确的是 ( ) A、顺-2-丁烯转化为反-2-丁烯的过程属于物理变化 B、顺-2-丁烯稳定性大于反2-丁烯 C、T℃,1mol顺-2-丁烯完全转化成反-2-丁烯放出热量kJ D、发生反应时,顺-2-丁烯断键吸收的能量低于反-2-丁烯成键释放的能量
A、顺-2-丁烯转化为反-2-丁烯的过程属于物理变化 B、顺-2-丁烯稳定性大于反2-丁烯 C、T℃,1mol顺-2-丁烯完全转化成反-2-丁烯放出热量kJ D、发生反应时,顺-2-丁烯断键吸收的能量低于反-2-丁烯成键释放的能量 -
7、根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向溶液中滴入硫酸酸化的溶液,观察溶液颜色变化
具有氧化性
B
将缓慢通入酸性溶液中,溶液紫红色褪去
具有漂白性
C
向盛有溶液的试管中滴加几滴溶液,振荡,再滴加几滴新制的氯水,观察溶液颜色变化
具有还原性
D
向溶液X中加入稀溶液,将湿润的红色石蕊试纸置于试管口,试纸未变蓝
原溶液中不存在
A、A B、B C、C D、D -
8、下列反应的离子方程式书写正确的是( )A、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO B、向NH4HCO3溶液中加入过量的NaOH溶液:NH+OH-= NH3•H2O C、Fe(OH)2溶于过量稀硝酸:Fe(OH)2+2H+ = Fe2++2H2O D、过量SO2通入NaOH溶液中:SO2+OH-= HSO
-
9、下图装置可用于收集气体并验证其某些化学性质,下列相关的选项正确的是( )

选项
气体
试剂
现象
结论
A
NH3
酚酞溶液
溶液变红色
氨气显碱性
B
SO2
酸性KMnO4溶液
溶液褪色
SO2具有漂白性
C
HCl
硅酸钠溶液
生成白色沉淀
Cl的非金属性比Si强
D
Cl2
KI-淀粉溶液
溶液变蓝
Cl2具有氧化性
A、A B、B C、C D、D -
10、下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
选项
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
CO2(SO2)
饱和NaHCO3溶液、浓H2SO4
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
A、A B、B C、C D、D -
11、下列实验操作、现象和所得出的结论都正确的是( )
选项
实验操作
现象
结论
A
将溶液X与盐酸反应产生的气体通入品红溶液中
品红溶液褪色
溶液X中一定含有SO
B
将少量碳酸钠溶液滴入足量稀盐酸中
有气泡产生
非金属性:Cl>C
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液
溶液显蓝色
Br2的氧化性比I2强
D
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液
溶液变红
Fe(NO3)2样品已变质
A、A B、B C、C D、D -
12、类比是研究物质性质的常用方法之一。下列类比推测中正确的是( )A、与稀硝酸反应生成 , 推测与稀硝酸反应生成 B、Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS C、C与少量反应生成CO,与过量反应生成;推测S与少量O反应生成 , 与过量反应生成 D、硅可作半导体器件,推测周期表中金属与非金属交界线处的锗具有半导体性能
-
13、下列离子在指定溶液中一定能大量共存的是( )A、无色透明的溶液中:、、、 B、pH=3的溶液中:、、、 C、使酚酞变红的溶液中:、、、 D、含有大量的溶液中:、、、
-
14、下列有关叙述正确的是( )A、和质子数相同,中子数不同,互为同素异形体 B、若某气体可使品红溶液褪色,则该气体一定为 C、已知酸性:HI>HBr>HCl>HF,所以元素非金属性:I>Br>Cl>F D、同温同压下,等体积的和两种气体含有相同的分子数
-
15、NA代表阿伏加德罗常数的值,下列说法中正确的是( )A、20gD2O中含有的电子数目为9NA B、标准状况下,11.2LSO3含有分子数目为0.5NA C、1molN2与足量的H2充分反应,转移的电子数目少于6NA D、16.8gFe与足量的硫蒸气完全反应转移的电子数目为0.9NA
-
16、下列叙述正确的是( )A、CO2和SiO2都是酸性氧化物,所以两者物理性质相似 B、CO2和SiO2都能与碳反应,且都作氧化剂 C、因为 , 所以硅酸的酸性比碳酸的酸性强 D、SiO2既能与NaOH溶液反应,又能与氢氟酸反应,所以二氧化硅属于两性氧化物
-
17、化学是推动科技进步和现代社会文明的重要力量。下列有关说法错误的是( )A、制造“蛟龙号”潜水艇的钛合金属于新型无机非金属材料 B、我国“硅-石墨烯-锗晶体管”技术已获重大突破, C、Si、Ge都是主族元素C.石墨烯与金刚石互为同素异形体 D、利用CO2合成聚碳酸酯可降解塑料,有利于实现“碳中和”
-
18、化学与生活、生产、科技、环境等密切相关。下列说法错误的是( )A、碳酸氢铵常用作氮肥,不可与碱性肥料混用 B、硫酸钡可用作胃肠X射线透视的造影剂 C、二氧化硫和二氧化氮都能形成酸雨,酸雨的pH<5.6 D、SO2可用于丝织品漂白是由于其能氧化丝织品中的有色成分
-
19、以焙烧黄铁矿(FeS2 , 杂质为石英等)产生的红渣为原料制备铵铁蓝颜料,工艺流程如图。

回答下列问题:
(1)、写出两种能够提高酸浸率的措施。(2)、红渣的主要成分是(填化学式),焙烧黄铁矿过程中若产生8.96 L(标准状况)SO2 , 则反应中转移电子的数目为。(3)、若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为。(4)、“一系列操作”包括、、过滤。(5)、简述洗涤铵铁蓝沉淀的操作:。 -
20、用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
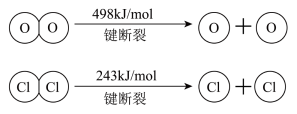 (1)、H2O的电子式是。(2)、反应A的热化学方程式是(注意:不写条件)。(3)、断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)。(4)、请回答:
(1)、H2O的电子式是。(2)、反应A的热化学方程式是(注意:不写条件)。(3)、断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)。(4)、请回答:参加反应的物质及状态
1mol分子中的化学键断裂时需要吸收的能量
436
a
369
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1 , 蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:。
(5)、已知甲烷的燃烧热为890.3kJ·mol-1 , H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1 , N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 , 则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=。(6)、二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:。