-
1、Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
化学键
H—H
Cl—Cl
O=O
C—Cl
C—H
O—H
H—Cl
E/(kJ·mol-1)
436
247
x
330
413
463
431

请回答下列问题:
(1)、如图表示某反应的能量变化关系,则此反应(填“吸收”或“放出”) kJ能量(用含有a、b的关系式表示)。(2)、反应H2(g)+O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=。(3)、历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为。(4)、Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):实验序号
A溶液
B溶液
①
20mL 0.1mol·L-1H2C2O4溶液
30mL 0.1 mol·L-1KMnO4溶液
②
20mL 0.2mol·L-1H2C2O4溶液
30mL 0.1mol·L-1KMnO4溶液
该实验探究的是因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是(填实验序号)。
 (5)、若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min内,v(MnO4-)= (假设混合液体积为50mL)。(6)、除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定来比较化学反应速率。(7)、小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②。
(5)、若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min内,v(MnO4-)= (假设混合液体积为50mL)。(6)、除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定来比较化学反应速率。(7)、小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②。 -
2、绿矾(FeSO4⋅7H2O))是一种重要的药物,也是一种工业原料。一种以黄铜矿(主要成分是CuFeS2 , 含SiO2、Al2O3等杂质)为原料制备绿矾的流程如图:

回答下列问题:
(1)、“焙烧”时,需将黄铜矿粉碎,其目的是;高温“焙烧”过程中生成了三种氧化物,其化学方程式是。(2)、滤渣1的主要成分为(填化学式,下同);滤渣2的主要成分为。(3)、“一系列操作”为:、、过滤、洗涤、干燥。(4)、硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为。(5)、绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中。 -
3、某实验小组为验证NO2与水反应的产物与课本方程式中的产物是否一致,设计如下装置进行实验(夹持装置已略去,装置气密性已检验)。

实验步骤如下:
步骤I:打开K1、K3、K5 , 关闭K2、K4 , 通入一段时间N2 , 关闭K1﹔
步骤II:打开K2 , 加入足量浓硝酸,同时打开pH传感器和c(NO)传感器,记录数据如下:[pH越小表示c(H+)越大]

步骤III:5min后,打开K4 , 用注射器将少量空气注入三颈烧瓶,关闭K4。
回答下列问题:
(1)、仪器a的名称为。(2)、“步骤I”中“通入一段时间N2”的目的是。(3)、“步骤II”中“打开K2 , 加入足量浓硝酸”时,可观察到:圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,同时烧瓶上方有红棕色气体产生,化学方程式为;片刻后,三颈烧瓶内的导管口有气泡冒出。(4)、“步骤III”中“用注射器将少量空气注入三颈烧瓶”的目的是检验(填化学式)。(5)、根据“步骤II”的数据采集和“步骤III”的实验现象,得到NO2与水反应的离子方程式为。
(6)、有同学认为该实验不严谨,传感器所记录的数据结果也可能是因为造成的。 -
4、沸石分子筛选择性催化还原的循环过程如图所示。下列说法正确的是( )
 A、反应过程中催化剂未参与电子得失 B、步骤一中与的物质的量之比为 C、每生成理论上消耗 D、所有步骤均有氧化还原反应发生
A、反应过程中催化剂未参与电子得失 B、步骤一中与的物质的量之比为 C、每生成理论上消耗 D、所有步骤均有氧化还原反应发生 -
5、2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如图所示:下列说法正确的是( )
 A、图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应式N2+6H++6e-=2NH3 D、a极上每产生22.4 L O2流过电极的电子数为4NA
A、图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应式N2+6H++6e-=2NH3 D、a极上每产生22.4 L O2流过电极的电子数为4NA -
6、部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( )
 A、a可经催化氧化生成b B、b为红棕色,可转化为c C、b、c会造成光化学烟雾,酸雨,污染环境 D、d的溶液与Cu反应可生成b或c
A、a可经催化氧化生成b B、b为红棕色,可转化为c C、b、c会造成光化学烟雾,酸雨,污染环境 D、d的溶液与Cu反应可生成b或c -
7、汽车受到猛烈碰撞时,安全气囊内的固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示。下列说法错误的是( )
 A、属于离子化合物 B、的分解反应属于放热反应 C、表示2mol固体的能量 D、作为安全气囊的气体发生剂,具有产气快、产气量大等优点
A、属于离子化合物 B、的分解反应属于放热反应 C、表示2mol固体的能量 D、作为安全气囊的气体发生剂,具有产气快、产气量大等优点 -
8、下列实验操作和现象与结论或目的对应错误的是( )
选项
操作和现象
结论或目的
A
用红色激光笔照射烧杯中的液体,在与光束垂直的方向观察到一条光亮的“通路”
验证液体为胶体
B
将分装在两支试管中,向一支试管中滴加足量盐酸,向另一支试管中滴加足量溶液,边滴边振荡,最终沉淀消失
验证为两性氢氧化物
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将浓硫酸加入蔗糖中形成多孔炭并有刺激性气味
浓硫酸具有氧化性和脱水性
A、A B、B C、C D、D -
9、已知升温、增大浓度、加大压强和使用催化剂均可以提高化学反应的速率。现把镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况(v)和反应进行的时间(t)的关系如图所示,则下列说法正确的是( )
 A、如果使用催化剂,反应结束后会产生更多质量的气体 B、t2时刻的速率大于t1时刻的速率主要原因是反应物的量较多 C、t2~t3速率变化的主要原因是盐酸的浓度逐渐减小 D、t2时恰好完全反应
A、如果使用催化剂,反应结束后会产生更多质量的气体 B、t2时刻的速率大于t1时刻的速率主要原因是反应物的量较多 C、t2~t3速率变化的主要原因是盐酸的浓度逐渐减小 D、t2时恰好完全反应 -
10、如图所示,托盘天平左、右两盘分别放有规格大小完全相同的锥形瓶,向两个锥形瓶中分别加入相应的试剂,然后塞上带导管的单孔塞并通过导管连通两瓶,调节天平平衡。下列有关说法正确的是( )
 A、若左瓶试剂为食盐晶体,右瓶试剂为烧碱固体,一段时间后,天平指针会向左偏转 B、若左瓶试剂为浓氨水,右瓶试剂为酚酞溶液,一段时间后,右瓶中的溶液会变红 C、若左瓶试剂为浓氨水,右瓶试剂为浓硫酸,一段时间后,导管中部会产生大量白烟 D、若左瓶试剂为浓硫酸,右瓶试剂为石蕊溶液,一段时间后,右瓶中的溶液会变红
A、若左瓶试剂为食盐晶体,右瓶试剂为烧碱固体,一段时间后,天平指针会向左偏转 B、若左瓶试剂为浓氨水,右瓶试剂为酚酞溶液,一段时间后,右瓶中的溶液会变红 C、若左瓶试剂为浓氨水,右瓶试剂为浓硫酸,一段时间后,导管中部会产生大量白烟 D、若左瓶试剂为浓硫酸,右瓶试剂为石蕊溶液,一段时间后,右瓶中的溶液会变红 -
11、NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4L氨气中含有的共价键数目为3NA B、将含2molH2SO4的浓硫酸与足量的焦炭反应,转移电子数目为4NA C、含1molHNO3的浓硝酸与足量的Cu反应转移电子数为NA D、1L0.1mol/L的氨水中,NH3分子、NH3·H2O分子共0.1NA
-
12、“十五”时期,碲化镉(Cde)薄膜电池研究被列入国家高技术研究发展计划(863计划)重点项目。碲化镉太阳能电池较单晶硅太阳能电池有制作方便、成本低廉和重量较轻等优点。下列说法错误的是( )A、和的核外电子数之差为2 B、的中子数比质子数多24个 C、和互为同素异形体 D、硅位于元素周期表中金属元素区与非金属元素区的分界线处,常用作半导体材料
-
13、2023年是我国实施新型基础设施建设的重要时期,在包括5G基站建设、城际高速铁路和城市轨道交通等领域都取得瞩目成就,其中涉及各种化学材料。下列相关说法错误的是( )A、中国自主研发的首个5G微基站射频芯片的主要材料是Si B、高铁动车的车厢厢体由不锈钢和铝合金制成,不锈钢和铝合金均属于金属材料 C、国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料 D、歼-20战斗机在长春航展上完美亮相,其机身采用的碳纤维是有机高分子材料
-
14、下列选项涉及的过程中能实现化学能直接转化为电能的是( )A、水力发电
 B、太阳能发电
B、太阳能发电  C、微生物燃料发电
C、微生物燃料发电 D、电动汽车充电
D、电动汽车充电
-
15、在光照条件下与反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
 (1)、下列说法正确的是____(填字母)。A、反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生 B、将该装置放在黑暗处,与也能反应 C、该实验发生了取代反应 D、和完全反应后试管内液面上升,液体充满试管(2)、生成的化学方程式为。(3)、氯代的机理为自由基(带有单电子的原子或原子团,如、)反应,包括以下几步:
(1)、下列说法正确的是____(填字母)。A、反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生 B、将该装置放在黑暗处,与也能反应 C、该实验发生了取代反应 D、和完全反应后试管内液面上升,液体充满试管(2)、生成的化学方程式为。(3)、氯代的机理为自由基(带有单电子的原子或原子团,如、)反应,包括以下几步:Ⅰ.链引发
Ⅱ.链传递
Ⅲ.链终止
…
…
①写出由生成过程中链传递的方程式:、。
②已知:25℃、时,中键和中键的键能分别是和。则反应完全反应(填“放出”或“吸收”)热量。
(4)、丙烷氯代反应中链传递的一步反应能量变化如图。
分析上图可知,中键能比
 中键能(填“大”或“小”)。(5)、能说明甲烷是正四面体而非正方形平面结构的是(填序号)。
中键能(填“大”或“小”)。(5)、能说明甲烷是正四面体而非正方形平面结构的是(填序号)。①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
-
16、工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为和),其反应的化学方程式为 , 请回答下列问题:(1)、上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是____。
 A、铝粉与氧化铁的反应 B、氯化铵与的反应 C、锌片与稀硫酸的反应 D、钠与冷水的反应(2)、一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是____。A、充入使容器压强增大,提高反应速率 B、 , 说明反应达到平衡状态 C、容器中焦炭的质量不再变化,说明反应达到平衡状态 D、容器中水蒸气与氢气的体积比为时,说明反应达到平衡状态(3)、在体积均为的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和水蒸气,在不同温度下反应的过程如下图所示:
A、铝粉与氧化铁的反应 B、氯化铵与的反应 C、锌片与稀硫酸的反应 D、钠与冷水的反应(2)、一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是____。A、充入使容器压强增大,提高反应速率 B、 , 说明反应达到平衡状态 C、容器中焦炭的质量不再变化,说明反应达到平衡状态 D、容器中水蒸气与氢气的体积比为时,说明反应达到平衡状态(3)、在体积均为的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和水蒸气,在不同温度下反应的过程如下图所示:
①甲容器中,内的平均反应速率。
②甲容器中,A点正反应速率B点的逆反应速率(填“<”“>”或“=”)。
③反应过程中,两个容器温度:甲乙(填“<” “>”或“=”)。
④乙容器中C点时,的物质的量百分数为。
(4)、在溶液条件下,以为原料,可制成一种燃料电池,写出该电池的负极反应式 , 当燃料电池消耗(标况下)时,正极上有参与反应。 -
17、物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮物质和含氯物质的价类二维图如下,回答下列问题:
 (1)、关于上述部分物质间转化的说法正确的是____(填字母)。A、a和c可在一定条件下反应生成b B、工业上通过a→b→d→e来制备HNO3 C、浓的a'溶液和浓的c'溶液反应可以得到b' D、a和a'在空气中相遇产生白烟(2)、固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
(1)、关于上述部分物质间转化的说法正确的是____(填字母)。A、a和c可在一定条件下反应生成b B、工业上通过a→b→d→e来制备HNO3 C、浓的a'溶液和浓的c'溶液反应可以得到b' D、a和a'在空气中相遇产生白烟(2)、固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
a.该转化过程①②③反应中为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有(填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3 , 同时生成molO2。
(3)、在常温下铁、铜与e的浓溶液组成原电池。①请在下面方框中画出该原电池的装置图。要求:注明电解质溶液名称、正负极材料,并标出电子移动方向。

②写出该电池总反应式和负极反应式:电池总反应式:;负极反应式:。
(4)、由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:。 -
18、某化学兴趣小组对与的产物进行了探究.
同学们经过讨论,提出了如下猜想:
猜想1:产物为和
猜想2:产物为
甲同学设计如图所示实验装置(夹持装置已省略)制备并进行实验探究,请回答下列问题:
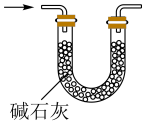
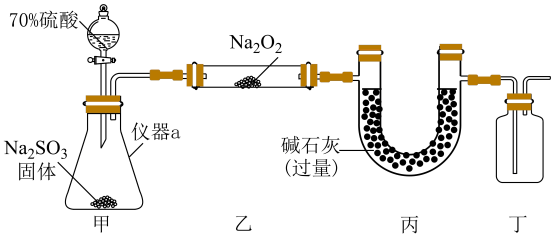 (1)、仪器a的名称为;打开分液漏斗活塞,装置甲中发生反应的离子方程式为;使用70%的硫酸而不用98%的硫酸的原因是 .(2)、①甲同学用带火星的木条检验出丁中收集的气体为氧气,该同学认为猜想1正确,乙同学分析装置后推翻了甲同学的结论,乙同学的理由可能是 , 乙同学对实验装置进行了改进,在装置甲和装置乙之间添加了装置戊,装置戊可能是(填标号).
(1)、仪器a的名称为;打开分液漏斗活塞,装置甲中发生反应的离子方程式为;使用70%的硫酸而不用98%的硫酸的原因是 .(2)、①甲同学用带火星的木条检验出丁中收集的气体为氧气,该同学认为猜想1正确,乙同学分析装置后推翻了甲同学的结论,乙同学的理由可能是 , 乙同学对实验装置进行了改进,在装置甲和装置乙之间添加了装置戊,装置戊可能是(填标号).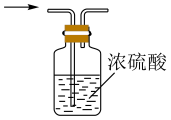
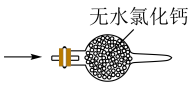
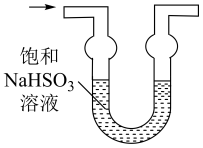
A
B
C
D
②改进实验装置后,丙同学在乙处硬质玻璃管内淡黄色固体全部变成白色后,取适量反应后的白色固体a于试管i中,加入适量的稀硫酸,有气泡产生,将产生的气体通入适量酸性高锰酸钾溶液b中,溶液b褪色,说明固体a中含有(填化学式),溶液b褪色的离子方程式为;另取适量固体a于试管ii中,加入足量的稀盐酸酸化,充分反应后,加入适量的溶液,观察到有白色沉淀产生,该白色沉淀为(填化学式)。
实验结论:与在常温时就能发生化学反应,生成(填化学式)和 .
-
19、下列有关离子检验的叙述正确的是( )
选项
操作及现象
结论
A
少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解
溶液中含有Ag+或SO42-
B
取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色
溶液中含有Br-
C
取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝
溶液中含有NH4+
D
取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色
原溶液中含有Fe2+
A、A B、B C、C D、D -
20、现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是( )
 A、制取氨气时烧瓶中的固体常用 B、将湿润的蓝色石蕊试纸置于三颈烧瓶瓶口,试纸变红,说明已经充满 C、关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则B点时喷泉最剧烈 D、若实验是在0℃、常压条件下完成,则在E点烧瓶中溶液溶质的物质的量浓度为
A、制取氨气时烧瓶中的固体常用 B、将湿润的蓝色石蕊试纸置于三颈烧瓶瓶口,试纸变红,说明已经充满 C、关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则B点时喷泉最剧烈 D、若实验是在0℃、常压条件下完成,则在E点烧瓶中溶液溶质的物质的量浓度为