-
1、下列化学用语使用正确的是( )A、中子数为17的P原子为 B、水的空间结构为
 C、H2O2的电子式为
C、H2O2的电子式为 D、基态S原子的价层电子轨道表示式为
D、基态S原子的价层电子轨道表示式为
-
2、抗坏血酸(结构如图所示)是水果罐头中常用的抗氧化剂,下列说法正确的是( )
 A、基态氧原子的未成对电子数为3 B、抗坏血酸分子中不存在手性碳原子 C、抗坏血酸分子中含有极性键和非极性键 D、碳原子中,2p、3p能级中的轨道数依次增多
A、基态氧原子的未成对电子数为3 B、抗坏血酸分子中不存在手性碳原子 C、抗坏血酸分子中含有极性键和非极性键 D、碳原子中,2p、3p能级中的轨道数依次增多 -
3、下列过程中,的是( )A、碳酸氢钠分解 B、氧化钙溶于水 C、石灰石分解 D、稀盐酸与NaHCO3反应
-
4、保护甲午海战致远舰,控制海水腐蚀至关重要。我国水下考古队员们潜入海底,把30公斤重的锌块固定在致远舰残存的铁甲表面。下列说法错误的是( )
 A、致远舰在海水中主要发生电化学腐蚀 B、时间久了,锌块质量会越来越小 C、该法利用了牺牲阳极法的原理 D、将锌块换成铜块也能达到相同目的
A、致远舰在海水中主要发生电化学腐蚀 B、时间久了,锌块质量会越来越小 C、该法利用了牺牲阳极法的原理 D、将锌块换成铜块也能达到相同目的 -
5、ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2 , 成为自来水的消毒剂。已知ClO2是一种易溶于水的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl,下图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品已省略),其中E用于除去ClO2中的未反应的Cl2。
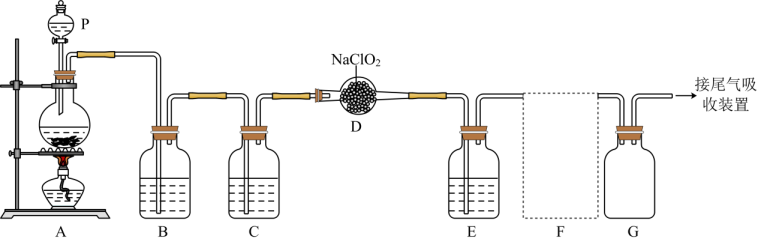 (1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、B装置中所盛试剂是。(4)、F为ClO2收集装置,应选用的装置是(填序号),其中与E装置导管相连的导管口是(填接口字母)。
(1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、B装置中所盛试剂是。(4)、F为ClO2收集装置,应选用的装置是(填序号),其中与E装置导管相连的导管口是(填接口字母)。 (5)、ClO2的另一种制备方法是用氯酸钠(NaClO3)与浓盐酸反应,同时生成Cl2。
(5)、ClO2的另一种制备方法是用氯酸钠(NaClO3)与浓盐酸反应,同时生成Cl2。①请写出该反应的化学方程式: , 每消耗319.5gNaClO3 , 生成L氯气(标况下)。(M(NaClO3)=106.5)。
②浓盐酸在该反应中表现出来的性质是(填序号)。
A. 只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
-
6、某磁铁矿石A的主要成分是磁性氧化铁(Fe3O4),还含少量的Al2O3、Cu2O。某工厂利用此矿石进行有关物质的回收利用,其中F为常见的补铁剂,工艺流程如图(已知Cu2O不溶于水和碱,但溶于强酸:Cu2O+2H+=Cu+Cu2++H2O)。根据流程回答下列问题:
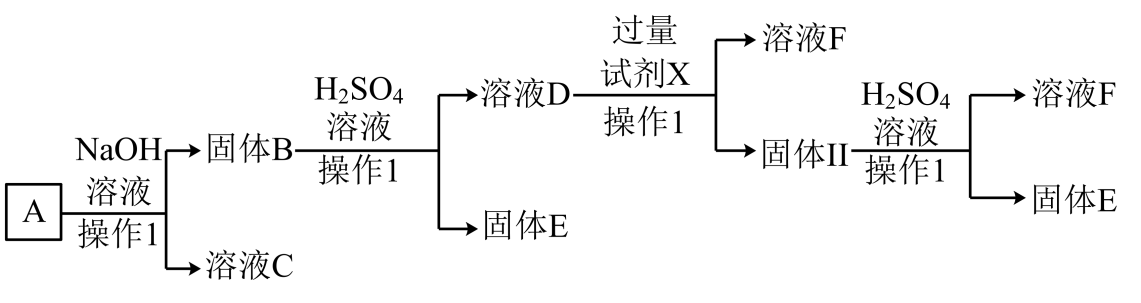 (1)、溶液C的溶质主要是 , 铝离子的结构示意图为。(2)、溶液D与过量试剂X反应的离子方程式是、。(3)、在溶液F中滴加NaOH溶液的现象是。(4)、操作1的名称为。(5)、已知E为红色固体,写出证明E中无Cu2O的方法:(写出实验操作与现象)。
(1)、溶液C的溶质主要是 , 铝离子的结构示意图为。(2)、溶液D与过量试剂X反应的离子方程式是、。(3)、在溶液F中滴加NaOH溶液的现象是。(4)、操作1的名称为。(5)、已知E为红色固体,写出证明E中无Cu2O的方法:(写出实验操作与现象)。 -
7、下列编号代表元素周期表中的一部分元素,用化学用语回答下列问题:
 (1)、碳元素在周期表中的位置为 , 它的最高价氧化物的电子式为。(2)、①④形成的化合物的化学键类型为 , ③⑧形成的化合物的电子式为 ,
(1)、碳元素在周期表中的位置为 , 它的最高价氧化物的电子式为。(2)、①④形成的化合物的化学键类型为 , ③⑧形成的化合物的电子式为 ,④形成的单质的结构式为。
(3)、②⑥的最高价氧化物的水化物发生反应的离子方程式为。(4)、⑧⑨简单氢化物的稳定性较强的是(写简单氢化物的化学式),⑤单质的氧化性比⑦的强,请从原子结构的角度解释其原因:。(5)、现拟用如下装置,证明元素的非金属性强弱:S>C,请选用合适的试剂完成实验。
实验试剂
甲:;乙:;丙(均填试剂的化学式)
可得出结论的实验现象
-
8、学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:(1)、云、雾属于胶体,鉴别胶体和溶液的方法是 , 胶体和溶液的本质区别是。(2)、生铁是(填“混合物”或“化合物”)。通常合金的熔点(填“高于”或“低于”)其组成单质的熔点。(3)、ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:。产生1molClO2时,转移电子的物质的量为mol;该反应中的还原剂是(填化学式)。(4)、在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=。(5)、Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是 , 从a点到b点反应的离子方程式是 , 解释b点之后导电能力上升的原因:。

-
9、某工厂的工业废水中含有大量的和较多的。为减少污染并变废为宝,工厂计划从该废水中回收金属铜,并制备 , 流程如下:

下列说法正确的是( )
A、甲为铁粉,乙为溶液 B、操作1和操作2均用到漏斗、烧杯和玻璃棒,且固体2为铜 C、往溶液1与溶液2中加入反应生成NO,欲制备1.5mol , 理论上至少需要2mol D、为检验中是否含有 , 加入盐酸溶解,再加入过量NaOH溶液,观察沉淀颜色变化 -
10、某同学欲配制100mL 溶液。以下操作①~④是其配制过程及示意图,关于该配制过程,下列说法正确的是( )
 A、操作①中,称取2.5g胆矾晶体,并于烧杯中加水溶解 B、操作②中,容量瓶使用前需用自来水、蒸馏水洗涤,干燥后才可用 C、操作③为定容,若仰视,将导致所配溶液浓度偏高 D、操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切
A、操作①中,称取2.5g胆矾晶体,并于烧杯中加水溶解 B、操作②中,容量瓶使用前需用自来水、蒸馏水洗涤,干燥后才可用 C、操作③为定容,若仰视,将导致所配溶液浓度偏高 D、操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切 -
11、以不同类别物质间的转化为线索,认识钠及其化合物。
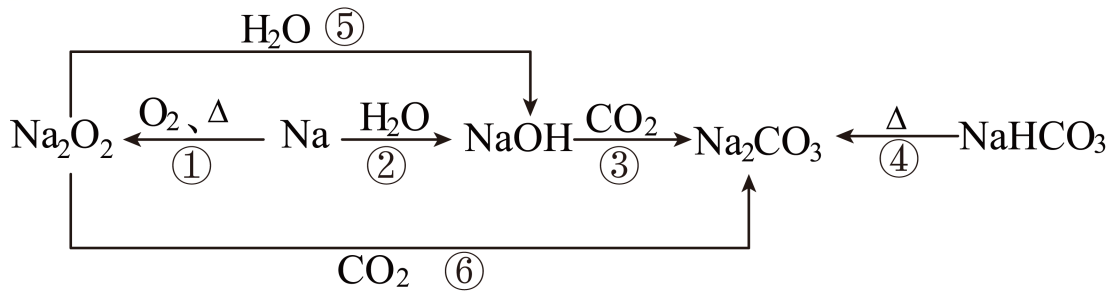
下列分析不正确的是( )
A、反应③表明CO2具有酸性氧化物的性质 B、反应④说明NaHCO3的热稳定性强于Na2CO3 C、反应⑤、⑥可用于潜水艇中氧气的供给 D、上述转化中发生的反应有分解反应、化合反应、置换反应 -
12、把含有氧化铁的铁丝投入足量稀硫酸中,直到固体全部溶解,经分析,溶液中无 , 且生成的与反应产生的的物质的量之比为。则原混合物中氧化铁与铁的物质的量之比为( )A、1∶2 B、2∶5 C、1∶1 D、4∶1
-
13、其同学为测定固体(含少量)的纯度,设计如下装置(含试剂)进行实验。下列说法正确的是( )
 A、通入空气的作用是保证②中产生的气体完全转移到③中 B、必须在①②间添加一个装有浓硫酸的洗气瓶,除去空气中的水分 C、只根据装置③增加的质量即可求算固体的纯度 D、④的作用是防止空气中的某些成分进入③中,也可以换成无水氯化钙
A、通入空气的作用是保证②中产生的气体完全转移到③中 B、必须在①②间添加一个装有浓硫酸的洗气瓶,除去空气中的水分 C、只根据装置③增加的质量即可求算固体的纯度 D、④的作用是防止空气中的某些成分进入③中,也可以换成无水氯化钙 -
14、室温下,下列实验探究方案不能达到探究目的的是( )
选项
探究方案
探究目的
A
向盛有溶液的试管中滴加几滴溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化
证明具有还原性
B
用玻璃棒蘸取某无色溶液后在酒精灯火焰上灼烧,观察火焰颜色
检验溶液中有
C
向盛有淀粉溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化
比较和的氧化性强弱
D
向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,观察脱脂棉燃烧
证明过氧化钠与水反应放热
A、A B、B C、C D、D -
15、下列反应的现象描述与离子方程式都正确的是( )A、向碳酸钙固体中加入盐酸,固体溶解,有气泡逸出:CO+2H+=H2O+CO2↑ B、向氯化亚铁溶液中加入过量铜粉,振荡,有黑色固体析出:Cu+Fe2+=Fe+Cu2+ C、将金属镁投入稀硫酸中,有无色气泡产生:Mg+2H++SO=MgSO4+H2↑ D、向氢氧化钡溶液中滴加稀硫酸,产生白色沉淀:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
-
16、设表示阿伏加德罗常数的值。下列说法正确的是( )A、溶于水形成的胶体中含有个胶体粒子 B、常温下,4g氢气所含的原子数目为 C、的溶液中含有H原子数大于 D、和中含有的质子数均为
-
17、常温下,下列离子在指定的水溶液中能大量共存的是( )A、的溶液中:、、、 B、在溶液中:、、、 C、含有大量的溶液中:、、、 D、能使酚酞变红的溶液中:、、、
-
18、下列各组物质,不会因反应条件(温度或者反应物用量)改变而引起产物改变的是( )A、溶液和 B、Fe和 C、Na和 D、NaOH溶液和
-
19、随原子序数的递增,八种短周期元素的原子半径、最高正价或最低负价的变化如图所示。
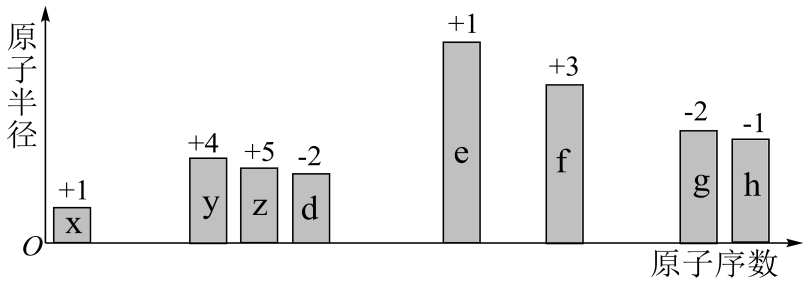
下列叙述正确的是( )
A、离子半径的大小顺序:d<f<e B、d与e组成的化合物一定只含离子键 C、x、z、d组成的化合物一定是共价化合物 D、h、g对应的阴离子还原性:h<g -
20、锗(Ge)是第四周期ⅣA族元素,处于周期表中金属与非金属的交界处,下列叙述正确的是( )A、锗是一种金属性很强的元素 B、锗的单质具有半导体的性能 C、锗化氢()的稳定性很强 D、锗酸()是强酸