-
1、一种脱除和利用水煤气中(设电催化还原产物为)的方法如图,下列说法错误的是
 A、水蒸气进入再生塔提供能量,促进的分解 B、a电极为电源的负极,电解池溶液中的向铂电极移动 C、电子的迁移方向:a电极铂电极电解质溶液玻碳电极电极 D、当电路中转移1.2mol电子时,两极生成气体的总体积为8.96L(标准状况)
A、水蒸气进入再生塔提供能量,促进的分解 B、a电极为电源的负极,电解池溶液中的向铂电极移动 C、电子的迁移方向:a电极铂电极电解质溶液玻碳电极电极 D、当电路中转移1.2mol电子时,两极生成气体的总体积为8.96L(标准状况) -
2、硫化镁钙是一种潜在的新型材料,其晶胞结构如图所示。下列叙述正确的是

已知:晶胞中1号原子的分数坐标为()。
A、基态原子的价层电子的电子云轮廓图为哑铃形 B、距离原子最近的S原子的数目为2 C、该物质的化学式为 D、2号S原子的分数坐标为() -
3、饮用水净水剂WY(ZX4)2·12R2X由周期表中前20号元素组成,且R、X、Y、Z、W的原子的序数依次增大。基态R、W原子最外层电子排布式为ns1 , 基态原子核外s、p能级上电子总数相等。Y在元素周期表中周期序数等于主族序数,X和Z位于同主族。下列叙述正确的是A、第一电离能: B、电负性: C、最简单氢化物的稳定性: D、简单离子半径:
-
4、为了探究与水反应的情况,进行如图实验,实验中观察到甲中固体逐渐溶解,乙中溶液变为红色,下列推断错误的是
 A、甲中有氨气产生 B、乙中倒置干燥管能防倒吸 C、其他条件不变,移走热水浴,乙中变色速率减慢 D、若用稀硫酸代替水,甲中可能观察到白烟
A、甲中有氨气产生 B、乙中倒置干燥管能防倒吸 C、其他条件不变,移走热水浴,乙中变色速率减慢 D、若用稀硫酸代替水,甲中可能观察到白烟 -
5、下列离子方程式正确的是A、磁性氧化铁溶于足量浓硝酸,得到浅黄色溶液: B、用浓氨水溶解试管底部的: C、将溶液和溶液混合,产生红褐色沉淀: D、在溶液中加入溶液,产生浅黄色沉淀和有刺激性气味的气体:
-
6、设为阿伏加德罗常数的值,碘及其化合物有如图所示的转化关系。下列叙述正确的是
 A、反应①中,常温常压下,完全反应转移的电子数为 B、反应②中,生成氧化产物和还原产物的数目均为 C、反应③中,每生成 , 转移的电子数为 D、反应④中,每生成 , 转移的电子数为
A、反应①中,常温常压下,完全反应转移的电子数为 B、反应②中,生成氧化产物和还原产物的数目均为 C、反应③中,每生成 , 转移的电子数为 D、反应④中,每生成 , 转移的电子数为 -
7、工业上,用溶液吸收氯气制备漂白液时要控制好温度。在不同温度下,用相同浓度的溶液吸收氯气制备漂白液,测得氧化产物与转移电子的物质的量的关系如图所示。下列叙述错误的是

已知:反应1、反应3分别在25℃、70℃条件下进行,均只有一种氧化产物;反应2有两种氧化产物,其中一种与反应1的相同,另一种与反应3的相同。
A、制备漂白液宜选择常温或较低温度 B、反应2为 C、上述3个反应中,参与反应的 D、根据上述信息可知,用热水稀释漂白液,有效成分的含量可能降低 -
8、含Fe元素或Cu元素或N元素的部分物质的“价-类”关系如图所示,下列叙述错误的是
 A、若a在常温常压下呈气态,则在雷电作用下,a与一步反应就可以得到f B、若c为蓝色,则两种物质之间一步反应能实现:c→b→a C、若a能被强磁铁吸附,则a和e能发生化合反应 D、若d为红褐色,则b、c均能与足量的稀硝酸发生氧化还原反应
A、若a在常温常压下呈气态,则在雷电作用下,a与一步反应就可以得到f B、若c为蓝色,则两种物质之间一步反应能实现:c→b→a C、若a能被强磁铁吸附,则a和e能发生化合反应 D、若d为红褐色,则b、c均能与足量的稀硝酸发生氧化还原反应 -
9、物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项
性质差异
结构因素
A
第一电离能:
电子层结构
B
沸点:邻羟基苯甲酸对羟基苯甲酸
化学键类型
C
酸性:
羟基极性
D
熔点:硅晶体白磷
晶体类型
A、A B、B C、C D、D -
10、北京理工大学材料学院某课题小组合成了一种高能材料,其合成“片段”如图,下列叙述正确的是
 A、是合成的单体 B、制备需要 C、和都能自然降解 D、和均含有2种官能团
A、是合成的单体 B、制备需要 C、和都能自然降解 D、和均含有2种官能团 -
11、下列离子组在指定条件下能大量共存的是A、在澄清溶液中:Cu2+、、、Cl- B、在0.1mol·L-1Ba(OH)2溶液中:Mg2+、Na+、、 C、在0.1mol·L-1HI溶液中:Fe3+、Al3+、Br-、 D、在0.1mol·L-1FeSO4溶液中:Na+、、S2-、Cl-
-
12、多姿多彩的艺术品是人类文明的见证,有些艺术瑰宝已有数百年甚至上千年的历史。下列颜料的颜色变化不涉及氧化还原反应的是A、朱砂: B、镉黄: C、红铅: D、铜绿:
-
13、南粤之地人杰地灵,文化灿烂。下列广东博物院馆藏文物中,一种文物的主要材料不同于其他三种文物的是A、南朝青铜盘 B、饕餮纹铜觚 C、南宋鎏金腰带 D、通雕蟹篓(木雕)
-
14、活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。

已知几种金属离子生成氢氧化物的如下表:
金属离子
开始沉淀的
完全沉淀的
1.5
3.7
7.9
10.0
6.3
9.7
7.4
9.4
回答下列问题:
(1)、的原子结构示意图为 。中铁的化合价为。 (2)、“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是。(3)、a的范围为。“除铁”的离子方程式为。(4)、金属M的化学式为。(5)、①“活性炭”表现的性质是(填字母)。
。中铁的化合价为。 (2)、“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是。(3)、a的范围为。“除铁”的离子方程式为。(4)、金属M的化学式为。(5)、①“活性炭”表现的性质是(填字母)。A.氧化性 B.还原性 C.吸附性
②“沉锌”的滤液采用、 , 过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)、“高温焙烧”过程中发生反应的化学方程式为。 -
15、亚硝酰溴常用于有机合成等。工业上,常用与反应制取 , 其制备原理为。(1)、实验室常将液溴保存在水中,其原因是。实验室常用和浓硫酸混合共热制备 , 写出该反应的化学方程式:。(2)、在恒容恒温条件下,充入和 , 发生上述反应。下列情况表明反应达到化学平衡状态的是_______(填字母)。A、混合气体密度不随时间变化 B、混合气体压强不随时间变化 C、混合气体平均摩尔质量不随时间变化 D、生成速率等于消耗速率(3)、某条件下,该反应速率 , 其中为速率常数,只与温度、催化剂有关,为反应级数,可以取负数、正数;也可以取分数和整数。为了测定反应级数,实验结果如下:
实验
反应速率
Ⅰ
0.1
0.1
0.1
Ⅱ
0.2
0.1
0.1
Ⅲ
0.2
0.2
0.1
Ⅳ
0.4
0.2
0.2
①反应级数为。
②其他条件相同,升高温度,(填“增大”“减小”或“不变”)。
(4)、在体积相同的甲、乙容器中均充入和 , 在“恒温恒容”、“绝热恒容”条件下发生上述反应,测得压强与时间关系如图所示。提示:①绝热恒容指物质与能量与外界不交换,即对于放热反应,容器温度会升高;②对于恒温恒容条件下,气体总压强与气体总物质的量成正比例;③在体积相同的条件下,一定物质的量的气体,温度越高,压强越大。
①属于绝热恒容容器的是(填“甲”或“乙”),中反应物总能量(填“高于”或“低于”)产物总能量。气体总物质的量:(填“>”“<”或“=”)。
②点NO的转化率为。
-
16、为阿伏加德罗常数的值。下列叙述正确的是A、(重氨)含中子数为 B、乙烯和乙醇蒸气的混合物完全燃烧消耗分子数为 C、在中生成时转移电子数为 D、和足量乙醇反应生成酯基的数目为
-
17、近日,一款激素类药物“醋酸氢化可的松片”上热搜。它的键线式如图所示。已知:与四个互不相同的原子或基团相连接的碳原子叫手性碳原子。下列叙述错误的是
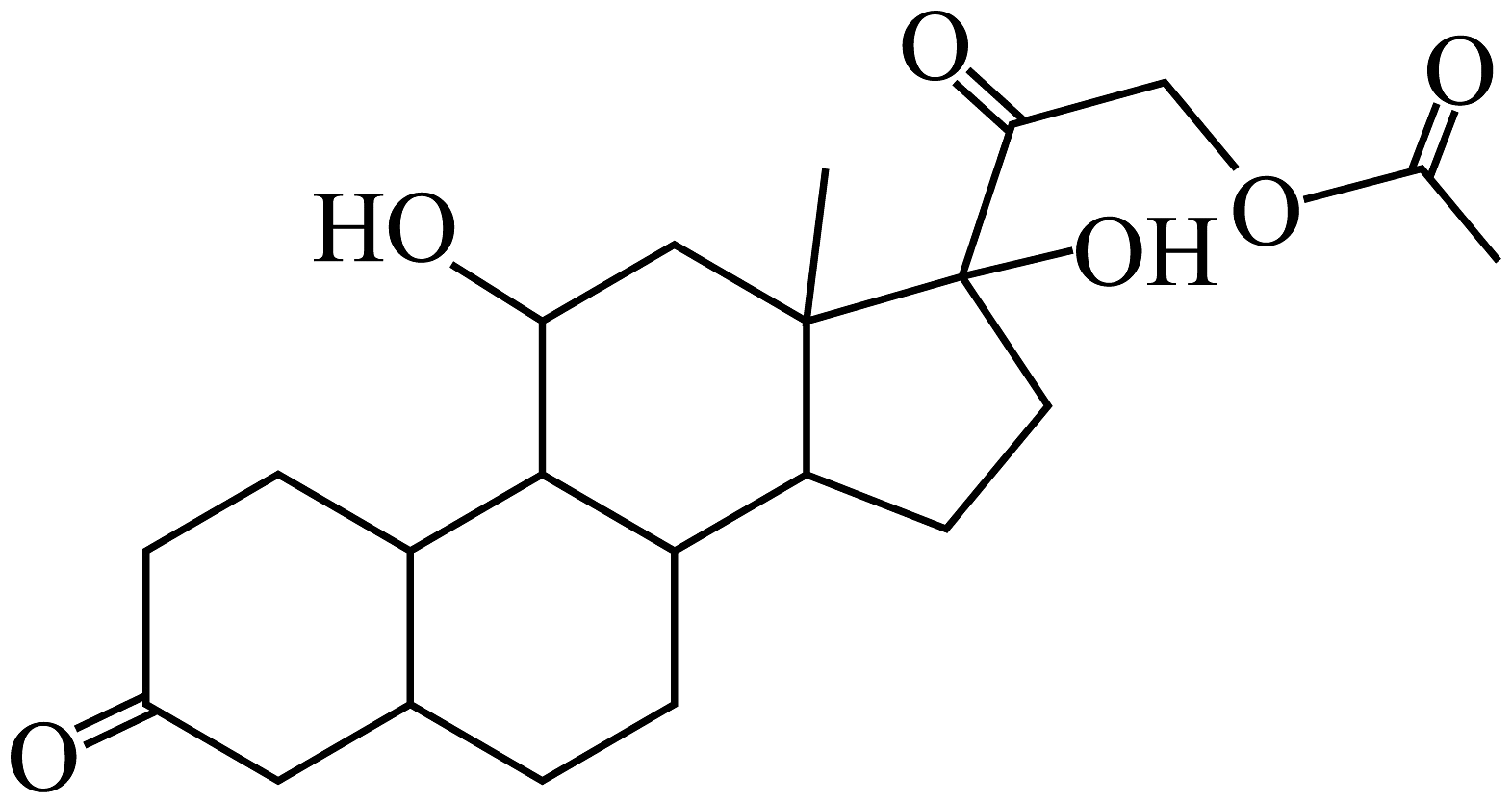 A、该物质中含有3个甲基 B、该物质分子含有手性碳原子 C、该物质能发生氧化、加成、取代反应 D、该物质能与溶液反应
A、该物质中含有3个甲基 B、该物质分子含有手性碳原子 C、该物质能发生氧化、加成、取代反应 D、该物质能与溶液反应 -
18、硅被誉为信息革命的“催化剂”。高纯硅的制备简易流程如图。下列叙述正确的是
 A、反应①的生成物有CO2、SiC B、反应②发生置换反应生成SiHCl3和H2 C、已知SiHCl3中H显﹣1价,则反应③中氧化剂是SiHCl3 , 还原剂是H2 D、制得的高纯硅可用于制造光导纤维
A、反应①的生成物有CO2、SiC B、反应②发生置换反应生成SiHCl3和H2 C、已知SiHCl3中H显﹣1价,则反应③中氧化剂是SiHCl3 , 还原剂是H2 D、制得的高纯硅可用于制造光导纤维 -
19、18世纪70年代瑞典化学家舍勒将软锰矿(主要成分为MnO2)和浓盐酸混合加热得到一种黄绿色气体——氯气。受此启发,某小组设计如下实验,能达到实验目的的是
 A、图A是制备氯气 B、图B是纯化氯气 C、图C是铁丝在氯气中燃烧 D、图D是证明氯气有漂白性
A、图A是制备氯气 B、图B是纯化氯气 C、图C是铁丝在氯气中燃烧 D、图D是证明氯气有漂白性 -
20、
学习小组开展了“设计和制作简易供氧器”的实践活动。
活动一 如图所示,该制氧机通过A、B两种物质产生氧气,其中A是过碳酸钠白色固体,B是二氧化锰黑色粉末。过碳酸钠加水溶解会分解生成和。

用该制氧机制氧时,在反应仓中加入适量水,再先后加入过碳酸钠和二氧化锰,反应仓内的现象为黑色粉末翻腾,溶液变得浑浊,仓壁变得温热,过滤仓底部导气管口有气泡冒出。
(1)反应仓中生成氧气,过滤仓中的水除了有过滤杂质提纯氧气的作用外,还可以起到的作用是(填字母)。
A.可以通过气泡观察氧气生成的速率 B.降低氧气温度 C.加快氧气的生成
(2)验证过滤仓导出的气体是氧气的方法是:将带放在 , 若出现的现象,则是氧气。
(3)反应仓中“通道”相当于下图装置中的(选填“c”或“d”)导管。

活动二 制作简易的家用制氧机
(4)同学们在充分思考交流的基础上,利用家庭中常见材料,设计并制作了简易家用制氧机(如图),其中C瓶的作用相当于仓(反应或过滤)。
