-
1、下列实验操作不能达到目的的是
目的
A.检验四氯化碳中的氯元素
B.检验是否沉淀完全
操作

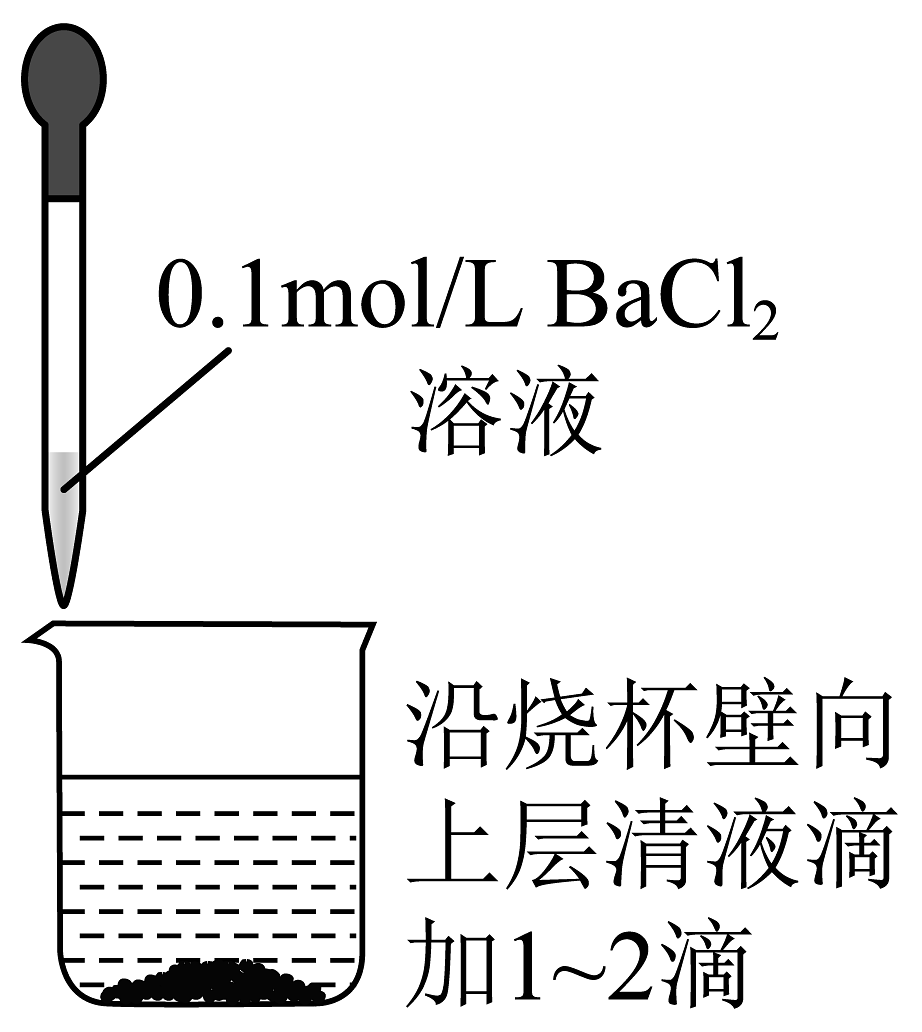
目的
C.制备检验醛基用的
D.喷泉实验
操作
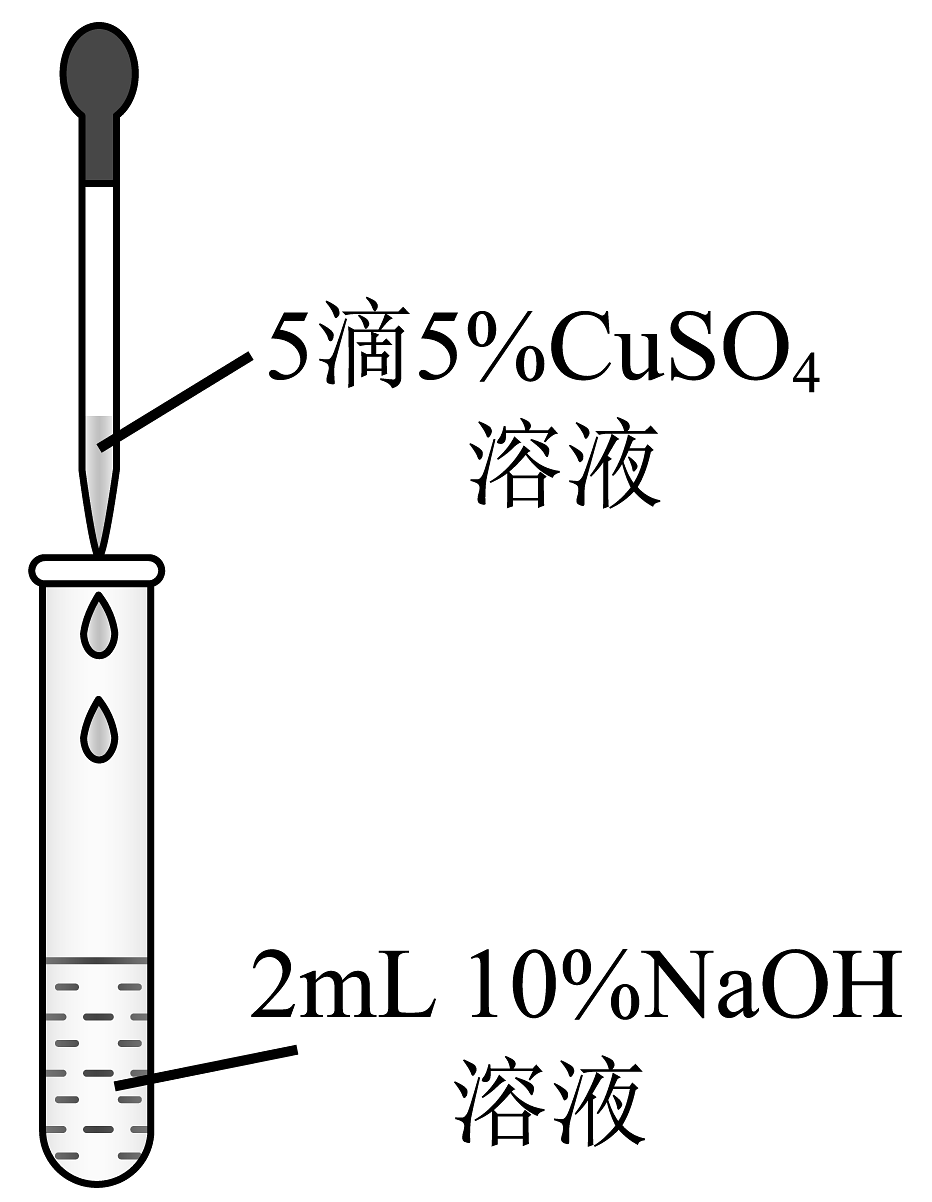
 A、A B、B C、C D、D
A、A B、B C、C D、D -
2、利用钛酸亚铁()制取金属钛的一种工艺如下图所示:

下列有关说法正确的是
A、高温时还原性: B、可以选用氮气代替氩气 C、用与溶液反应也能制得金属钛 D、氯化时每消耗碳单质就有电子转移 -
3、蔗糖与浓硫酸发生作用的过程如图所示。下列关于该过程的分析不正确的是
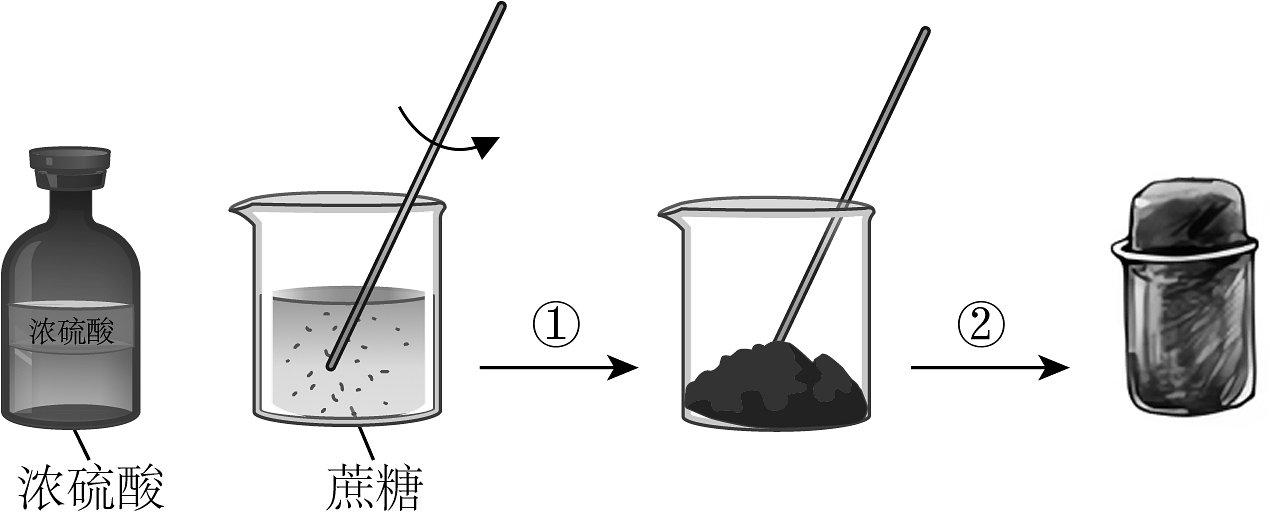 A、过程①白色固体变黑,体现了浓硫酸的脱水性 B、过程②固体体积膨胀,与产生的大量气体有关 C、过程中产生刺激性气体,体现了浓硫酸的酸性 D、反应后蔗糖分子中所有的化学键都发生了断裂
A、过程①白色固体变黑,体现了浓硫酸的脱水性 B、过程②固体体积膨胀,与产生的大量气体有关 C、过程中产生刺激性气体,体现了浓硫酸的酸性 D、反应后蔗糖分子中所有的化学键都发生了断裂 -
4、已知某反应的能量变化如图所示,下列说法不正确的是
 A、该反应可将热能转为化学能 B、不能利用该反应设计原电池 C、反应中断键吸收的总能量高于成键放出的总能量 D、该图可以表示和反应时的能量变化
A、该反应可将热能转为化学能 B、不能利用该反应设计原电池 C、反应中断键吸收的总能量高于成键放出的总能量 D、该图可以表示和反应时的能量变化 -
5、将铜丝插入浓硝酸中进行下图所示的实验,下列说法正确的是
 A、铜丝与浓硝酸接触后生成红棕色气体,说明酸性强 B、注水后b管内气体颜色变浅,说明气体中分子数减少 C、注水后b中铜片表面有气泡,说明与硝酸反应生成 D、装置c能用来吸收尾气,说明和均是酸性氧化物
A、铜丝与浓硝酸接触后生成红棕色气体,说明酸性强 B、注水后b管内气体颜色变浅,说明气体中分子数减少 C、注水后b中铜片表面有气泡,说明与硝酸反应生成 D、装置c能用来吸收尾气,说明和均是酸性氧化物 -
6、已知为阿伏加德罗常数的值。下列叙述正确的是A、异丁烷分子中共价键的数目为 B、的硫酸溶液中的数目为 C、标准状况下,中共含有个电子 D、锌锰干电池负极每少就转移个电子
-
7、如图所示装置工作时,下列有关说法正确的是
 A、电流表指针有偏转:说明该反应会放热 B、稀硫酸的作用:电极反应物和离子导体 C、电子流向:锌片→溶液→铜片→电流表 D、负极的电极反应:
A、电流表指针有偏转:说明该反应会放热 B、稀硫酸的作用:电极反应物和离子导体 C、电子流向:锌片→溶液→铜片→电流表 D、负极的电极反应: -
8、下列有关丙烯()的说法,错误的是A、每个分子比乙烯多3个共价键 B、能使酸性的高锰酸钾溶液褪色 C、完全燃烧的产物分子数比为 D、与溴水反应成
-
9、劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是
选项
劳动项目
化学知识
A
帮厨活动:在燃气灶上煎鸡蛋
加热能使蛋白质变性
B
科普行动:宣传化肥的合理施用
不同的化肥性质不同
C
工艺体验:以油脂为原料制肥皂
油脂促进维生素吸收
D
家务劳动:用卤水点豆浆制豆腐
胶体遇电解质会聚沉
A、A B、B C、C D、D -
10、实验室制氨装置如图所示。下列有关说法正确的是
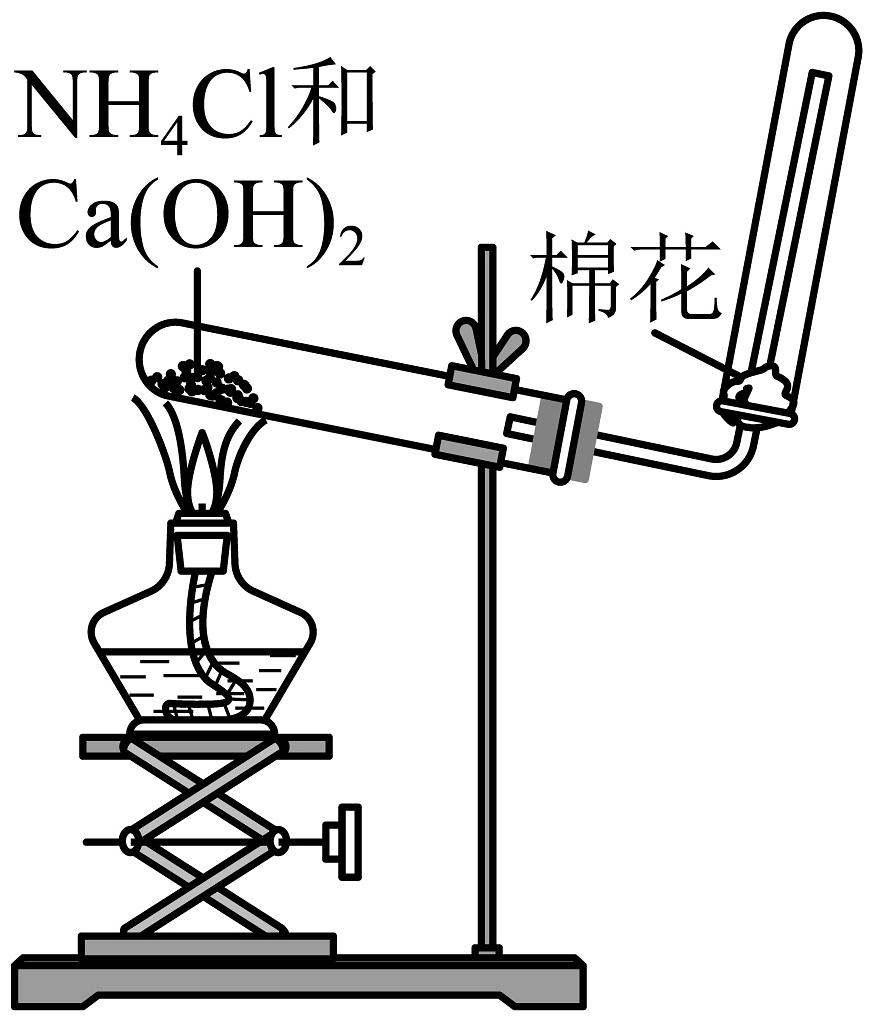 A、此实验能收集到纯净的氨气 B、用湿润的蓝色石蕊试纸验满 C、生成物的化学能高于反应物 D、反应后氮元素的化合价升高
A、此实验能收集到纯净的氨气 B、用湿润的蓝色石蕊试纸验满 C、生成物的化学能高于反应物 D、反应后氮元素的化合价升高 -
11、下列措施中,不能增大化学反应速率的是A、加热分解时,添加少量 B、与盐酸反应时,适当升高温度 C、进行合成反应时,增大气体压强 D、Zn与稀硫酸反应时,加入几滴蒸馏水
-
12、铜与浓硫酸反应装置如图所示。下列有关说法正确的是
 A、胶塞附近的气体呈红棕色 B、棉团中会有生成 C、品红因被氧化而褪色 D、要结束反应只能撤酒精灯
A、胶塞附近的气体呈红棕色 B、棉团中会有生成 C、品红因被氧化而褪色 D、要结束反应只能撤酒精灯 -
13、工业制备高纯硅的一种途径如下。下列有关说法正确的是
 A、中只含有非极性共价键 B、反应①为 C、反应②说明硅的非金属性较强 D、反应③中还原剂是和
A、中只含有非极性共价键 B、反应①为 C、反应②说明硅的非金属性较强 D、反应③中还原剂是和 -
14、科是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是A、制备医用同位素—元素锕的质量数为225 B、发现月壤中的嫦娥石[]—该成分属无机盐 C、利用合成脂肪酸-实现无机小分子向有机高分子的转变 D、研制高效率钙钛矿太阳能电池-其能量转化形式:太阳能→电能
-
15、化学与生活密切相关,下列说法正确的是A、维生素C用作食品的抗氧化剂是因其易被氧化 B、阿司匹林不宜长期大量服用是因其在水中微溶 C、苯甲酸钠可作为食品防腐剂是由于其含碳量高 D、人们需摄入纤维素因其在体内会水解成葡萄糖
-
16、“蛮腰绰约,立城郭之高标”。下述广州塔建造用材,属于硅酸盐材料的是A、制作塔柱外斜交网状外框筒的钢材 B、拼接高空观景厅外透明幕墙的玻璃 C、塔内电缆材料里的交联聚乙烯塑料 D、塔顶金属枪杆表面防腐涂层的锌粉
-
17、在生产、生活中金属腐蚀所带来的损失非常严重,下列有关金属腐蚀与防护的说法正确的是A、生铁浸泡在食盐水中会发生析氢腐蚀 B、钢铁发生吸氧腐蚀的正极的电极反应式为 C、在轮船的底部镶嵌不易腐蚀的铜块,可以提高船体的使用寿命,利用了牺牲阳极法 D、将钢铁闸门与电源正极相连的防腐措施属于外加电流法
-
18、下列离子方程式中,正确的是A、稀硫酸滴在铁片上: B、稀盐酸滴在石灰石上: C、稀硫酸与氢氧化钡溶液混合: D、铜片插入硝酸银溶液中:
-
19、非天然氨基酸是一种重要的药物中间体,其合成路线之一如下:
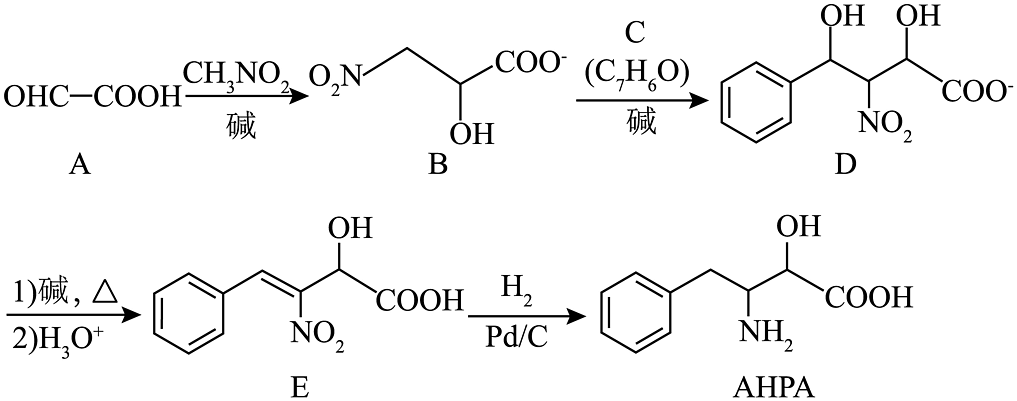 (1)、写出A含有的官能团的名称。(2)、原子利用率为 , C的结构简式为。(3)、E中碳原子的杂化方式有。(4)、根据的机构特征,分析其化学性质,完成下表
(1)、写出A含有的官能团的名称。(2)、原子利用率为 , C的结构简式为。(3)、E中碳原子的杂化方式有。(4)、根据的机构特征,分析其化学性质,完成下表反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
浓氢溴酸、加热
(5)、写出同时满足下列条件的的同分异构体的结构简式。①含苯环且苯环只有一个取代基;
②红外光谱显示含氧官能团只有和;
③核磁共振氢谱显示有6组峰,峰面积比为。
(6)、参照上述合成路线,设计以苯甲醛( )为主要原料制备
)为主要原料制备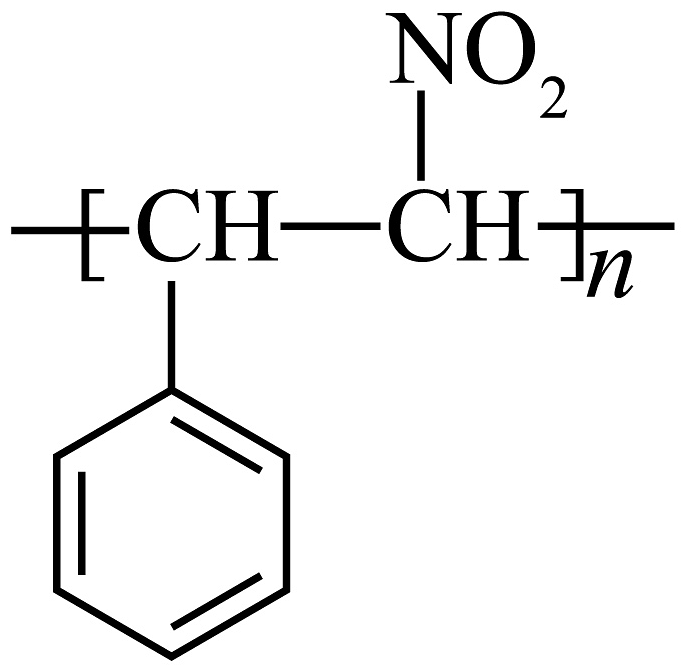 的合成路线(其他原料、试剂任选)。
的合成路线(其他原料、试剂任选)。 -
20、2030年全球新能源动力电池镍消费量将达到2020年全球镍产量的近。碱式碳酸镍在工业上可作为制备其他含镍化合物的原料。工业上由某含镍废渣精矿(主要成分为)为原料制备碱式碳酸镍的流程如下图所示。

已知:①时,相关离子开始沉淀和完全沉淀的如表所示。
离子
开始沉淀时的
6.4
2.2
4.4
完全沉淀时的
8.4
3.5
6.7
②时,。
回答下列问题:
(1)、滤渣I的主要成分为(填化学式)。(2)、“除杂1”时应利用加入的溶液凋节溶液的范围为。(3)、“除杂2时发生反应的离子方程式为 , 时,该反应的化学平衡常数为;实验测得此工序中加入的物质的量与“除杂1”所得溶液中的物质的量之比、反应温度对除杂2”所得滤渣中铜镍比的关系分别如左图和右图所示:
则最佳的加入的物质的量与“除杂1”所得溶液中的物质的量之比和反应温度分别为。
(4)、“萃取”和“反萃取”的最终目的是富集获得含有(填化学式)的水溶液。(5)、“沉镍”时应控制温度为 , 反应除生成外,还有一种无色气体生成,该气体为分子(填“极性”或“非极性”)。(6)、碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池充电的工作原理为:(M表示储氢金属或合金),该电池充电过程中阴极的电极反应式为。(7)、镍和砷可以形成多种化合物,红砷镍矿主要成分的晶胞结构如下图所示,该砷化镍的化学式为。