-
1、下列变化过程中一定不存在化学能转化为热能的




A.谷物酿酒
B.木材燃烧
C.干冰升华
D.鞭炮燃放
A、A B、B C、C D、D -
2、某学校小组探秘人体血液中的运载氧平衡及酸碱平衡,请回答下列问题:(1)、正常人体血液中主要含有和形成的缓冲体系,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
项目名称
结果浓度
参考范围
正常人
代谢性酸中毒病人
CO2分压/mmHg
40
50
35~45
c()/mmol·L+
24.2
19
23.3~24.8
血液酸碱度(pH)
7.40
7.21
7.35~7.45
用方程式表示人体血液中存在的化学平衡:。
(2)、人体酸碱平衡维持机制简要表达如下图:
①当人体摄入酸过多时,肺通过呼吸排出的CO2会(选填“增加”“不变”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法。
A.口服0.9%KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%NaHCO3溶液 D.静脉注射0.9%NaCl溶液
(3)、血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合。与氧气的结合度α(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压密切相关。①Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:Hb(aq)+H+(aq)⇌HbH+(aq)+O2(g)。37℃,pH分别为7.2、7.4、7.6时氧气分压与达到平衡时Hb与氧气的结合度α的关系如图所示,pH=7.6时对应的曲线为(填“A”或“B”)。
 (4)、Mb与氧气结合的反应如下:氧气分压与达平衡时Mb与氧气的结合度α的关系如图所示。
(4)、Mb与氧气结合的反应如下:氧气分压与达平衡时Mb与氧气的结合度α的关系如图所示。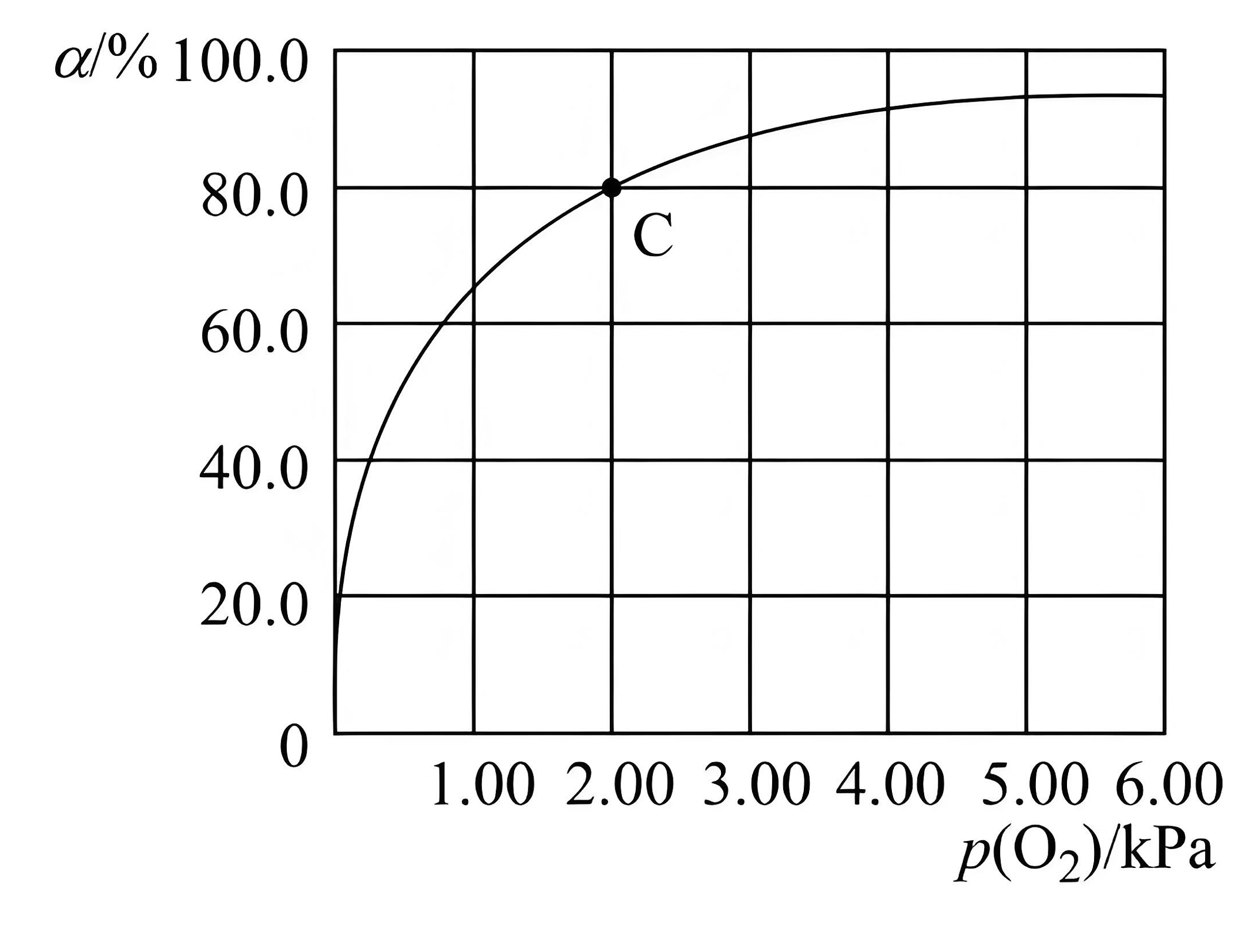
①经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH(填“>”、“<”或“=”)0。
②已知Mb与氧气结合的反应的平衡常数表达式计算37℃时K=kPa-1。
-
3、含氮化合物在现代工业、环境治理中有重要地位。请回答下列有关问题:(1)、用CH4催化还原氮氧化物可以消除氢氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
写出CH4(g)与反应生成N2(g)、CO2 (g)和H2O(l)的热化学方程式。
(2)、不同催化剂下合成氨反应的历程如下图,吸附在催化剂表面的物种用“*”表示。由图可知,使用催化剂A时,决速步骤的产物是。合成氨工业上采取了10-30个大气压,400-500℃的高温环境,请从速率或平衡的角度解释原因。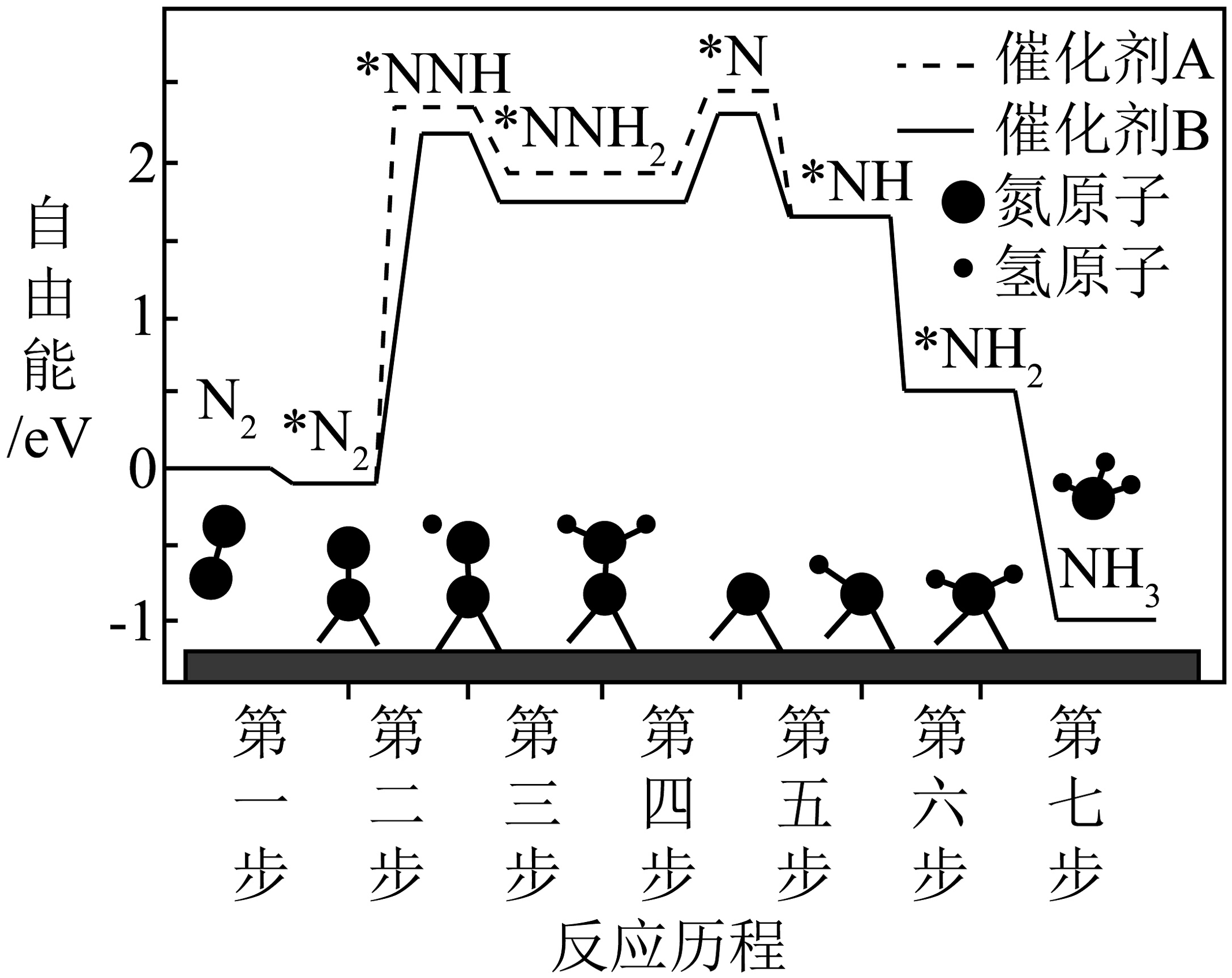 (3)、氨气是工业制取硝酸的重要原料,过程中有以下两个竞争反应I、II。
(3)、氨气是工业制取硝酸的重要原料,过程中有以下两个竞争反应I、II。反应I: ΔH1=-905.0kJ/mol
反应II: ΔH2=-1268kJ/mol
为分析某催化剂对该反应的选择性,将1molNH3和2molO2充入2L密闭容器中,在不同温度,相同时何下,测得有关物质的量关系如图所示。

①该催化剂在低温时对反应(填“I”或“II”)的选择性更好。
②520℃时,反应II:4NH3的平衡常数K= (只需列出有具体数字的计算式,不要求计算出结果)。
③高于840℃时,NO的产率降低的可能原因是。
A.NH3溶于水 B.反应活化能增大
C.反应I的平衡常数变小 D.催化剂活性降低
(4)、NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,请分析选择这个温度范围的原因是。 -
4、硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗硼的工艺流程:

已知:硼镁矿的主要成分为硼砂的化学式为
回答下列问题:
(1)、硼镁矿要粉碎处理,其目的是 , NaOH浓溶液与硼镁矿反应的化学方程式为(不考虑杂质参与反应)。(2)、请解释流程中生成无水需在HCl氛围中进行的原因。(3)、写出B2O5和Mg在高温下发生置换反应的化学方程式。(4)、已知为一元弱酸,其与NaOH反应的化学方程式为写出在水中的电离方程式:。(5)、实验测得一定质量的在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
①C对应的物质可表示为:则n=。
②写出C到D过程中发生反应的化学方程式:。
-
5、
乙二酸俗称草酸(H2C2O4),是一种二元弱酸,易溶于水,具有还原性。25℃时,H2C2O4的电离平衡常数
(1)H2C2O4中C元素的化合价是 , 写出NaHC2O4的电离方程式:。
I.石榴学习小组利用滴定法测定某KMnO4粗产品的纯度,实验步骤如下:
①称取m1gKMnO4粗产品,配成50mL溶液。
②称取m2gNa2C2O4 , 置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
③将锥形瓶中溶液加热到75~80℃,恒温,用①所配溶液滴定至终点,消耗①的溶液VmL。
(2)进行滴定时,①中所配溶液应盛装在(填仪器名称),滴定终点的现象是 , 依据学习小组实验步骤①②③的测定数据,粗产品中KMnO4的质量分数为(用含m1、m2、V的列式表示)。若滴定终点时俯视读数,则测量结果会(填“偏大”“偏小”或“不变”)。
Ⅱ.培桂化学实验小组探究草酸盐的性质。
(3)文献表明:相同条件下,的还原性强于Fe2+。为验证此结论,小组中周蕙斌同学完成了如下实验:向10mL0.5mol/LFeCl3溶液中缓慢加入(溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
已知:翠绿色晶体的成分为反应过程中发生如下反应:Fe3++3⇌[Fe(C2O4)3]3-K=1.6×1020
①冷松泽同学取少量翠绿色晶体,洗净,用蒸馏水配成溶液;滴加几滴KSCN溶液,不变红:滴入几滴浓硫酸,振荡后溶液变红。请从平衡移动角度分析溶液变红的原因:。
②李挟根同学检验出反应后的翠绿色溶液中无Fe2+ , 他推测(和未发生氧化还原反应。可能的原因是:。
-
6、铜一铁催化剂可催化分解转化为氢气,反应为。往体积为2L的密闭容器中加入4molNH3。图中曲线a、b分别表示在铜一铁催化剂I的作用下、T1时n(NH3)及T2时随时间的变化;曲线c表示在铜一铁催化剂Ⅱ的作用下,T1时n(N2)随时间的变化。以下说法正确的是
 A、T1>T2 B、T1时, C、其他条件不变,充入Ar,曲线b的平台下移 D、铜一铁催化剂II的催化效果更好
A、T1>T2 B、T1时, C、其他条件不变,充入Ar,曲线b的平台下移 D、铜一铁催化剂II的催化效果更好 -
7、已知:按起始投料比加入反应物,测得的平衡转化率(实线)和催化剂催化效率(虚线)受温度的影响如下图所示。下列说法不正确的是
 A、时,b点状态下Q>K B、生成乙烯的速率c点一定大于a点 C、d→e,催化效率降低是由于温度升高引起催化剂失活 D、a点乙烯的体积分数约为7.7%
A、时,b点状态下Q>K B、生成乙烯的速率c点一定大于a点 C、d→e,催化效率降低是由于温度升高引起催化剂失活 D、a点乙烯的体积分数约为7.7% -
8、将等物质的量的X、Y气体充入某密闭容器中,一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)=2Z(g) ΔH<0,改变某个条件达到新的平衡,表中关于新平衡与原平衡的比较一定正确的是
选项
改变的条件
新平衡与原平衡比较
A
升高温度
X的转化率变小
B
增大压强(压缩体积)
X的浓度变小
C
充入一定量的Y
Y的转化率增大
D
充入一定量的Z
Z的体积分数变小
A、A B、B C、C D、D -
9、下列实验方案、现象与结论正确的是
选项
实验方案
现象
结论
A
Na2O2用棉花包裹放在石棉网上,向棉花上滴几滴水
棉花燃烧
Na2O2与H2O的反应放热
B
常温下,测定等体积的盐酸和醋酸溶液的pH
醋酸溶液的pH大于盐酸
证明醋酸是弱电解质
C
将NO2和N2O4的混合气体通入密闭的注射器,压缩活塞
混合气体的颜色变浅
增大压强,化学平衡向气体体积缩小的方向移动
D
向2mLFeCl3溶液中滴加1mL等浓度的KI溶液,充分反应后,再滴加KSCN溶液,观察现象
溶液最终变为血红色
FeCl3溶液与KI溶液的反应为可逆反应
A、A B、B C、C D、D -
10、设NA为阿伏加德罗常数的值。下列说法中正确的是A、常温下,pH=12的NH3·H2O溶液中OH-数目为0.01NA B、标准状况下,2.24LH218O中所含电子数目为NA C、常温下,1LpH=4的H2SO4溶液中,由水电离出的H+数目为 D、0.1molH2 (g)和0.1molI2 (g)充入密闭容器中充分反应,转移的电子数为0.2NA
-
11、氨氧化法是工业制硝酸的重要途径,其中氨氧化过程如下图所示。下列说法错误的是
 A、Pt/CaTiO3能降低氨氧氮反应的△H B、该过程的总反应式中氧化剂和还原剂物质的量之比为5:4 C、硝酸工业的尾气可用碱液吸收法处理 D、O*和N*形成NO的过程中释放能量
A、Pt/CaTiO3能降低氨氧氮反应的△H B、该过程的总反应式中氧化剂和还原剂物质的量之比为5:4 C、硝酸工业的尾气可用碱液吸收法处理 D、O*和N*形成NO的过程中释放能量 -
12、可通过反应制备光电子功能材料ZnS。下列说法正确的是A、增大H2O(g)的量,平衡逆向移动 B、增大ZnO(s)的量,平衡正向移动 C、任何温度下该反应都能自发进行 D、使用催化剂,正反应速率加快,逆反应速率减慢
-
13、化学是一门以实验为基础的学科,下列定量实验的操作或方法正确的
选项
定量实验
实验操作或方法
A
滴定分析法
锥形瓶水洗后用待测液润洗
B
配制溶液
定容时加水超过刻度线,可用胶头滴管吸出超出的部分
C
反应热的测定
中和反应反应热的测定过程中,将量筒中NaOH溶液迅速倒入量热计的内筒与盐酸反应
D
反应速率的测定
测定Zn与稀硫酸反应生成H2的反应速率实验中,可将稀硫酸换成稀硝酸进行
A、A B、B C、C D、D -
14、已知电离常数反应(达到平衡后,要使HClO浓度增大,可加入A、Na2SO3固体 B、NaCl固体 C、NaHCO3固体 D、NaOH固体
-
15、合成氨工业中采用循环操作,主要是为了A、增加反应速率 B、降低氨的沸点 C、提高平衡体系中氨的含量 D、提高原料的利用率
-
16、化学反应中往往伴随着能量的变化,下列有关能量变化的描述正确的是A、灼热的碳与二氧化碳的反应是吸热反应。吸热反应均需要加热才能进行 B、酸碱中和、燃料的燃烧、浓硫酸的稀释等都是常见的放热反应 C、甲烷的标准燃烧热为-890.3kJ·mol·¹,则甲烷燃烧热的热化学方程式表示为:1-¹ D、从C(石墨,s)=C(金刚石,s) △H=+1.9kJ·mol-1 , 可知石墨比金刚石更稳定
-
17、以下食品添加剂的使用与调控反应速率有关的是A、柠檬黄——着色剂 B、味精——增味剂 C、小苏打—膨松剂 D、苯甲酸钠—防腐剂
-
18、“临行爆竹响空谷,青烟一缕千峰吼。”下列反应类型与诗句没有关联的是A、放热反应 B、复分解反应 C、氧化还原反应 D、熵增反应
-
19、“一碳化学”是以分子中只含一个碳原子的化合物 (如CO2、 CO、CH4等) 为原料来合成一系列化工原料和燃料的化学。回答下列问题:(1)、二氧化碳加氢制甲醇过程中的主要反应为(忽略其他副反应) :
△H1=+41.2kJ·mol-¹ K1
K2
K3
则△H3 , 平衡常数K3= (用K1、K2表示) ,反应③△S0(填“>”或“<”) ,反应②的浓度平衡常数表达式 K2=。
(2)、100 bar(1MPa=10 bar)时,将2mol CO2和6mol H2投入5L恒容密闭容器中进行上述反应。平衡时CO2的转化率、CO及CH3OH的选择性与温度的关系如图Ⅰ,使用活性镓镍催化剂时CH3OH的时空收率(CH3OH的时空收率表示在1mol催化剂表面生成CH3OH的平均速率) 与温度的关系如图Ⅱ:
①从反应开始到B 点用时t min, 则0-t min 时间内CO2的消耗速率为。
②下列说法正确的是(填标号) ;
a.H2的平衡转化率始终低于 CO2
b.温度越高,越有利于工业生产CH3OH
c.在一定温度范围内,为提高CH3OH的生成速率可加入选择性高的催化剂
d.在200℃-400℃范围内,温度升高,H2O的平衡产量一直增大
③图Ⅰ中在100℃-320℃范围内,CO2的平衡转化率随温度升高而降低的原因是;图Ⅱ中温度高于300℃时,CH3OH的时空收率迅速降低的原因可能是。
-
20、现有下列物质:① Ba(OH)2② BaCO3③蔗糖④ Na2S ⑥镁条⑦盐酸 ⑧KOH溶液⑨ HClO , 部分物质25℃时的电离平衡常数如下表:
Ka1
Ka2
H2C2O4
5.9×10-2
6.4×10-5
HClO
4.0×10-8
——
回答下列问题:
(1)、上述物质中是强电解质的有(填序号,下同) ,能导电的有。(2)、是二元弱酸,在水溶液中的电离方程式为。(3)、已知25℃时, 溶质为HClO和NaClO的混合溶液中 则溶液中 , 将 的HClO 溶液加水稀释 10 倍后溶液中氢离子的数目(填“增大”“减小”或“不变”,下同) ,氢离子的浓度 , 的值 , HClO的电离平衡常数。(4)、25℃, 101kPa时用⑦和⑩的稀溶液发生中和反应生成 时,放出的热量(填“>”、“<”或“=”) 57.3kJ, 理由是。