-
1、某研究性学习小组的同学通过实验探究浓度和温度对化学反应速率的影响。实验原理及方案为在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应: , 生成的碘可用淀粉溶液检验,根据出现蓝色所需时间来衡量该反应的速率。
实验编号
0.01 mol·L-¹ KIO3酸性溶液 (含淀粉) 的体积/mL
0.01 mol·L-¹ Na2SO3溶液的体积/mL
水的体积/mL
实验温度/℃
出现蓝色的时间/s
①
5
5
V1
5
t1
②
5
5
40
25
t2
③
5
V2
35
25
t3
④
5
15
30
25
t4
已知:IO3的氧化性随着酸性的增强而增强。
回答下列问题:
(1)、实验中V1= , V2= 。(2)、实验①、②、③中出现蓝色的时间t1、t2、t3由大到小的顺序是。(3)、实验①②是探究对化学反应速率的影响,实验②③是探究对化学反应速率的影响。(4)、该反应的过程和机理较复杂,一般认为发生以下四个反应:(反应速率慢), (反应速率快)
(反应速率较快), (反应速率快)
根据上述反应推测该反应总的反应速率由反应(填序号) 决定。从上述四个反应可以看出必须在(填离子符号)消耗完时才会有淀粉变蓝的现象产生。理论上实验④最终(填“能”或“不能”) 看到溶液显蓝色,判断理由是。
(5)、若将碘酸钾(KIO3)和亚硫酸氢钠溶液混合,也可发生反应生成碘,反应原理为 实验发现开始时反应缓慢,随后反应速率“急增”,最后又逐渐减慢,则关于该化学反应速率“急增”的原因的合理解释是。 -
2、羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在密闭容器中,加入等物质的量的CO与H2S发生反应: △H<0,达到平衡后,其他条件不变,分别改变下列条件,平衡移动情况和物理量变化情况如何变化? 请分别用“向正反应方向” “向逆反应方向” “不”分析判断平衡移动情况;用“增大” “减小” “不变”分析判断物理量变化情况:(1)、保持容器温度和体积不变,增加H2S的浓度,平衡移动; 加入少量 He,平衡移动。(2)、保持容器压强和温度不变,加入少量 He,平衡移动,H2S(g)的化学反应速率。(3)、保持容器体积不变,升高温度,平衡移动,平衡常数 K , 反应热△H。(4)、在一定温度下,增大压强(缩小容器体积) ,CO的转化率 , 容器内气体的平均相对分子质量 , 容器内气体的密度。(5)、保持容器温度和体积不变, 再加入2molCO和2molH2S, 平衡移动,H2(g)的化学反应速率 , 平衡后COS的体积分数。(6)、加入适量的正催化剂,逆反应速率 , 平衡移动。
-
3、已知在25℃、1.01×105Pa下, 1mol NH3生成H2(g)和N2(g)的能量变化如下图所示:

下列说法正确的是
A、甲为气态氨,乙为液态氨 B、甲、 乙、丙、丁中物质所具有的总能量大小关系:丙>丁>乙>甲 C、由图中数据可得出: D、形成1mol NH3(g)中的化学键需吸收 1172kJ的能量 -
4、在硫酸工业中,通过如下反应使SO2转化为SO3: , 在不同温度和压强下,反应达到平衡时SO2的转化率如下表所示。则:SO2发生催化氧化反应适宜的温度和压强分别是
温度/℃
不同压强下的转化率/%
0.1 MPa
0.5MPa
l MPa
5 MPa
10 MPa
450
97.5
98.9
99.2
99.6
99.7
550
85.6
92.9
94.9
97.7
98.3
A、450℃ 5 MPa B、550℃ 5MPa C、550℃ 10 MPa D、450℃ 0.1 MPa -
5、向绝热恒容密闭容器中通入CO(g) 和H2O(g), 在一定条件下发生反应: ,该反应的正反应速率随着时间变化的示意图如图所示。下列说法正确的是
 A、d点: v(正)>v(逆) B、该反应的△H >0 C、c点时CO的转化率最大 D、a、b、 c、d四点对应的压强: c>d>b>a
A、d点: v(正)>v(逆) B、该反应的△H >0 C、c点时CO的转化率最大 D、a、b、 c、d四点对应的压强: c>d>b>a -
6、下列装置不能达到对应实验目的的是


 A、探究浓度对化学平衡的影响[Fe3+(浅黄色)+3SCN- (无色)Fe(SCN)3(红色)] B、探究温度对碳酸氢钠和碳酸钠分解速率的影响 C、探究温度对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)] D、探究压强对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)]
A、探究浓度对化学平衡的影响[Fe3+(浅黄色)+3SCN- (无色)Fe(SCN)3(红色)] B、探究温度对碳酸氢钠和碳酸钠分解速率的影响 C、探究温度对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)] D、探究压强对化学平衡的影响[2NO2(g)(红棕色)N2O4(g)(无色)] -
7、已知H2与ICl的反应分两步完成:H2(g)+ICl(g)HCl(g)+HI(g) △H1<0, △H2<0,且△H1>△H2 下列图像最符合上述反应历程的是A、
 B、
B、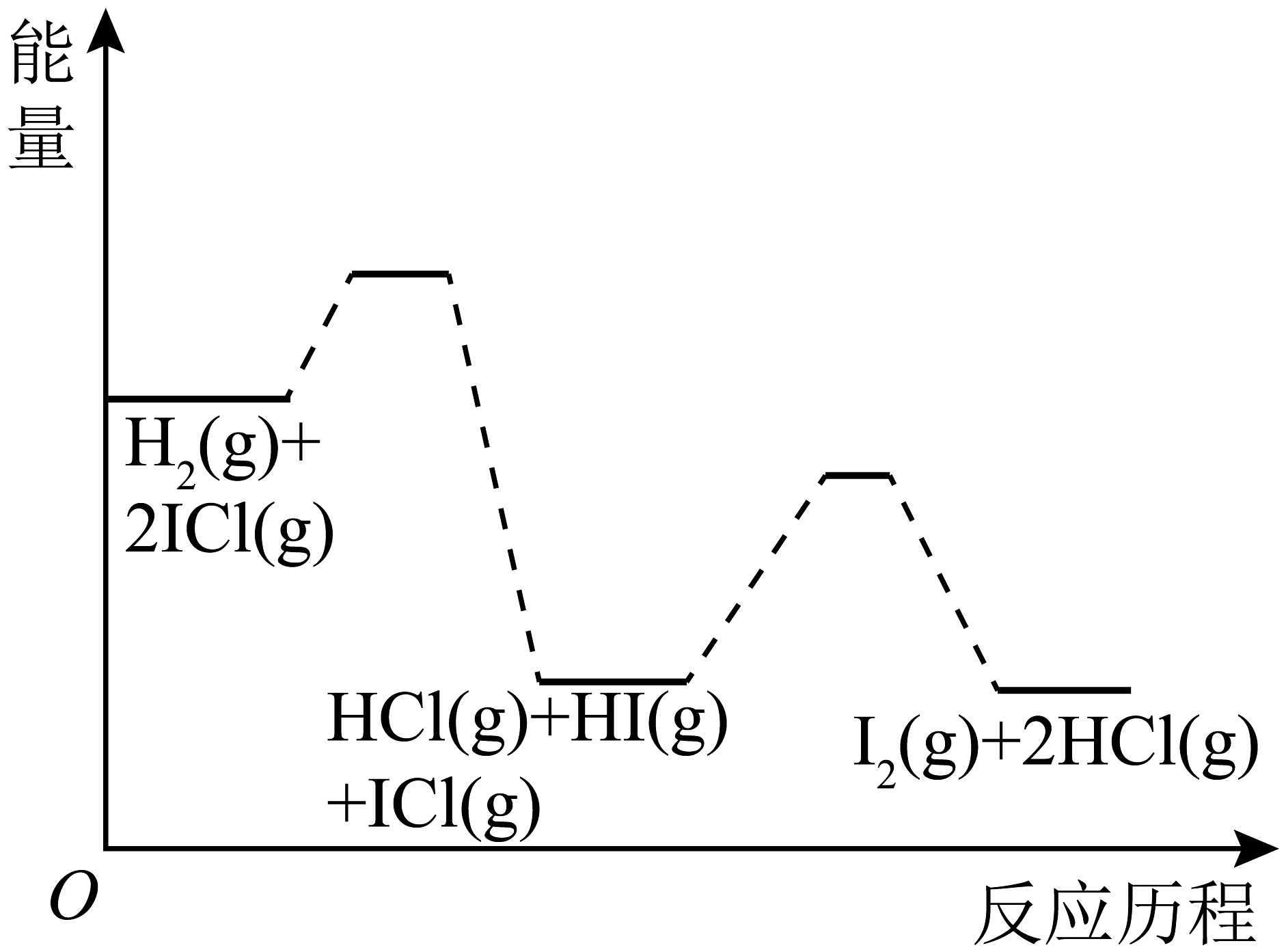 C、
C、 D、
D、
-
8、在SO2的饱和溶液中H2SO3达到电离平衡的标志是A、 B、溶液中无H2SO3分子 C、c(HSO3)不再变化 D、溶液中 共存
-
9、下列措施能增大氨水中NH3·H2O 电离程度的是A、加入NH4Cl固体 B、通入一定量的NH3 C、加入少量冰醋酸 D、加入少量NaOH固体
-
10、在一定温度下的恒容密闭容器中发生可逆反应: , 已知NH3(g)、O2(g)、NO(g)、H2O(g)的初始浓度分别为 当反应达到平衡时,各物质的浓度不可能为A、 B、 C、 D、
-
11、下列事实不能用平衡移动原理解释的是A、反应 达到化学平衡后,升高温度,体系的颜色变浅 B、新制氯水应放在阴暗低温处保存 C、合成氨的过程中及时分离出氨气 D、反应 达到化学平衡后,减小容器体积,体系的颜色加深
-
12、下列说法正确的是A、自发进行的反应均是熵增反应 B、蔗糖在水中溶解是一个自发过程 C、NaHCO3受热分解过程:△S<0 D、吸热反应一定不能自发进行
-
13、下列热化学方程式的反应热表示燃烧热的是A、 B、 C、 D、
-
14、如下图所示,下列有关化学反应能量变化的说法错误的是
 A、铁与盐酸反应的能量变化可用图1表示 B、图1 表示反应物的总键能小于生成物的总键能 C、图1、图2中化学反应的焓变 D、图2可以表示反应 的能量变化
A、铁与盐酸反应的能量变化可用图1表示 B、图1 表示反应物的总键能小于生成物的总键能 C、图1、图2中化学反应的焓变 D、图2可以表示反应 的能量变化 -
15、下列说法正确的是A、化学反应总是伴随着能量的变化 B、所有化学反应的反应热均可通过量热计直接测定 C、物质的内能与温度和压强无关 D、所有的分解反应都是吸热反应
-
16、下列仪器在中和热测定实验中不会用到的是A、温度计 B、玻璃搅拌器 C、秒表 D、量筒
-
17、在2 L恒容密闭容器中充入4 mol CO和4 mNO,发生反应2NO(g)+2CO(g)N2(g)+2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
 (1)、求C点NO的平衡转化率。(2)、若C点在10min达到平衡,求10min内CO的平均反应速率。(3)、若起始容器内压强为pPa,求C点时该反应的平衡常数Kp(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(1)、求C点NO的平衡转化率。(2)、若C点在10min达到平衡,求10min内CO的平均反应速率。(3)、若起始容器内压强为pPa,求C点时该反应的平衡常数Kp(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。 -
18、
CO2的资源化对于构建低碳社会具有重要意义。回答下列问题:
I.利用CO2催化加氢合成二甲醚
主要发生下列反应:
反应ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1=+41.2 kJ·mol-1
反应ⅱ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH2
(1)已知反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH3=-204.9 kJ·mol-1。则ΔH2=kJ·mol-1。Ⅱ.利用CO2制备CH3OH
(2)一定条件下,在容积为2 L的恒容密闭容器中充入1.5 mol CO2和3 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500 K的条件下,反应10 min后达到平衡。
①下列现象能说明反应达到平衡状态的是(填标号)。
a.单位时间内消耗n mol H2的同时消耗 n mol H2O
b.体系中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度相等
c.混合气体的平均摩尔质量不变
d.体系中混合气体密度不变
②该反应是(填“吸热”或“放热”)反应。500 K时,在0~10 min内平均反应速率v(H2)为。
③500 K下达到平衡时体系的总压强为p,该反应的平衡常数Kp=。(Kp为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
Ⅲ.高温电解CO2和H2O制备清洁燃料
(3)该技术的原理如图所示。电极a上的电极反应式是H2O+2e-=H2↑+O2-和。
-
19、回答下列问题:(1)、甲装置发生的化学反应方程式为。阴极收集到标况下2.24L气体时,阳极溶液质量减轻g。
 (2)、乙装置是一种家用环保型消毒液发生器,外接电源b为(填“正”或“负”)极,外接电源a连接的石墨电极的电极反应式为。
(2)、乙装置是一种家用环保型消毒液发生器,外接电源b为(填“正”或“负”)极,外接电源a连接的石墨电极的电极反应式为。 (3)、一氧化氮-空气质子交换膜燃料电池将化学能转化为电能。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和电镀的原理。
(3)、一氧化氮-空气质子交换膜燃料电池将化学能转化为电能。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和电镀的原理。
①燃料电池放电过程中负极的电极反应式。
②乙装置中物质A是(填化学式),若在标准状况下,甲装置有5.6L O2参加反应,则乙装置中通入的物质A的物质的量为mol。
③丙装置为铜表面镀银装置,电极D为 ,电镀一段时间后,溶液中AgNO3溶液浓度(填“变大”、“变小”或“不变”)。
(4)、“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将太阳能转化为电能(工作原理图1),除供给飞船使用外,多余部分用镉镍蓄电池储存起来。当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,镉镍蓄电池工作原理为Cd+2NiO(OH)+2H2OCd(OH)2 +2Ni(OH)2。
飞船在光照区运行时,N极链接镉镍蓄电池极(填“m”或“n”)。飞船运行到阴影区时,b室中发生的电极反应反应式为 。
-
20、某工业矿渣废料的主要成分为、和 , 还含有少量和。利用该矿渣废料制备高纯和回收含铁化合物的工业流程如图:

已知:i.当微粒浓度低于时,认为溶液中不存在该微粒;
ii.常温下;部分难溶物的溶度积常数如表:
难溶物
回答下列问题:
(1)、“滤渣Ⅱ”的主要成分为(填化学式)。(2)、“还原”过程中发生的主要氧化还原反应的离子方程式为、。(3)、“氧化”时需要少量、多次加入 , 其目的是。(4)、“调”时可选择的试剂为___________(填字母)。A、 B、 C、 D、(5)、常温下,若“调”后所得溶液中、 , 则所调的范围为。(6)、“沉锰”时发生反应的离子方程式为。(7)、若使用100 kg含87% MnO2的矿渣废料,最终获得101.2 kg MnCO3 , 则MnCO3产率为。