-
1、冶金废水(主要含)通过“电解-碳化”制备的装置如图所示。下列说法不正确的是
 A、M极上产生黄绿色气体 B、电解前后,N极区溶液的基本不变 C、电解总反应为: D、1通过阳离子交换膜时,理论上共产生44.8L的气体
A、M极上产生黄绿色气体 B、电解前后,N极区溶液的基本不变 C、电解总反应为: D、1通过阳离子交换膜时,理论上共产生44.8L的气体 -
2、阅读下列材料,完成下列3个小题。
碳族元素及其化合物在自然界广泛存在且具有重要应用。甲烷是清洁能源,燃烧热大(890.3),完全燃烧生成 , 催化加氢可制;是一种杀菌剂;电解还原可制得半导体材料晶体 , 四氯化锗()水解可得到;醋酸铅[]易溶于水,难电离,醋酸铅溶液可用于吸收气体。
(1)、下列说法正确的是A、晶体属于分子晶体 B、1中含有σ键数为3 C、的空间构型为平面正方形 D、中的C原子和中的原子杂化方式相同(2)、下列化学反应表示正确的是A、甲烷的燃烧: B、电解还原制高纯的阴极反应: C、水解制: D、醋酸铅溶液吸收气体:(3)、下列有关反应的说法正确的是A、反应的 B、反应的平衡常数表达式 C、反应的(表示键能) D、反应在高温、高压和催化剂条件下进行可提高H2的平衡转化率 -
3、光卤石[]可作为提取金属镁的矿物原料。下列说法正确的是A、原子半径: B、第一电离能: C、沸点: D、碱性:
-
4、实验室称量一定质量的固体,并用于测定盐酸的浓度。下列相关原理、装置及操作不正确的是
 A、称量 B、溶解 C、加指示剂 D、滴定
A、称量 B、溶解 C、加指示剂 D、滴定 -
5、反应可实现工业副产品资源再利用。下列说法正确的是A、O元素位于周期表ⅥA族 B、电子式为
 C、基态的电子排布式为
D、中既含极性键又含非极性键
C、基态的电子排布式为
D、中既含极性键又含非极性键
-
6、下列用于水处理的物质,主要成分属于有机物的是A、活性炭 B、聚丙烯滤膜 C、明矾 D、二氧化氯
-
7、由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
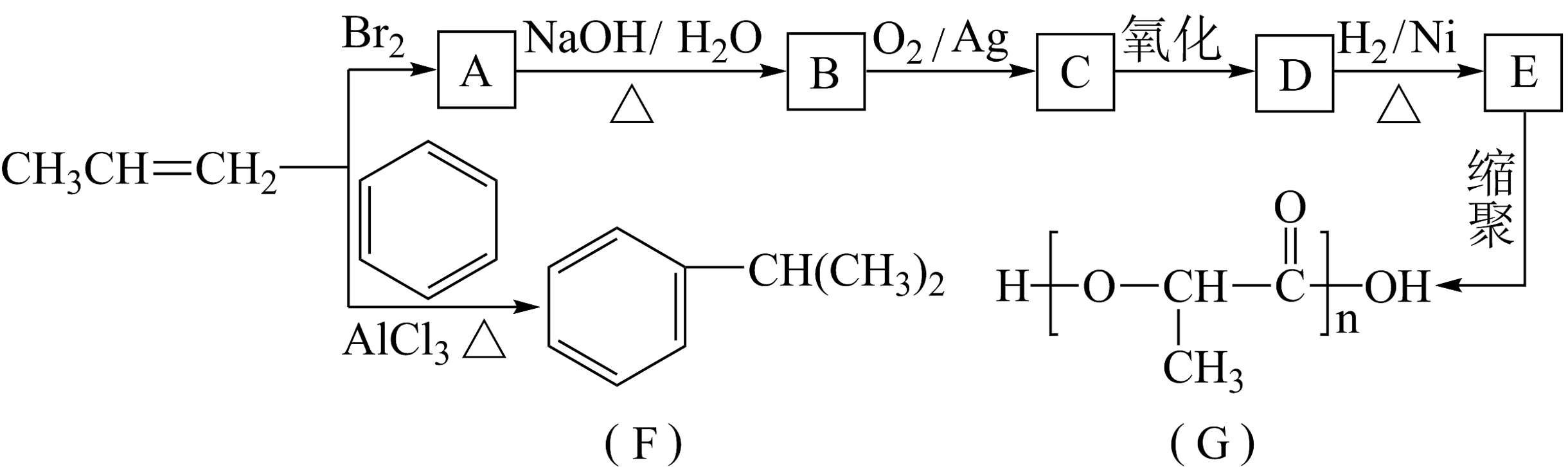 (1)、C中含氧官能团的名称是。(2)、生成F的反应类型:。(3)、B转化为C的化学方程式为。(4)、F的芳香同分异构体有种,其中核磁共振氢谱中显示峰面积比为3:1的同分异构体的结构简式为。(5)、写出由
(1)、C中含氧官能团的名称是。(2)、生成F的反应类型:。(3)、B转化为C的化学方程式为。(4)、F的芳香同分异构体有种,其中核磁共振氢谱中显示峰面积比为3:1的同分异构体的结构简式为。(5)、写出由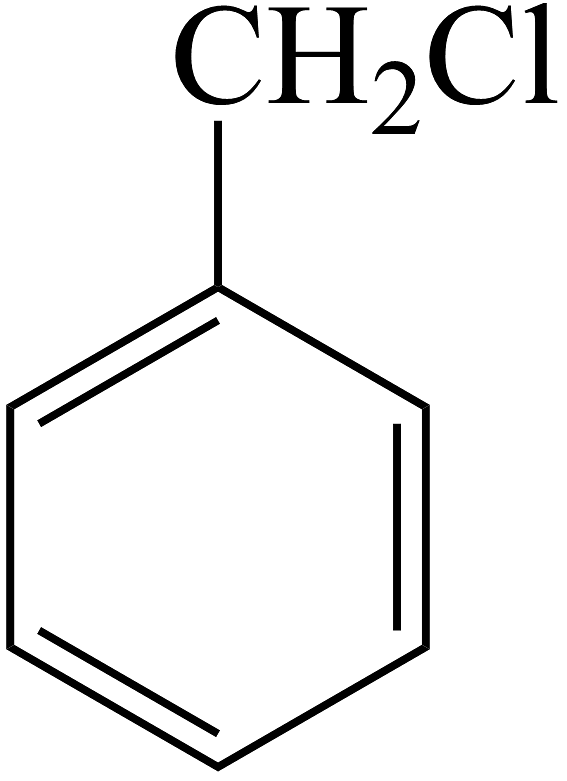 合成
合成 (合成路线常用表示方法为)。
(合成路线常用表示方法为)。 -
8、铬(Cr)、锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:(1)、基态铬原子的价层电子排布式为。(2)、含铬化合物CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为析。
A.
 B.
B. C.
C. (3)、已知金属锰有多种晶型,型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原子数为。
(3)、已知金属锰有多种晶型,型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原子数为。A.
 B.
B. C.
C. D.
D. (4)、[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2 , DMSO中硫原子的杂化轨道类型为 , ClO的空间构型是。(5)、①NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为1,1,1),则C的离子坐标参数为。
(4)、[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2 , DMSO中硫原子的杂化轨道类型为 , ClO的空间构型是。(5)、①NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为1,1,1),则C的离子坐标参数为。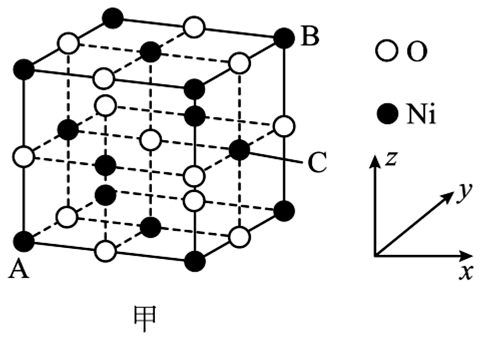
②一定温度下,NiO可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列(O2-之间相切),Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA , 每平方米面积上具有该单分子层的质量为g(用含a、NA的代数式表示)。

-
9、有机物a是一种重要的化工原料,其分子式为C5H10 , 结构简式为(H3C)2C=CH—CH3 , 有机物a在一定条件下能发生如图所示的反应,其中b为高分子化合物。

已知:
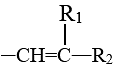 —COOH+
—COOH+ (R1、R2为烃类基团)(1)、a的名称是。(2)、b的结构简式为。(3)、下列关于b的说法正确的是(填标号)。
(R1、R2为烃类基团)(1)、a的名称是。(2)、b的结构简式为。(3)、下列关于b的说法正确的是(填标号)。A.为混合物 B.能使酸性高锰酸钾溶液褪色 C.0.1molb完全燃烧可消耗7.5molO2
(4)、a→d的反应类型为。(5)、有机物a与酸性高锰酸钾溶液反应的有机产物除了H3C-CO-CH3 , 还有。(6)、a的一种同分异构体具有顺反异构,写出其顺式结构:。(7)、已知不对称烯烃加成时氢原子首先加到碳碳双键上含氢较多的碳上:根据信息写出a→c的化学方程式:。 -
10、某届奥运会上,有个别运动员因服用兴奋剂被取消参赛资格。如图是检测出兴奋剂的某种同系物X的结构,下列关于X的说法正确的是
 A、1molX与NaOH溶液反应最多消耗4molNaOH B、X能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键 C、1molX与足量的饱和溴水反应,最多消耗4molBr2 D、1molX与足量H2反应最多消耗6molH2
A、1molX与NaOH溶液反应最多消耗4molNaOH B、X能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键 C、1molX与足量的饱和溴水反应,最多消耗4molBr2 D、1molX与足量H2反应最多消耗6molH2 -
11、环辛四烯
 、立方烷
、立方烷 、苯乙烯
、苯乙烯 分子式均为C8H8 , 下列对这三种化合物的叙述中正确的是 A、环辛四烯的七氯代物有2种 B、苯乙烯最多能与1molH2发生加成反应 C、三者均属于不饱和烃 D、苯乙烯中的所有碳原子可能共平面
分子式均为C8H8 , 下列对这三种化合物的叙述中正确的是 A、环辛四烯的七氯代物有2种 B、苯乙烯最多能与1molH2发生加成反应 C、三者均属于不饱和烃 D、苯乙烯中的所有碳原子可能共平面 -
12、下列实验操作、现象、结论均正确的是
实验操作
现象
结论或目的
A
向等体积乙醇与水中分别加入等质量金属钠
都产生具有可燃性的气体
乙醇中羟基H原子与水中H原子的活性一样
B
将光亮的铜丝在酒精灯火焰上加热,立即伸入无水乙醇中
铜丝先变黑后恢复成原来的颜色
乙醇被氧化,铜作氧化剂
C
常温下,将二氧化碳通入苯酚钠溶液
溶液变浑浊
制得苯酚,同时生成碳酸氢钠
D
将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液
产生淡黄色沉淀
检验溴乙烷中的溴元素
A、A B、B C、C D、D -
13、绥阳金银花是贵州特产之一,有抗菌、解热、增强免疫等功效,其所含咖啡酰奎尼酸结构如图所示。下列说法正确的是
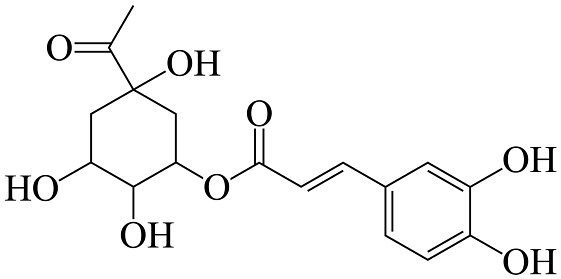 A、分子中所有碳原子有可能在同一平面内 B、1mol该有机物最多与3molNa反应 C、分子中碳原子的杂化类型有sp、sp2、sp3三种 D、该有机物遇氯化铁溶液会发生显色反应,有四个手性碳原子
A、分子中所有碳原子有可能在同一平面内 B、1mol该有机物最多与3molNa反应 C、分子中碳原子的杂化类型有sp、sp2、sp3三种 D、该有机物遇氯化铁溶液会发生显色反应,有四个手性碳原子 -
14、如图为几种晶体或晶胞的结构示意图,下列说法错误的是

 A、晶胞A的化学式是LaNi4 B、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 C、碘单质是分子晶体,碘单质在CCl4中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:金刚石>MgO>碘单质
A、晶胞A的化学式是LaNi4 B、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 C、碘单质是分子晶体,碘单质在CCl4中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:金刚石>MgO>碘单质 -
15、下列实验装置可以达到实验目的的是


A.用酒精萃取碘水中的碘
B.除去乙烷中的乙烯杂质得到纯净的乙烷
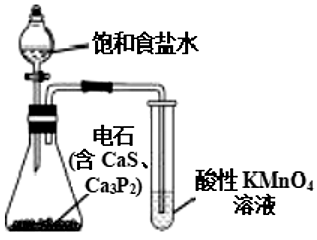

C.验证乙炔具有还原性
D.实验室制硝基苯
A、A B、B C、C D、D -
16、有机物X为合成光刻胶的一种中间体,其结构简式如图所示。下列有关说法中正确的是
 A、分子式为 B、1mol该物质中含有4mol碳碳双键 C、在一定条件下该物质能合成有机高分子化合物 D、该物质能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
A、分子式为 B、1mol该物质中含有4mol碳碳双键 C、在一定条件下该物质能合成有机高分子化合物 D、该物质能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 -
17、维生素C是一种很好的抗氧化剂,适当的补充维生素C可增加中性粒细胞的趋化性和变形能力,提高白细胞的杀菌能力,其分子的结构简式如图所示。下列关于维生素C的叙述错误的是
 A、属于烃的衍生物 B、分子中含有3种官能团 C、1mol该物质最多能与2molBr2加成 D、该物质能使酸性KMnO4溶液褪色
A、属于烃的衍生物 B、分子中含有3种官能团 C、1mol该物质最多能与2molBr2加成 D、该物质能使酸性KMnO4溶液褪色 -
18、下列有机物命名正确的是A、3,3-二甲基-2-乙基戊烷 B、3,3-二甲基戊烷 C、2-甲基-3-丁烯 D、1,5-二甲苯
-
19、吸湿性强,常被用作气体和液体的干燥剂,它甚至可以使硝酸脱水:。下列说法正确的是A、第一电离能:N<P B、电负性:N<P C、离子半径: D、沸点:
-
20、我国力争2030年前实现碳达峰,2060年前实现碳中和,这体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的 , 下列有关化学用语表示正确的是A、的分子结构模型:
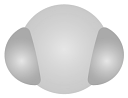 B、键电子云轮廓图
B、键电子云轮廓图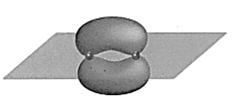 C、的电子式:
C、的电子式: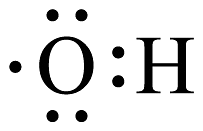 D、的电子排布式:
D、的电子排布式: