相关试卷
-
1、我国芯片蚀刻技术国际领先。利用NF3蚀刻硅芯片时的产物均为气体,在蚀刻物表面不留任何残留物,该反应的微观示意图如图所示,下列说法正确的是
 A、丁为N2 , 空气中丁的质量分数约为78% B、丙分子中的Si、F原子质量比为1:4 C、参加反应的甲和乙的微观粒子个数比为1:1 D、反应前后原子种类不变
A、丁为N2 , 空气中丁的质量分数约为78% B、丙分子中的Si、F原子质量比为1:4 C、参加反应的甲和乙的微观粒子个数比为1:1 D、反应前后原子种类不变 -
2、热爱劳动是中华民族的传统美德。下列劳动项目与所述化学知识没有直接关联的是
选项
劳动项目
化学知识
A
帮厨活动:炖汤时用网袋装着汤料
利用了过滤原理
B
学校清洁:用酒精对桌椅进行消毒
酒精可燃烧
C
家务劳动:用白醋清洗壶中的水垢
白醋可与水垢反应
D
学农活动:在酸性土壤中撒熟石灰
酸碱中和
A、A B、B C、C D、D -
3、《神农本草经》中记载荷叶有清暑化湿的功效。荷叶中含有荷叶碱 , 下列关于荷叶碱的说法正确的是A、氢元素的质量分数最小 B、含有43个原子 C、碳、氧原子的个数比为19:1 D、由四种元素组成
-
4、我国科研工作者开发出一种全新的高活性产氢催化剂“铂——氮化钼”。钼在元素周期表中的信息如图所示,下列说法不正确的是
 A、钼的原子序数为42 B、钼的相对原子质量为95.95 C、MoN中钼的化合价为-3 D、钼原子核内质子数为42
A、钼的原子序数为42 B、钼的相对原子质量为95.95 C、MoN中钼的化合价为-3 D、钼原子核内质子数为42 -
5、下列关于实验室制取CO2的操作、试剂和装置选择不合理的是


A.选择试剂
B.取用固体试剂
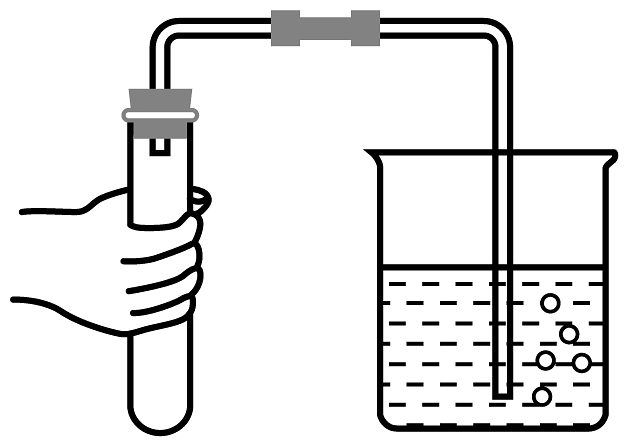

C.检查装置的气密性
D.取用液体试剂
A、A B、B C、C D、D -
6、阅读以下材料,完成下面小题。
我国神舟十八号航天员吃到了自己在“太空菜园”种的太空蔬菜,无土栽培技术是太空种菜的主要方式。
(1)、无土栽培需要将浓的营养液稀释数倍后再施用,稀释操作过程中不需要用到的仪器是A、烧杯 B、量筒 C、酒精灯 D、玻璃棒(2)、下列关于营养液中硝酸铵(NH4NO3)的说法正确的是A、可以促进蔬菜茎叶生长 B、可以增强蔬菜的抗寒抗旱能力 C、可以增强蔬菜的抗病虫害能力 D、属于复合肥(3)、下列关于太空蔬菜的说法正确的是A、太空蔬菜可以为航天员补充维生素 B、太空蔬菜生长只需营养液 C、太空蔬菜有辐射,不能食用 D、太空蔬菜光合作用属于物理变化 -
7、“珍爱生命,保障安全,守护健康”是人类永恒的主题。下列做法正确的是A、为延长食品的保质期,生产中添加过量的防腐剂 B、为避免浪费,发霉的大米经高温煮熟后再食用 C、发现厨房内天然气泄漏,立即打开抽油烟机排气 D、发生轻度煤气中毒,立即将患者转移到通风的地方
-
8、化学用语是学习和研究化学的基础。下列化学用语表达正确的是A、两个硫酸根离子: B、三个氧原子: C、四个二氧化氮分子: D、五个水分子:
-
9、“化学史给人以智慧”,下列化学史不符合事实的是A、门捷列夫编制出元素周期表 B、侯德榜最早发现并使用石蕊 C、张青莲主持测定铟元素的相对原子质量新值 D、徐光宪提出稀土分离技术
-
10、“垃圾是放错位置的资源”,废旧书籍应投入的垃圾箱是A、
 B、
B、 C、
C、 D、
D、
-
11、我国很多珍贵文物都记载着中华文明的灿烂成就。下列文物用到金属材料的是


A.瓷罐
B.铜奔马


C.玉如意
D.山水画卷
A、A B、B C、C D、D -
12、学习小组的同学想测定一瓶失去标签的稀盐酸中溶质的质量分数,取大理石样品25g,逐渐缓慢向其中加入150g待测稀盐酸(杂质难溶于水,且不与酸反应),测得剩余固体的质量与加入稀盐酸的质量关系如图所示。请完成下列分析与计算:
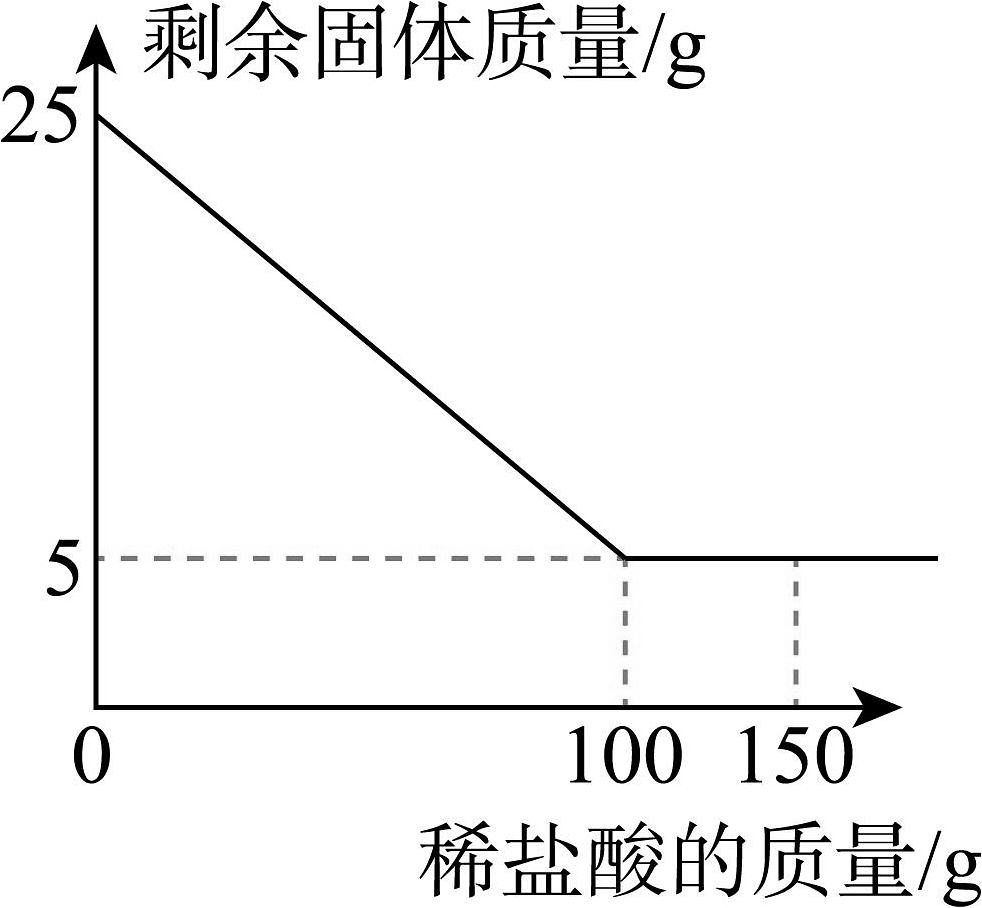 (1)、该大理石中的质量为g。(2)、计算该稀盐酸中溶质的质量分数。
(1)、该大理石中的质量为g。(2)、计算该稀盐酸中溶质的质量分数。 -
13、
酸在生产生活中有广泛应用,学习酸的性质是一项重要的内容。我校九年级化学兴趣小组以“探究硫酸的性质”为主题开展项目式学习。请回答下列问题。

任务一:浓硫酸稀释过程中的能量变化。
(1)图1实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水(填“吸热”或“放热”)。
任务二:硫酸的浓度对硫酸化学性质的影响。
图II实验中,观察到滤纸B很快变黑,由此可知硫酸的浓度不同,硫酸的腐蚀性不同。
任务三:稀硫酸的化学性质。
小组同学按图III进行实验。向试管1中加入一定量的稀硫酸,锌粒表面有气泡冒出。
(2)向试管2中加稀硫酸后可观察到的现象是。
(3)该小组同学利用数字化传感器测得向试管3中不断滴加稀硫酸时溶液pH随时间的变化图像如图所示,图中a点所示溶液中含有的溶质是(填化学式)。
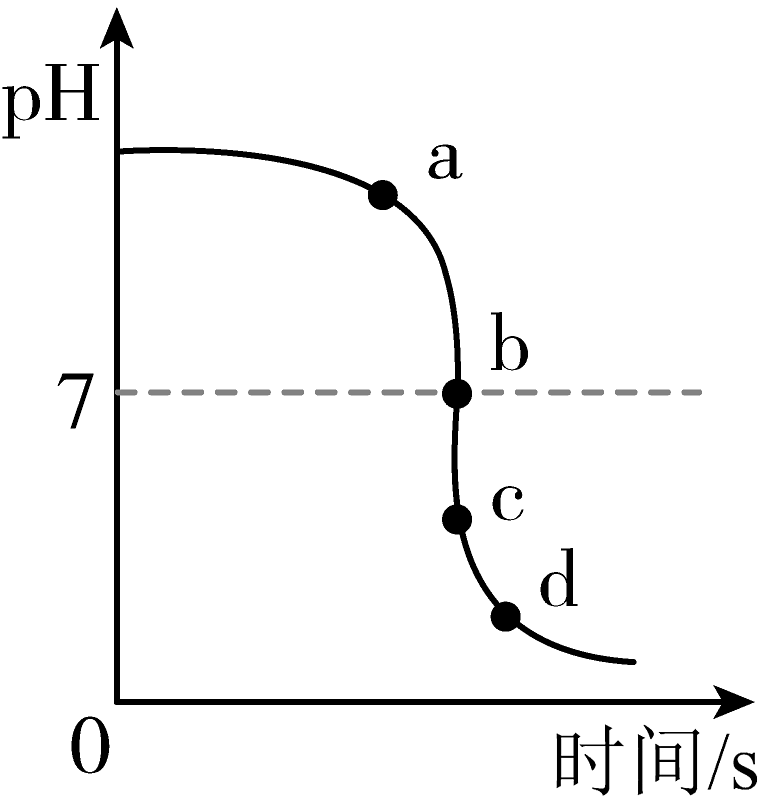
小组同学向试管4中滴加一定量稀硫酸后,对反应后的溶质成分产生了兴趣,他们继续进行实验。
【提出问题】
(4)试管4中反应后的溶液中溶质成分。
猜想一:可能是;猜想二:可能是;猜想三:可能是、K2CO3
【实验与结论】
(5)甲同学取少量反应后试管4中的溶液于另一试管中,向其中滴加溶液,观察到有白色沉淀产生,他认为猜想三正确。乙同学认为有白色沉淀产生不能证明猜想三成立,因此乙同学重新设计了合理的实验方案来证明猜想三正确、该实验方案为:。
任务四:废液回收处理。
(6)实验结束后在老师指导下,同学们将四支试管中的液体倒入废液缸。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,应向该废液中加入适量的(填物质名称),处理后再排放。
-
14、完成下列小题:(1)、氧气的实验室制取与性质
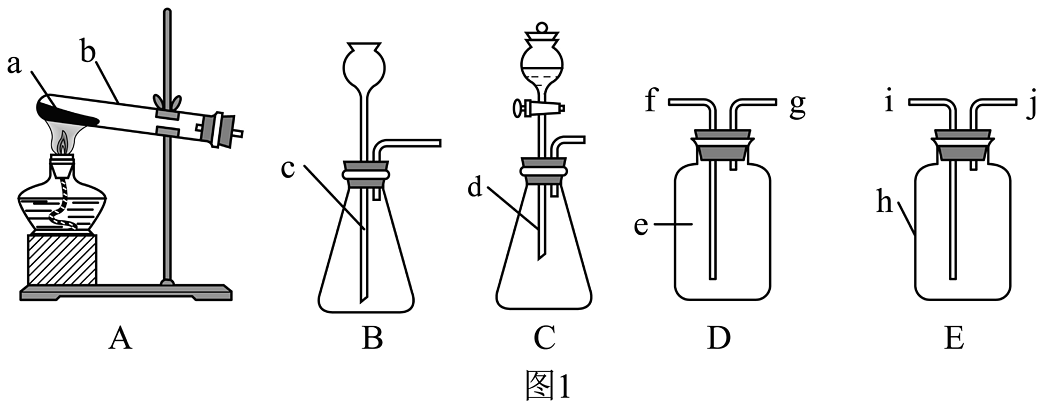
Ⅰ.仪器b的名称是。
Ⅱ.若用高锰酸钾制取氧气,应选择的发生装置是(填大写字母序号)。
Ⅲ.用装置D收集氧气,进气口为(填“f”或“g”)。
(2)、常见金属的物理性质和化学性质操作
实验现象
解释与结论
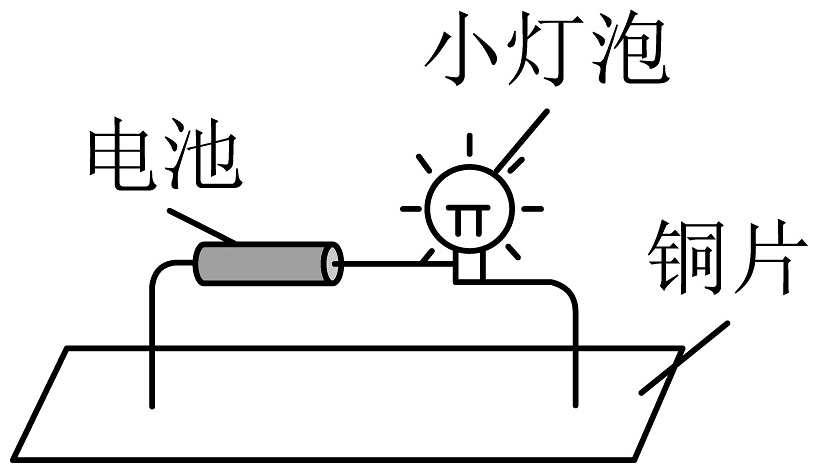
铜片具有导电性
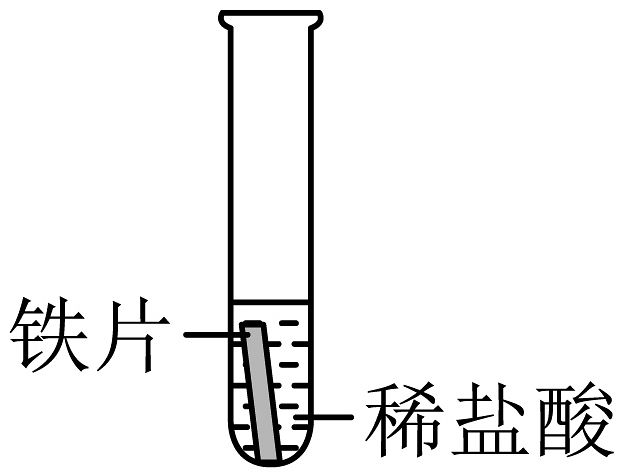
固体逐渐溶解,有气泡产生,溶液由无色变为浅绿色
铁的金属活动性比铜强
-
15、我国是世界上锌冶炼最早的国家,明代宋应星所著的《天工开物》中有关于“火法”炼锌的工艺记载是:“每炉甘石(主要成分是碳酸锌)十斤,装载入一泥罐内……然后逐层用煤炭饼(反应后生成一氧化碳)垫盛,其底铺薪,发火缎红……冷定毁罐取出……即倭铅(锌)也。”该工艺过程分解模拟如图,请结合图文信息回答问题:
 (1)、装入原料器之前,将炉甘石敲碎的目的是。(2)、高温炉中,炉甘石与煤中的C反应,该反应类型为。(3)、湿法冶金利用置换反应。向混合液中加入Fe粉,充分反应后过滤。若取出的滤渣滴加稀盐酸有气泡产生,则滤液中含有的金属阳离子是。
(1)、装入原料器之前,将炉甘石敲碎的目的是。(2)、高温炉中,炉甘石与煤中的C反应,该反应类型为。(3)、湿法冶金利用置换反应。向混合液中加入Fe粉,充分反应后过滤。若取出的滤渣滴加稀盐酸有气泡产生,则滤液中含有的金属阳离子是。 -
16、认真阅读下列材料,回答相关问题。
豆腐,作为一种营养丰富、口感细腻的传统食品,在中国乃至世界的饮食文化中都占据着重要地位。黄豆是制作豆腐的主要原料,其主要营养成分的含量(每100g)如表。
糖类/g
蛋白质/g
油脂/g
水/g
37.3
33.1
15.9
9.2
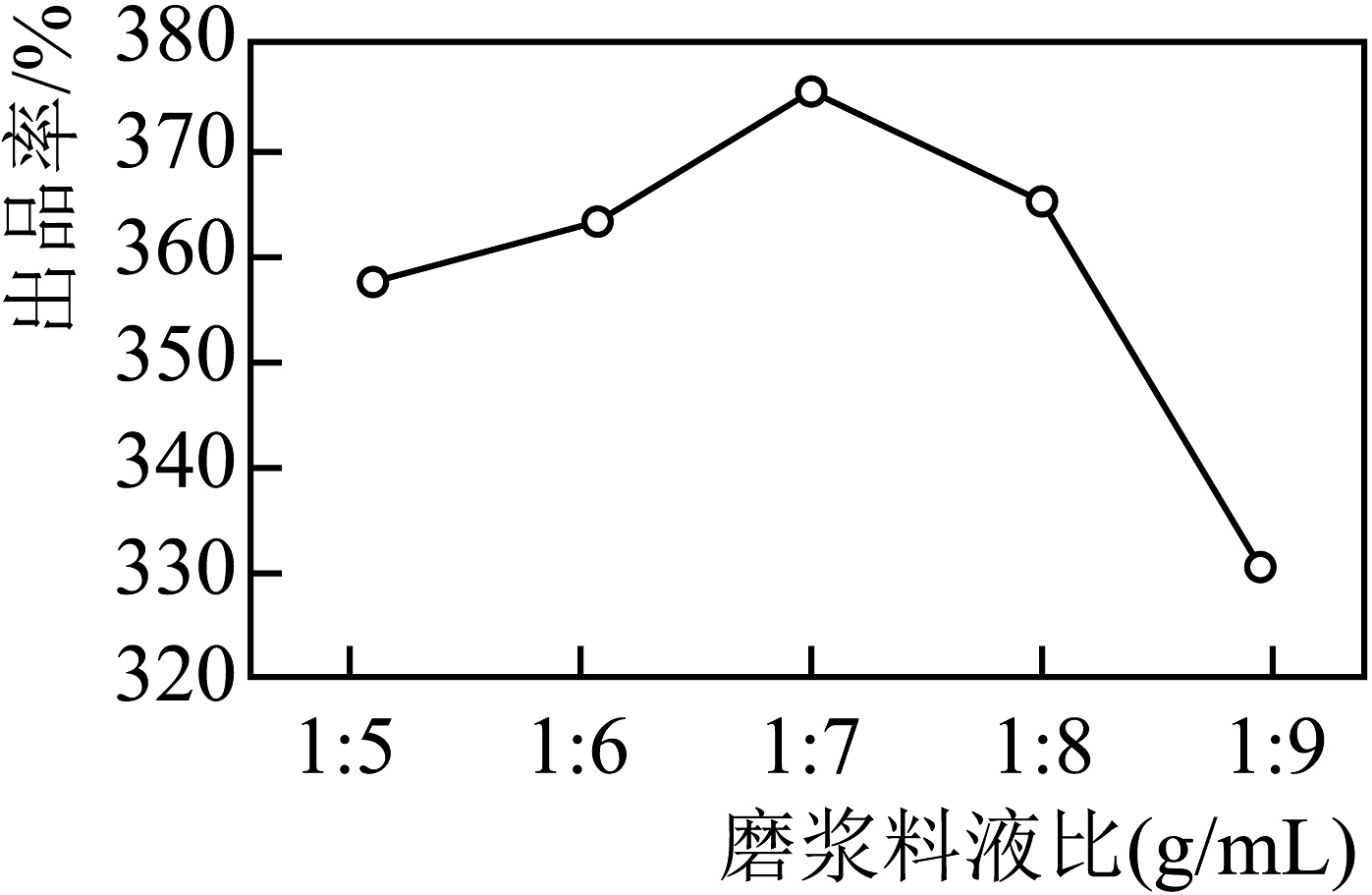
制作过程中,磨浆料液比(即黄豆与水的质量比)对豆腐出品率的影响如下图。
豆腐制作过程中的关键环节之一为凝固。常见凝固方法有石膏凝固法、卤水凝固法、葡萄糖酸内酯凝固法。卤水凝固法中凝固剂与黄豆的质量百分比对豆腐出品率的影响如表。
序号
凝固剂与黄豆的质量百分比
豆腐出品率
1
2
3
豆腐属于高蛋白食物,过量食用可能会导致消化不良,从而出现腹胀、腹泻等不良反应。且豆腐中的嘌呤含量也较多,嘌呤代谢异常的人群不宜多吃,过量食用可能会加重原病情。
(1)、黄豆营养成分中含量最高的是。(2)、常见豆腐凝固方法有(写出一种即可)。(3)、依据表2数据,能否得出“凝固剂种类等其他条件相同时,凝固剂与黄豆质量百分比越大,豆腐出品率越高”的结论?请判断并说明理由:。 -
17、下图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
 (1)、A点的含义是。(2)、在时,向30克甲物质中加入50克水,充分溶解后所得溶液是(填“饱和”或“不饱和”)溶液。(3)、若乙中混有少量甲,最好采用(填“降温结晶”或“蒸发结晶”)的方法提纯乙。
(1)、A点的含义是。(2)、在时,向30克甲物质中加入50克水,充分溶解后所得溶液是(填“饱和”或“不饱和”)溶液。(3)、若乙中混有少量甲,最好采用(填“降温结晶”或“蒸发结晶”)的方法提纯乙。 -
18、写出下列反应的化学方程式。(1)、目前,人类利用的能量大多来自化石燃料。在有石油的地方,一般都有天然气存在,天然气的主要成分是甲烷,请写出甲烷燃烧的化学方程式。(2)、《淮南万毕术》记载“曾青(硫酸铜溶液)得铁则化为铜”的湿法炼铜工艺,反应的化学方程式为。
-
19、鉴别、分离、检验、除杂是基本的实验方法。下列实验设计中,能达到实验目的的是
选项
实验目的
实验设计
A
鉴别水和5%的过氧化氢溶液
分别加入少量二氧化锰,观察现象
B
分离和CO气体
通入足量NaOH溶液
C
检验久置的NaOH溶液是否变质
取样,滴加酚酞试液,观察颜色
D
除去溶液中混有的盐酸
加入过量 , 过滤
A、A B、B C、C D、D -
20、下列有关化学观念的说法正确的是A、微粒观:二氧化碳和一氧化碳的化学性质不同,是因为构成两种物质的分子不同 B、守恒观:1g木炭在1g氧气中充分燃烧生成的质量为2g C、转化观:不可以互相转化 D、元素观:某物质在纯氧中完全燃烧生成和 , 推知该物质一定由元素组成