相关试卷
-
1、下列化学反应中,属于化合反应的是A、碳酸钙氧化钙+二氧化碳 B、甲烷+氧气二氧化碳+水 C、氢气+氧气水 D、锌+硫酸=硫酸锌+氢气
-
2、小华进行如图所示实验,探究过氧化氢分解制取氧气的反应中二氧化锰的作用。
 (1)、已知过氧化氢在常温下可以分解产生氧气,图A试管中盛有5mL5%的过氧化氢溶液,将带有火星的木条伸入试管内,没有观察到明显现象,原因是。(2)、如图B,在试管中加入二氧化锰,在图C中观察到的现象是;用文字表示该反应:。(3)、待图C试管中无现象后,向其中再次添加过氧化氢溶液,并把带有火星的木条伸入试管内,观察到;重复该操作多次,均观察到相同的现象,说明。如果用精密的天平称量反应前后二氧化锰的质量,发现二氧化锰的质量没有发生变化。(4)、由上述实验可得出结论:。
(1)、已知过氧化氢在常温下可以分解产生氧气,图A试管中盛有5mL5%的过氧化氢溶液,将带有火星的木条伸入试管内,没有观察到明显现象,原因是。(2)、如图B,在试管中加入二氧化锰,在图C中观察到的现象是;用文字表示该反应:。(3)、待图C试管中无现象后,向其中再次添加过氧化氢溶液,并把带有火星的木条伸入试管内,观察到;重复该操作多次,均观察到相同的现象,说明。如果用精密的天平称量反应前后二氧化锰的质量,发现二氧化锰的质量没有发生变化。(4)、由上述实验可得出结论:。 -
3、为测定空气中氧气的含量,同学们在实验室设计并完成了如图实验。
 (1)、【实施观察】红磷燃烧,产生黄色火焰,放出热量,产生大量;打开弹簧夹后,。(2)、【问题与交流】本实验的原理:红磷燃烧消耗空气中的 , 生成固态的 , 使密闭装置内压强。冷却至室温后,打开弹簧夹,大气压强把烧杯内的水压入集气瓶。进入集气瓶中水的体积,即为空气中氧气的体积。(3)、若将红磷替换为打磨光亮的细铁丝,能否观察到相同的现象,请解释说明。(4)、用文字表示红磷燃烧的反应:。
(1)、【实施观察】红磷燃烧,产生黄色火焰,放出热量,产生大量;打开弹簧夹后,。(2)、【问题与交流】本实验的原理:红磷燃烧消耗空气中的 , 生成固态的 , 使密闭装置内压强。冷却至室温后,打开弹簧夹,大气压强把烧杯内的水压入集气瓶。进入集气瓶中水的体积,即为空气中氧气的体积。(3)、若将红磷替换为打磨光亮的细铁丝,能否观察到相同的现象,请解释说明。(4)、用文字表示红磷燃烧的反应:。 -
4、如图是氯化钠形成的微观过程示意图,请读图后回答下列问题。
 (1)、钠原子与钠离子的区别是。(2)、形成氯化钠的微观本质:钠原子失去1个电子形成 , 氯原子得到1个电子形成 , 钠离子与氯离子结合成氯化钠。(3)、由图可知:原子形成离子的过程中,结构中的一定改变,可能改变,而一定不变。
(1)、钠原子与钠离子的区别是。(2)、形成氯化钠的微观本质:钠原子失去1个电子形成 , 氯原子得到1个电子形成 , 钠离子与氯离子结合成氯化钠。(3)、由图可知:原子形成离子的过程中,结构中的一定改变,可能改变,而一定不变。 -
5、如图是两种变化的微观图示:(●氢原子○氧原子)
 (1)、①②两种变化中属于物理变化的是(填“①”或“②”)。(2)、从微观角度看,物质发生化学变化的实质是。(3)、分子和原子的本质区别是。(4)、下列各图中“●”和“○”分别表示不同元素的原子,其中表示混合物的是______(填字母)。A、
(1)、①②两种变化中属于物理变化的是(填“①”或“②”)。(2)、从微观角度看,物质发生化学变化的实质是。(3)、分子和原子的本质区别是。(4)、下列各图中“●”和“○”分别表示不同元素的原子,其中表示混合物的是______(填字母)。A、 B、
B、 C、
C、 D、
D、
-
6、如图是镍元素在元素周期表中的信息和原子结构示意图,x= , 镍元素在元素周期表中位于第周期,其相对原子质量为。

-
7、写出下列元素符号或符号表示的意义。(1)、氢、氯。(2)、3个硫原子。(3)、Na表示①、②、③。
-
8、可以根据物质的性质鉴别物质。(1)、有两瓶气体,分别是氧气和二氧化碳,请用合适的方法鉴别它们。
①可以利用燃着的木条鉴别氧气和二氧化碳,是因为氧气具有的性质,二氧化碳具有的性质。
②也可以利用澄清石灰水鉴别氧气和二氧化碳,分别向集气瓶中滴加少量澄清石灰水,产生现象的为二氧化碳。
(2)、现有两瓶无色液体,分别是水和酒精。请你根据它们不同的物理性质和化学性质,写出区分它们的两种方法。①。
②。
-
9、微粒观是重要的化学思想。下列关于3种原子的结构示意图的说法正确的是
 A、3种原子核外都有3个电子层 B、图中“+”表示原子带正电 C、③在化学反应中易失去电子 D、②和③的化学性质相似
A、3种原子核外都有3个电子层 B、图中“+”表示原子带正电 C、③在化学反应中易失去电子 D、②和③的化学性质相似 -
10、根据物质分类知识判断,下列物质属于混合物的是A、氮气 B、纯净的空气 C、氧气 D、冰
-
11、下列所示基本操作正确的是A、
 B、
B、 C、
C、 D、
D、
-
12、下列主要发生物理变化的是A、铁生锈 B、纸张燃烧 C、汽油挥发 D、醋的酿造
-
13、
某兴趣小组同学发现向过氧化氢溶液加入氧化铜( , 不溶于水)粉末后,瞬间产生大量气泡。小组同学对此进行探究。
【提出问题】该反应中和过氧化氢溶液分别起什么作用?
【作出猜想】猜想一:与过氧化氢溶液反应,产生气体。
猜想二:自身反应,产生气体,过氧化氢溶液做催化剂加速反应的进行。
猜想三:过氧化氢溶液自身反应,产生气体,做催化剂加速反应进行。
【进行实验】
(1)以上实验不完整,请将实验Ⅲ的实验过程补充完整:
实验
实验过程
实验现象
解释与结论
Ⅰ

带火星的木条均不复燃
常温下,过氧化氢溶液和氧化铜两者自身均不反应或反应较慢。
Ⅱ

带火星的木条复燃。
发生化学反应,产生大量氧气。
Ⅲ
待实验Ⅱ反应结束后, , 并重复此操作。
带火星的木条不复燃
过氧化氢溶液不是催化剂,猜想二错误。
Ⅳ
重复实验Ⅱ,待反应结束后,重新加入过氧化氢溶液,伸入带火星的木条,重复此操作。
带火星的木条均复燃
猜想三正确
(2)小明认为实验Ⅳ仍然不能证明猜想三正确,还需增加一个实验验证反应前后的不变,由此小组同学继续实验,才能得出“猜想三正确、猜想一错误”的结论。
【拓展延伸】小组同学继续对氧化铜和二氧化锰的催化效果进行对比探究。实验装置如图1所示。

按下表添加试剂,然后打开分液漏斗活塞,采集数据,得到图2所示的装置内压强–时间图像。
实验
抽滤瓶
抽滤瓶中盛放物质
分液漏斗盛放物质
1
①
无任何试剂
20mL4%的溶液
2
②
___________g粉末
20mL4%的溶液
3
③
0.2g粉末
20mL4%的溶液
(3)请补充以上表格中,实验2抽滤瓶中盛放物质g粉末。
(4)对比实验2和3,分析图2可得出的结论是。
(5)之后兴趣小组同学对催化剂展开了激烈的讨论并阐述自己的观点,以下观点正确的是。
a.二氧化锰是催化剂 b.催化剂在化学反应前后的质量和性质均不发生改变
c.催化剂就是加快某物质反应速率的物质 d.氧化铜可能是其他物质反应的催化剂
-
14、实验室常用到高锰酸钾固体和过氧化氢溶液来制取氧气,以下装置是制氧所需的化学实验仪器,请根据下列问题,利用所学化学知识作出回答:
 (1)、请指出A中装置名称:b:。(2)、用过氧化氢溶液和二氧化锰来制取较干燥的氧气时,可选发生装置和收集装置是(填序号)。(3)、用E装置收集氧气的依据是 , 检验其氧气是否集满的方法是。(4)、请写出实验室利用A装置制备氧气的文字表达式:。(5)、选用A与C制氧,最后两步实验操作①熄灭酒精灯②撤出导管,其顺序依次是(填序号)。
(1)、请指出A中装置名称:b:。(2)、用过氧化氢溶液和二氧化锰来制取较干燥的氧气时,可选发生装置和收集装置是(填序号)。(3)、用E装置收集氧气的依据是 , 检验其氧气是否集满的方法是。(4)、请写出实验室利用A装置制备氧气的文字表达式:。(5)、选用A与C制氧,最后两步实验操作①熄灭酒精灯②撤出导管,其顺序依次是(填序号)。 -
15、如图所示是工业上制取液氧的流程图,请回答下列问题。
 (1)、蒸发液态空气可分离出氧气和氮气,其原理是利用液氮和液氧的不同。(2)、氮气常用作灯泡填充气,是因为氮气的。(3)、氧气能供给呼吸,若使用如图装置给病人输氧,(填“a”或“b”)与蓝色钢瓶相连。
(1)、蒸发液态空气可分离出氧气和氮气,其原理是利用液氮和液氧的不同。(2)、氮气常用作灯泡填充气,是因为氮气的。(3)、氧气能供给呼吸,若使用如图装置给病人输氧,(填“a”或“b”)与蓝色钢瓶相连。
-
16、阅读以下材料,并回答下列问题:
利用氩氦刀治疗肿瘤
氩氦刀不是一般意义上的手术刀,而是一种低温冷冻微创治疗肿瘤的设备,其治疗过程利用氩气降温和氨气升温,因此被称为氩氦刀。大多数气体遭遇节流后温度将下降,如氩气和氧气。而某些气体,例如氢气和氮气,温度反而上升。
氩氮刀的制冷和加热原理是:当高压气体经针尖突然释放,进入较大空间时,随着压强突然降低,气体会使局部温度迅速降低或升高。氢气在针尖急速释放,可在几十秒内冷冻病变组织,使其温度降至-140℃至-160℃维持15min,关闭氩气,启动氮气;氦气在针尖急速释放,将使病变组织快速升温解冻,从而消除肿瘤。降温和升温的速度以及冷冻区域的大小与形状都可以进行精确设定和控制,而且氢氮刀没有化疗和放疗带来的副作用。
 (1)、氩氦刀的真空绝缘层能承受工作压力四倍的气压,说明该材料有很好的性能。(2)、氩和氦气都属于稀有气体,请写出稀有气体的另一种用途(写一点即可)。(3)、氩氦刀治疗肿瘤的优点之一是。
(1)、氩氦刀的真空绝缘层能承受工作压力四倍的气压,说明该材料有很好的性能。(2)、氩和氦气都属于稀有气体,请写出稀有气体的另一种用途(写一点即可)。(3)、氩氦刀治疗肿瘤的优点之一是。 -
17、为了探究分子运动现象和开展“测定空气里氧气含量”的探究活动,兴趣小组进行了以下实验。
 (1)、图1是按课本进行的实验,一段时间后,A烧杯中的酚酞溶液由无色变红色,由此说明分子具有的性质是。(2)、图2与图1相比,优点(写一条即可)。(3)、图3实验结束后,集气瓶中剩余气体具有的化学性质是。同学们利用如图3装置多次实验,水面均未上升到刻度“1”,原因可能是(写一点即可)。
(1)、图1是按课本进行的实验,一段时间后,A烧杯中的酚酞溶液由无色变红色,由此说明分子具有的性质是。(2)、图2与图1相比,优点(写一条即可)。(3)、图3实验结束后,集气瓶中剩余气体具有的化学性质是。同学们利用如图3装置多次实验,水面均未上升到刻度“1”,原因可能是(写一点即可)。 -
18、如图是探究氧气化学性质的实验。
 (1)、A中可观察到实验现象是:;B中水的作用是。(2)、请写出C装置中的文字表达式:。(3)、若C实验失败,可能的原因是(填序号)。
(1)、A中可观察到实验现象是:;B中水的作用是。(2)、请写出C装置中的文字表达式:。(3)、若C实验失败,可能的原因是(填序号)。①未打磨生锈的铁丝 ②铁丝在集气瓶中自上而下缓慢伸入
③铁丝绕在火柴上,火柴点燃后迅速伸入集气瓶 ④实验前集气瓶敞口放置了一段时间
-
19、某家快递公司在卸载时造成危险化学品氟乙酸甲酯()泄漏导致9人中毒。现收集到有关氟乙酸甲酯的信息:①氟乙酸甲酯是无色透明液体,②沸点为104.5℃;③可溶于酒精,不溶于水;④易燃,在空气中消耗氧气燃烧生成氟化氢、二氧化碳和水;⑤剧毒,有腐蚀性,刺激眼睛、呼吸系统和皮肤;⑥氟乙酸甲酯在燃料、医药、农药等领域有广泛的用途,是制造抗肿瘤药物和抗菌药物的原料。(1)、根据上述内容可归纳出氟乙酸甲酯的物理性质有(填序号)。(2)、按照我国国家邮政局规定氟乙酸甲酯等这类物品不得邮递,通过阅读上述资料,分析其原因为(至少答两点);应避免与人体直接接触,接触时正确处理的方法是。
-
20、兴趣小组用图甲所示装置探究不同催化剂对过氧化氢分解的催化效果。取大小相同的新鲜土豆块和新鲜猪肝块作催化剂,分别加入10mL相同浓度的过氧化氢稀溶液后,用传感器测量装置中气压的变化,如图乙中曲线a、b所示。下列说法正确的是
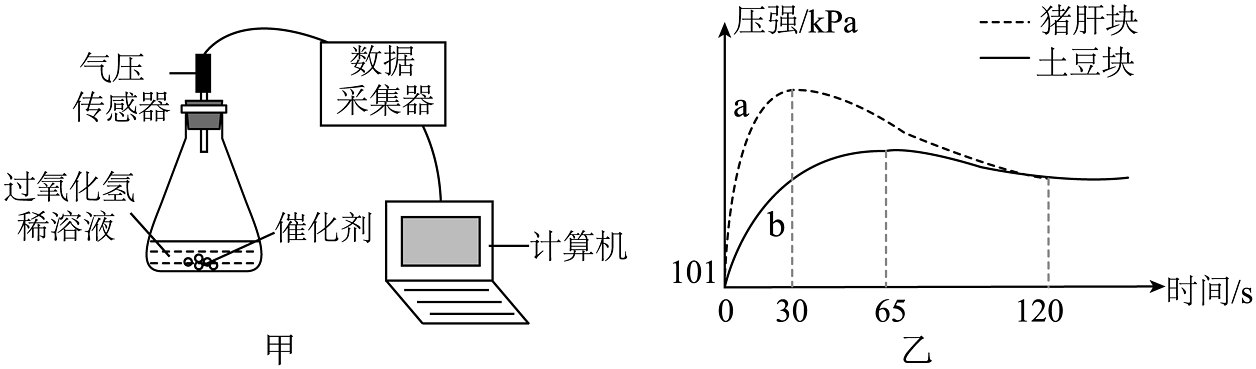 A、两种催化剂中催化效率更高的是土豆块 B、后期压强减小说明过氧化氢分解时会放出热量 C、加猪肝块催化的过氧化氢完全反应所用的时间大约是120s D、30s时曲线a的压强高于65s时曲线b,说明加猪肝块比加土豆块催化其完全反应产生氧气更多
A、两种催化剂中催化效率更高的是土豆块 B、后期压强减小说明过氧化氢分解时会放出热量 C、加猪肝块催化的过氧化氢完全反应所用的时间大约是120s D、30s时曲线a的压强高于65s时曲线b,说明加猪肝块比加土豆块催化其完全反应产生氧气更多