相关试卷
-
1、20℃时,分别对90g溶质质量分数为10%的硝酸钾溶液进行如下处理。计算所得溶液的溶质质量分数:(1)、加入10g蒸馏水:;(2)、加入10g溶质质量分数为15%的硝酸钾溶液:;(3)、加入10g溶质质量分数为10%的硝酸钾溶液:;(4)、加入20g硝酸钾固体,充分搅拌后,过滤,得到3.4g硝酸钾固体:。(计算结果保留到1%)
-
2、
生活和化学实验中,经常用到各种除湿剂(或干燥剂)。某化学实验小组的同学对于除湿剂提出了下面两个问题,他们查阅资料,并进行下面的数字化实验探究。请回答下列各题。
【查阅资料】
(1)①硅胶:无色或白色颗粒,吸水量为30%~35%,加热到200~350℃可以反复使用。其主要成分可看作是SiO2 , 该物质读作。
②浓硫酸:无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂但日常生活中却很少用它作除湿剂。其原因是(写出一条即可)。
【提出问题一】除湿剂是否真的可以除湿?
【实验―】探究浓硫酸对氧气的干燥情况。用10%的过氧化氢溶液和二氧化锰制取的氧气,通过浓硫酸两次干燥,将湿度传感器放入收集氧气的密封保鲜袋内,连接数据采集器和电脑。实验装置如下图1,约采集4min,得到变化曲线如图2.

(2)分析图2曲线﹐袋内湿度明显降低﹐说明。随着时间变化,浓硫酸的吸水速率随着浓硫酸吸水后逐渐被稀释,吸水能力(填“增强”或“减弱”)。
【实验二】探究市售硅胶除湿剂是否真的可以除湿。实验如图3,用25mL烧杯盛放等体积、等温度的两杯水,分别放在生化密闭实验器中,其中一个实验器中加20.0g硅胶,连接数据采集器和电脑。约采集15min,得到变化曲线如图4.
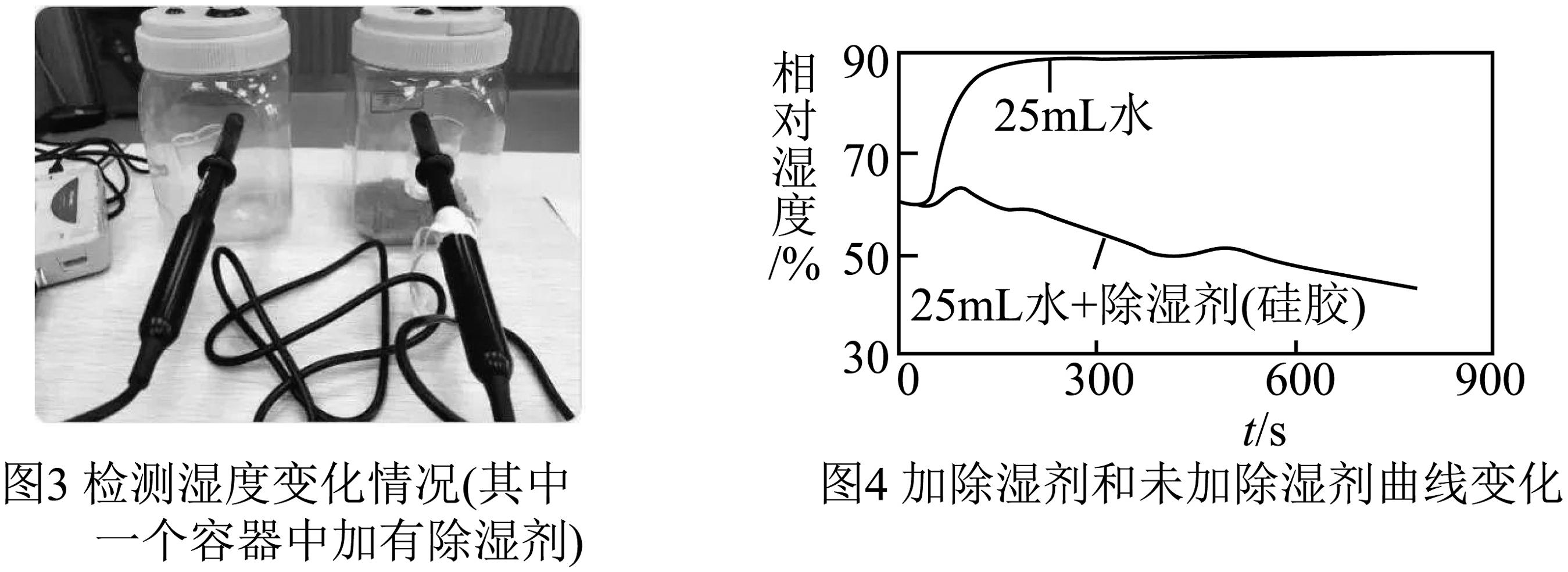
(3)分析图4曲线,未加硅胶的实验器内相对湿度增大的原因是(从微观角度解释)。加硅胶的实验器内相对湿度明显 , 说明硅胶除湿剂的确可以除湿。
【提出问题二】哪种成分的除湿剂除湿效果更好?
取硅胶、蒙脱石﹑氯化钙除湿剂各20.0g,放入3个相同的生化密闭实验器中,连接数据采集器和电脑。约采集20min,得到变化曲线如图5.

(4)分析图5曲线,这三种除湿剂中单位时间内吸附水速率的快慢和除湿效果的强弱顺序是。再通过图2、图5的曲线对比,发现的干燥效果都低于其他除湿剂,这是生活中很少用它作除湿剂的另一个原因。
【实验结论】市售除湿剂的确可以除湿;对比几种除湿剂中硅胶的除湿效果最好,速率最快。不同成分的除湿剂除湿效果除了与所含成分不同外,还可能与颗粒大小,形状等因素有关系。
【拓展提升】同学们查阅资料还发现;还原铁粉(灰色或黑色粉末,又称“双吸剂”),也能够吸收空气中的水分和氧气,常用于食品保鲜。
-
3、
小李同学在实验室配制100g溶质质量分数为18%的食盐溶液。部分实验操作如图所示:

(1)计算:需要食盐质量g,水的体积mL。(水的密度为1g/mL)
(2)称量和量取:按图示的实验操作,小李实际称取的食盐质量是g。按此操作小李配制的食盐溶液的溶质质量分数为(计算结果保留到0.1%)。
在老师的指导下,小李同学纠正了错误操作,按要求完成了实验。
(3)溶解:按下图所示进行操作。其中玻璃棒搅拌的作用是。

装瓶:将所得溶液装入试剂瓶中,盖好瓶塞,贴上标签。
-
4、镁条在空气中燃烧,不仅生成氧化镁,还有少量氡化锑生成。已知氯化镁中氮元素的化合价为-3。那么,氮化镁的化学式量为。其中氮,镁元素的质量比为。100g氮化镁中氮元素的质量为g。
-
5、氯气(Cl2)在涌堂情况下为黄绿色气体,具有较强的氧化性,能与多种金属和非金属直接化合,还能与水l碱等化合物反应。氯气可用于制备多种消毒剂,消毒泡腾片,其中二氧化氯是最新―代高的,广谱、安全环保型杀菌消毒、保鲜剂,世界卫生组织(WHO)已将二氧化氯列为第四代Al级宏全高效消毒剂。请回答:(1)、请写出氯气的物理性质、化学性质(各一条):
①物理性质;
②化学性质。
(2)、二氧化氯的化学式为;其中氯元素的化合价为。 -
6、某实验小组对天然硬水的软化进行研究。填写下列空白。
 (1)、试剂A是用于判断水是硬水还是软水,若出现大量浮渣则为硬水。“某现象”为“出现大量浮渣”,说明活性炭(填“能”或“不能”)降低水的硬度。加入活性炭是利用其性,除去水中的色素和异味。(2)、煮沸过程中可将溶于水的Mg(HCO3)2转化为难溶性的Mg(OH)2以降低水的硬度。该过程属于变化。(3)、通过(填操作名称)可将Mg(OH)2等难溶性杂质除去。如图是小芳同学的操作示意图。该装置图中有处明显错误;该装置图缺少的仪器是 , 其作用为。
(1)、试剂A是用于判断水是硬水还是软水,若出现大量浮渣则为硬水。“某现象”为“出现大量浮渣”,说明活性炭(填“能”或“不能”)降低水的硬度。加入活性炭是利用其性,除去水中的色素和异味。(2)、煮沸过程中可将溶于水的Mg(HCO3)2转化为难溶性的Mg(OH)2以降低水的硬度。该过程属于变化。(3)、通过(填操作名称)可将Mg(OH)2等难溶性杂质除去。如图是小芳同学的操作示意图。该装置图中有处明显错误;该装置图缺少的仪器是 , 其作用为。
-
7、如图是电解水实验的简易装置,试回答下列问题。
 (1)、在实验过程中,试管b汇集的气体的化学式是。(2)、a,b两试管中的气体体积比约为(整数值)。(3)、图示电源的左端为电源的(填“正”或“负”)极。(4)、该实验的微观解释(用“分子、原子”填空):水通电分解为氢、氧,氢、氧又分别结合成氢、氧。化学变化的实质是发生重新组合,形成新的分子或物质。
(1)、在实验过程中,试管b汇集的气体的化学式是。(2)、a,b两试管中的气体体积比约为(整数值)。(3)、图示电源的左端为电源的(填“正”或“负”)极。(4)、该实验的微观解释(用“分子、原子”填空):水通电分解为氢、氧,氢、氧又分别结合成氢、氧。化学变化的实质是发生重新组合,形成新的分子或物质。 -
8、化学用语是初中化学的重要组成部分。请用元素符号,离子符号、化学式表示。(1)、碳元素。(2)、2个氯离子。(3)、硫酸铜的化学式。(4)、2个氢分子。(5)、锶(Sr)的一种微粒结构示意图为
 , 则该微粒符号为。
, 则该微粒符号为。 -
9、现有MgO和另一种金属氧化物组成的混合物4g,测得其中氧元素的质量为1.8g,则另一种金属氧化物可能是A、CuO B、CaO C、Al2O3 D、Fe2O3
-
10、下列变化属于分解反应的是A、食盐水食盐+水 B、镁+氧气氧化镁 C、水氢气+氧气 D、锌+稀盐酸→氯化锌+氢气
-
11、2023年是元素周期表诞生第150周年。如图是元素周期表的一部分,从表中不能获取的信息是
 A、铜原子的中子数为29 B、钾原子的质子数为19 C、溴的相对原子质量为79.90 D、铝元素在周期表的第三周期
A、铜原子的中子数为29 B、钾原子的质子数为19 C、溴的相对原子质量为79.90 D、铝元素在周期表的第三周期 -
12、归纳总结是学习化学的重要方法。下列说法正确的个数有
①分子一定比原子大
②带电的微粒不一定是离子
③水结冰后水分子停止运动
④均一、稳定的液体一定是溶液
⑤CO和CO2组成元素相同,化学性质也相同
⑥其他条件不变,增加溶剂能使饱和溶液变成不饱和溶液
A、2个 B、3个 C、4个 D、5个 -
13、明代李梃的《医学入门》中记载了制取没食子酸的方法。没食子酸(化学式为C6H7O5)是世界上最早制得的有机酸﹐中医常用其治疗流感。下列有关没食子酸的叙述正确的是A、没食子酸的相对分子质量为159g B、15.9g没食子酸中含有7.2g碳元素 C、没食子酸由碳、氢、氧三种原子构成 D、没食子酸中碳、氢元素的质量比为6:7
-
14、如图所示,试管中装有一定体积的蒸馏水,向试管中加入某种物质后,红墨水向左移动。该物质是
 A、食盐 B、植物油 C、硝酸铵 D、氢氧化钠
A、食盐 B、植物油 C、硝酸铵 D、氢氧化钠 -
15、实验室配制溶质质量分数为10%的食盐溶液50g,不需要用到的仪器是A、
 B、
B、 C、
C、 D、
D、
-
16、请结合下图回答问题:
 (1)、仪器名称:① , ②。(2)、用高锰酸钾制备并收集一瓶较纯净的氧气,选用的装置组合是(填字母),试管口放一团棉花的原因是 , 该反应的表达式为 , 该实验收集到的氧气不纯,可能的原因是。(3)、图C是实验室制备气体的一种装置图。该装置的特点是:打开弹簧夹,块状固体和液体接触,反应发生;关闭弹簧夹后,产生的气体将液体压回装置②,使固体和液体分开,反应停止。用过氧化氢溶液制氧气时(填“可以”或“不可以”)采用此装置。
(1)、仪器名称:① , ②。(2)、用高锰酸钾制备并收集一瓶较纯净的氧气,选用的装置组合是(填字母),试管口放一团棉花的原因是 , 该反应的表达式为 , 该实验收集到的氧气不纯,可能的原因是。(3)、图C是实验室制备气体的一种装置图。该装置的特点是:打开弹簧夹,块状固体和液体接触,反应发生;关闭弹簧夹后,产生的气体将液体压回装置②,使固体和液体分开,反应停止。用过氧化氢溶液制氧气时(填“可以”或“不可以”)采用此装置。 -
17、图1为元素周期表的一部分,图2为几种粒子结构示意图,据图回答问题。
 (1)、图1中氧的核电荷数是 , 硫的相对原子质量是。(2)、请画出氟原子的结构示意图 , 它在周期表中位于第周期。(3)、图2是四种微观粒子的结构示意图,其中属于阳离子的是(填字母序号,下同),属于同一种元素的是;B表示的原子,在化学反应中容易(填“得到”或“失去”)个电子,达到相对稳定结构,形成(填离子符号)。
(1)、图1中氧的核电荷数是 , 硫的相对原子质量是。(2)、请画出氟原子的结构示意图 , 它在周期表中位于第周期。(3)、图2是四种微观粒子的结构示意图,其中属于阳离子的是(填字母序号,下同),属于同一种元素的是;B表示的原子,在化学反应中容易(填“得到”或“失去”)个电子,达到相对稳定结构,形成(填离子符号)。 -
18、我国承诺力争在2030年前实现碳达峰、2060年前实现碳中和。减少空气中CO2含量的有效措施包括二氧化碳捕集、封存与利用等。请回答下列问题:(1)、吸附法是利用固态吸附剂对气体进行有选择性的可逆吸附来分离回收CO2.将捕集到的CO2转化成流体态(气态、超临界态和液态共存)输送到封存地点,此过程中二氧化碳分子(填“有”或“没有”)改变。(2)、我国自主研发的“液态太阳能燃料合成技术”可将CO2转化为CH3OH(甲醇)等物质,生产流程如下图所示:

该流程中可循环利用的物质的化学式是 , 电解水时发生反应的表达式为 , 该过程把能转化为化学能;催化合成阶段,发生反应的表达式为。
-
19、材料一:通常情况下,硫单质是黄色晶体,难溶于水,微溶于乙醇,易溶于二硫化碳。硫及其化合物在生产生活中有广泛用途,燃烧硫磺常用于熏蒸消毒和漂白。
材料二:西汉青铜雁鱼灯及其工作原理如图所示。青铜雁鱼灯里面是空的,腹部用于贮水。使用时燃烧产生的烟气(含二氧化硫SO2)通过雁脖子进入腹部。

材料三:东晋《抱朴子》记载,“凡草木烧之即烬,而丹砂(硫化汞HgS)烧之成水银(汞Hg),积变又还成丹砂,其去凡草木亦远矣”。
(1)、“材料一”中属于硫的物理性质的是(写一条)。写出硫在空气中燃烧的表达式:。(2)、“材料二”中青铜雁鱼灯腹部贮水的目的是。(3)、“材料三”中丹砂受热分解,从微观角度分析,该反应过程中,发生改变的微观粒子是(填“分子”或“原子”)。 -
20、空气是一种重要的资源。请沿用科学家认识事物的方法认识“空气”:(1)、从微观角度:用“
 ”表示氮原子,“
”表示氮原子,“ ”表示氧原子。用“
”表示氧原子。用“ ”可表示的微粒是(填名称);已知:同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,据此图中可表示空气微观模型的是(填标号)。
”可表示的微粒是(填名称);已知:同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,据此图中可表示空气微观模型的是(填标号)。A.
 B.
B.  C.
C. (2)、从变化角度:根据下表数据判断:
(2)、从变化角度:根据下表数据判断:工业上制取氧气,控制温度T在℃<T<℃液态空气内的氮气分离出来。用液态空气制取氧气的过程属于变化。
物质
H2O
CO2
N2
O2
沸点/℃
0
-56.6
-196
-183
(3)、从空气的用途角度看。冰箱中常用“气调保鲜”来达到对食物保鲜的效果。如图所示是工业上用膜分离技术实现“气调保鲜”的流程。

在空气分离后,富氧空气中氧气和其他气体的体积比可能是_____(填字母)。
A、1:3 B、1:4 C、1:5(4)、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,主要来自化石燃料的燃烧和飘尘。下列措施能减少PM2.5污染的是_______(填字母〉。A、焚烧秸秆 B、用太阳能发电 C、大量烧煤取暖 D、植树造林