相关试卷
-
1、请用合适的化学用语填空:
4个亚铁离子;相对分子质量最小的氧化物;由地壳中含量最高的金属元素组成的氧化物的化学式为。
-
2、原煤(含硫元素)在氧气中不完全燃烧会生成 CO、CO2 和 SO2。SO2 在空气中溶于雨水会形成酸雨。若测得 CO、CO2 和 SO2 的混合气体中碳元素的质量分数为24%,则其中 SO2 的质量分数可能是( )A、10% B、30% C、50% D、70%
-
3、在反应中,已知A和B的相对分子质量之比为 , 当与一定量B恰好完全反应后,生成 , 则生成C的质量为A、 B、 C、 D、
-
4、如图为碘元素在元素周期表的部分信息及其原子结构示意图。下列说法错误的是
 A、碘属于非金属元素 B、碘原子的质子数为53 C、碘元素位于元素周期表中的第四周期 D、碘原子在化学反应中易获得电子
A、碘属于非金属元素 B、碘原子的质子数为53 C、碘元素位于元素周期表中的第四周期 D、碘原子在化学反应中易获得电子 -
5、下列关于三种物质的说法正确的是A、都含有氧分子 B、“2”均表示2个氧原子 C、氧元素的质量分数 D、核电荷数:C<S<N
-
6、宏观物质是由微观粒子构成的,构成下列物质的粒子与构成氖气的粒子类型相同的是( )A、铜、氧气 B、氨气、硫酸铜 C、金、水银 D、二氧化碳、水
-
7、开车不喝酒,喝酒不开车。如表是国家对“饮酒驾车”和“醉酒驾车”的界定标准。乙醇(俗称酒精,化学式为C2H5OH),饮酒后酒精会进入人体血液中。请回答下列问题:
酒驾类型
血液中酒精含量
饮酒驾车
20毫克/100毫升≤血液中的酒精含量<80毫克/100毫升
醉酒驾车
血液中的酒精含量≥80毫克/100毫升
(1)、某人饮酒后驾车,被交警发现,经抽血测定其每100毫升血液中酒精含量为93毫克,属于驾车。(2)、乙醇中碳、氢、氧三种元素的质量比为。(3)、根据乙醇的元素组成,试推理乙醇在人体内最终的氧化产物为CO2和。(4)、多少克乙醇中碳元素的质量与22克二氧化碳中碳元素的质量相等?(写出计算过程) -
8、
小华同学对课本实验“测定空气中氧气的含量”,实验完毕后集气瓶中是否还含有氧气产生质疑,于是设计了如图1装置来探究磷在空气中燃烧后氧气浓度的变化情况。
【提出问题】足量红磷在密闭的图1容器内燃烧熄灭后,容器内氧气是否有剩余?
【猜想假设】猜想1:氧气有剩余;猜想2:氧气无剩余。
【实验验证】按图1组装好实验装置(气密性良好),利用高能激光笔照射燃烧匙上的足量红磷,红磷燃烧直至熄灭。待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
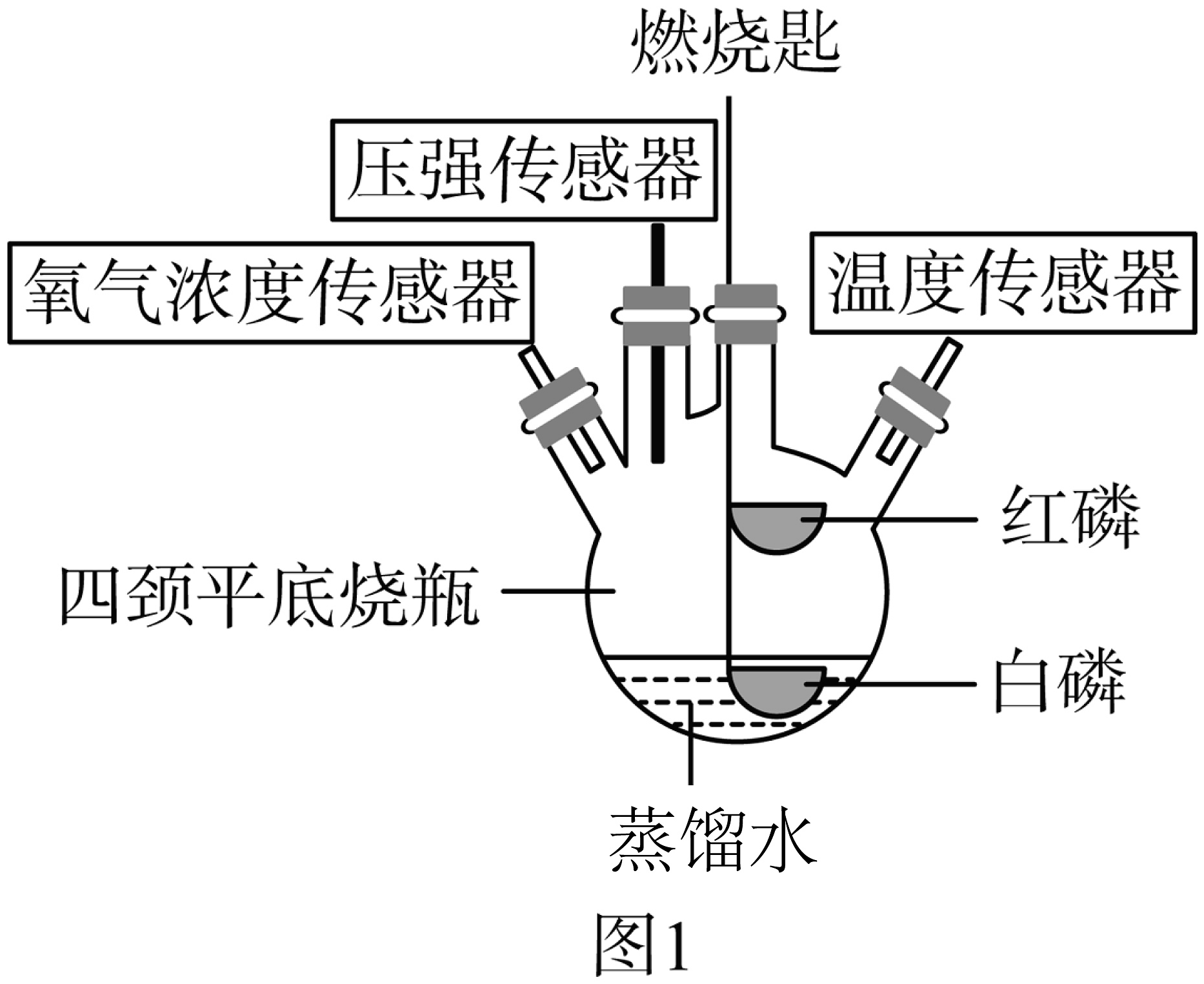
(1)实验中,激光笔的作用有。
(2)红磷在空气中燃烧的文字表达式(或符号表达式)为 , 反应的基本类型为。
【实验结论】
(3)猜想正确。
【交流讨论】
(4)图2是该小组同学在整个实验过程中,用氧气传感器测定容器内氧气浓度变化的曲线图。曲线DE段氧气浓度变化的原因是。

(5)根据图2中曲线变化,你认为用“燃磷法测定空气中氧气含量”时,选用红磷和白磷哪种更合适并说明理由。
-
9、化学是一门以实验为基础的科学。
 (1)、仪器名称:①。(2)、实验室选用加热氯酸钾和二氧化锰的混合物制氧气,该反应的文字表达式(或符号表达式)为 , 制备并收集一瓶较纯净的氧气,应选用的装置组合是(从A~E装置中选取)。若用F装置收集氧气,证明氧气已经集满的方法是。(3)、氢气是理想的绿色能源,在点燃前,要先。实验室常用锌粒(固体)和稀硫酸(液体)在常温下制取氢气,选用的发生装置是(填字母)。如要获得平稳的气流,需对装置进行的改进是。可用E装置收集氢气,由此说明氢气的物理性质是。(4)、选择制作简易供氧器的药品时,下列因素不需要考虑的是______(填字母)。A、是否廉价易得 B、反应速率是否适中 C、氧气的性质 D、是否安全、环保(5)、某化学兴趣小组设计如表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图2所示。
(1)、仪器名称:①。(2)、实验室选用加热氯酸钾和二氧化锰的混合物制氧气,该反应的文字表达式(或符号表达式)为 , 制备并收集一瓶较纯净的氧气,应选用的装置组合是(从A~E装置中选取)。若用F装置收集氧气,证明氧气已经集满的方法是。(3)、氢气是理想的绿色能源,在点燃前,要先。实验室常用锌粒(固体)和稀硫酸(液体)在常温下制取氢气,选用的发生装置是(填字母)。如要获得平稳的气流,需对装置进行的改进是。可用E装置收集氢气,由此说明氢气的物理性质是。(4)、选择制作简易供氧器的药品时,下列因素不需要考虑的是______(填字母)。A、是否廉价易得 B、反应速率是否适中 C、氧气的性质 D、是否安全、环保(5)、某化学兴趣小组设计如表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图2所示。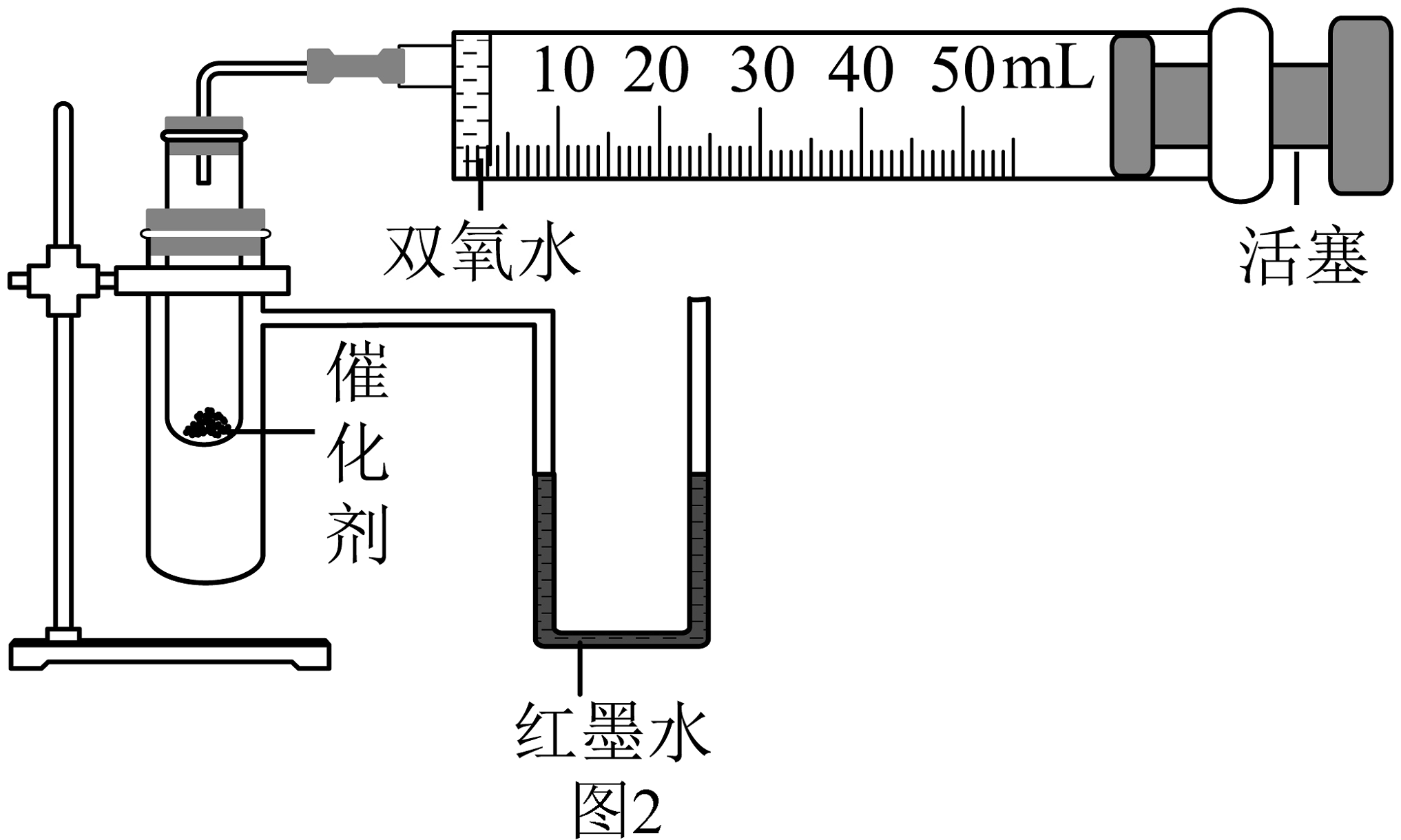
实验序号
过氧化氢溶液
催化剂
实验1
5mL4%
粉末状MnO20.2g
实验2
5mL4%
粉末状CuO0.2g
①实验2中制取氧气的文字表达式或符号表达式为。
②实验需要测量并记录的数据有:氧气的体积和。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是。
-
10、
水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。
I.水的组成

(1)如图是太空舱通过电解水制氧的实验装置,电源A极是________极。将燃着的蜡烛放入b管收集的气体中,看到燃烧________。
(2)太空舱制氧原理的文字表达式(或符号表达式)为________,反应过程中种类和数目均没有发生改变的微观粒子是________(用符号表示)。该实验说明水是由________组成。
(3)实验前预先向水中加入少量氢氧化钠等物质,目的是________,以提高电解效率。升高温度也能提高电解效率的原因之一是:温度升高,微观粒子运动速率________。
(4)电解过程中消耗的水和生成的氧气的质量比是________。
II.水的净化
(5)保护水资源是全社会共同的责任。下列做法符合爱护水和保护水的是______(填序号)。
A. 大量使用化肥农药 B. 工业废水处理达标后排放 C. 园林浇灌改大水漫灌为喷灌、滴灌 (6)自来水厂常用明矾[KAl(SO4)m•12H2O]作絮凝剂,明矾能作絮凝剂是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝,则m=________,氢氧化铝的化学式为________。
(7)实验室进行过滤操作时,需要用到的玻璃仪器有烧杯、玻璃棒和________。玻璃棒的作用是________。正确过滤后,展开滤纸,若灰色代表泥沙,则看到的情况最接近图中的________(填字母)。
A.
 B.
B. C.
C. D.
D.
(8)小丽同学在自制的净水器中忘记放入了______(填序号),导致所得的水仍有明显颜色。
A. 小卵石 B. 石英砂 C. 活性炭 -
11、空气是重要的资源。如图是利用空气生产氮肥的一种方法。下列说法正确的是
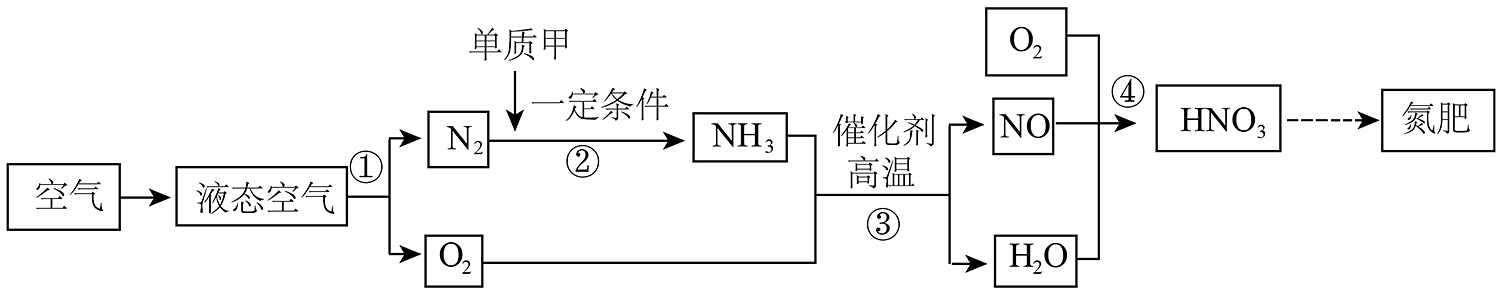 A、过程①利用了N2与O2的密度不同 B、反应②甲物质为H2 C、反应③中需不断添加催化剂 D、过程④中有三种元素的化合价在反应前后发生了变化
A、过程①利用了N2与O2的密度不同 B、反应②甲物质为H2 C、反应③中需不断添加催化剂 D、过程④中有三种元素的化合价在反应前后发生了变化 -
12、如图是汽车尾气中某些有毒气体转变为无毒气体的微观示意图。下列说法错误的是
 A、反应物都是氧化物 B、反应后生成三种新物质 C、该反应遵守质量守恒定律 D、反应前后原子的种类、数目均无变化
A、反应物都是氧化物 B、反应后生成三种新物质 C、该反应遵守质量守恒定律 D、反应前后原子的种类、数目均无变化 -
13、5G时代已经来临,高纯度单质硅是制作芯片的材料,如图是硅元素在元素周期表中的某些信息,下列有关硅的说法错误的是
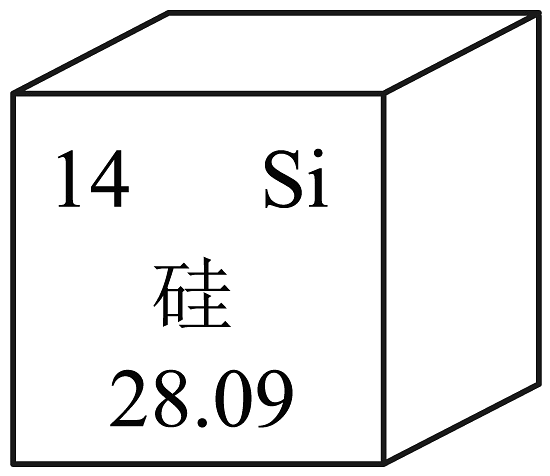 A、元素符号为Si B、属于非金属元素 C、质子数为14 D、相对原子质量为28.09g
A、元素符号为Si B、属于非金属元素 C、质子数为14 D、相对原子质量为28.09g -
14、宏观和微观结合是认识物质结构与性质的重要方法。下列对于宏观事实的微观解释错误的是A、“满架蔷薇一院香”——分子在不断运动 B、金刚石和石墨物理性质不同——碳原子排列方式不同 C、水银温度计的汞柱升高或降低——汞原子大小发生变化 D、氢气在氧气中燃烧生成水——化学变化中分子分解为原子,原子又结合成新的分子
-
15、生活中常接触到“含氟牙膏”“碘盐”和“加铁酱油”等用品,这里的氟、碘、铁指的是A、元素 B、原子 C、离子 D、单质
-
16、下列对实验现象的描述中,错误的是A、红磷在空气中燃烧,产生大量白烟,放出热量 B、木炭在氧气中燃烧,产生白光,放出热量,生成二氧化碳 C、铁丝在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体 D、镁条在空气中燃烧,发出耀眼的白光,放出热量,生成白色固体
-
17、规范的操作方法是实验安全和成功的重要保证。下列实验操作中正确的是A、闻气体气味
 B、连接仪器
B、连接仪器 C、倾倒液体
C、倾倒液体 D、向试管里加固体粉末
D、向试管里加固体粉末
-
18、物质由微观粒子构成,下列物质由原子直接构成的是A、铁 B、氢气 C、水 D、氯化钠
-
19、习近平总书记在2024年新年贺词中指出“中国以自强不息的精神奋力攀登,到处都是日新月异的创造。”下列属于化学研究范畴的是A、研制“奋斗者”号钛合金材料 B、用“中国天眼”探索太空奥秘 C、研究“神舟十七号”飞船轨道 D、计算“嫦娥六号”在月球上的重力
-
20、
空气是宝贵的自然资源。如图是以空气等为原料合成尿素【CO(NH2)2】的流程(部分产物略)。

(1)空气中体积分数最大的气体是;X气体是 , 反应②的基本反应类型为。
(2)工业上获取氧气主要通过分离液态空气法,该过程属于(填“物理”或“化学”)变化。工业上制取氧气的方法除分离液态空气外,还有一种分子筛制氧法,又叫吸附法,其原理如下图所示。由此推测氧分子的体积比氮分子。(填“大”或“小”)

(3)尿素 CO(NH2)2的相对分子质量是 , N、H元素质量比为;N元素的质量分数是(保留一位小数)。
(4)尿素【CO(NH2)2】和碳酸氢铵(NH4HCO3 , 简称碳铵)是惠州地区常用的氮肥,某月市场报价为:尿素2000元/吨,碳铵600元/吨,若你用1000元前去购买氮肥,为了使所购的化肥得到的氮最多,应该选择这两种氮肥中的。(写名称)