相关试卷
-
1、水是生命之源,研究“水”可从多角度展开。(1)、某同学将公园里浑浊的水样倒入烧杯中,静置一会儿后,进行过滤(如图1),请回答:

①进行过滤操作时,下列做法错误的是(填字母)。
A.玻璃棒要靠在三层滤纸的一边
B.漏斗末端尖嘴部分紧靠烧杯的内壁
C.滤纸边缘要低于漏斗边缘
D.液面不要低于滤纸边缘
②若过滤后滤液仍浑浊,可能的原因是(写一条)。
(2)、“生命吸管”(如图2)可直接将污水净化为饮用水,主要净水流程如图3所示(离子交换树脂的主要作用是去除重金属离子、软化水质)。其中活性炭的作用是(填字母,下同),超滤膜的作用是。
A.去除有害细菌和部分病毒
B.吸附色素和异味
C.除去较大的不溶性杂质
(3)、经“生命吸管”处理后的水是硬水还是软水,可加入检验。在生活中,为降低水的硬度和杀灭病原微生物,常采用的方法,硬水在煮沸时发生的反应之一是:碳酸氢钙碳酸钙+二氧化碳+水,该反应所属基本反应类型是(选填“化合”或“分解”)反应。(4)、电解水实验(如图4)中,常用检验玻璃管a中的气体,该实验可说明水是由组成的。
-
2、如图是实验室制取气体常用的装置,试回答有关问题。
 (1)、写出仪器①的名称:。(2)、若用G装置收集氧气,应从(选填“a”或“b”)端通入气体。(3)、实验室用氯酸钾和二氧化锰制取并收集干燥的氧气,发生装置应选(填字母,后同),收集装置应选 , 反应的文字表达式为 , 检验氧气收集满的方法为。若用高锰酸钾和装置A制取氧气,你认为还缺少。(4)、装置C与B相比,优点是。
(1)、写出仪器①的名称:。(2)、若用G装置收集氧气,应从(选填“a”或“b”)端通入气体。(3)、实验室用氯酸钾和二氧化锰制取并收集干燥的氧气,发生装置应选(填字母,后同),收集装置应选 , 反应的文字表达式为 , 检验氧气收集满的方法为。若用高锰酸钾和装置A制取氧气,你认为还缺少。(4)、装置C与B相比,优点是。 -
3、下图是初中化学中常见的实验。

(1)A中现象:烧杯②中溶液变红。请用分子的知识解释“变红”的原因。
(2)B中集气瓶底部有少量水,其作用是 , 反应的文字表达式为。
(3)C实验完毕,集气瓶内水面上升到一定高度后,不能继续上升,这种现象说明氮气具有的性质;若从烧杯中进入集气瓶内水的体积明显小于瓶内原空气体积的 , 可能存在的原因是(写出一条即可)。
-
4、按要求回答下列问题。(1)、图1为A、B、C、D四种粒子的结构示意图。

①图1中共有种元素,中n=。
②四种粒子中属于同种元素的是(填字母)。
③A和C两种粒子的相同,所以它们具有相似的化学性质。
(2)、图2是镁在氧气中燃烧反应的微观示意图。
①生成物丙中两种元素的原子个数比为。
②在化学变化中,(选填“分子”或“原子”)不能再分。
-
5、宏微结合是化学学科特有的思维方式。下列对宏观事实的微观解释,不正确的是A、水结成冰——水分子停止了运动 B、氧气液化——分子间隔变小 C、氢气在氧气中燃烧生成水——化学反应中分子种类发生改变 D、CO能燃烧,CO2不能燃烧——不同的分子化学性质不同
-
6、下列关于空气及其成分的认识正确的是A、氮气的化学性质不活泼 B、空气中氧气的质量分数为21% C、空气中的稀有气体燃烧时能发出不同颜色的光,可作电光源 D、洁净的空气是纯净物
-
7、下列实验基本操作正确的是A、点燃酒精灯
 B、倾倒液体
B、倾倒液体 C、装入固体粉末
C、装入固体粉末 D、加热液体
D、加热液体
-
8、溶液在人类的生产、生活和科学研究中具有广泛的应用。农业生产中通常用溶质质量分数为的氯化钠溶液来选种,请完成下列配制溶液的问题:(1)、现要配制溶质质量分数为的氯化钠溶液,需要取用固体氯化钠多少?(2)、用溶质质量分数为的氯化钠溶液,可稀释成的氯化钠溶液多少?
-
9、如下是市售某品牌牙膏包装盒上的部分说明。其主要活性成分单氟磷酸钠(),是牙膏常用添加剂之一,实验表明牙膏主要活性中单氟磷酸钠质量分数达到时,防龋齿效果较好。
主要活性成分:单氟磷酸钠()
净含量:
含氟:
功能:防止蛀牙
请据图回答:
(1)、求单氟磷酸钠的相对分子质量。(2)、求单氟磷酸钠中钠元素与氧元素的质量比。 -
10、
某兴趣小组在学习了过氧化氢分解制氧气的实验后,知道催化剂(二氧化锰)能改变化学反应速率。到底还有哪些因素与化学反应速率有关呢?
【任务一】探究氧化铜能否对过氧化氢的分解起催化作用

(1)在此实验中观察到:A试管中小木条;B试管中的小木条复燃;结论:氧化铜能加快过氧化氢的分解速率。
(2)同学们讨论后,认为要确定氧化铜对此反应有催化作用,还需探究反应前后氧化铜的不变。
【任务二】探究二氧化锰和氧化铜对过氧化氢分解的催化效果
化学兴趣小组的同学为了比较氧化铜和二氧化锰对过氧化氢分解的催化效果。用如图1所示的装置进行了两次实验,在试管中分别加入等质量的氧化铜和二氧化锰,分别将注射器内盛有的的双氧水注入试管中,利用注射器收集氧气,收集到氧气的体积和时间的关系如图2所示。

(3)为了比较两种催化剂的催化效果,实验中除了记录注射器内收集氧气的体积,还需记录。
(4)通过图像除了能得出二氧化锰催化效果比氧化铜好,还能得出的结论。
【任务三】:探究影响反应速率的其他因素
实验步骤
现象
结论
取一支试管加入的过氧化氢溶液,把试管放入盛有冷水的烧杯中
反应缓慢,有少量气泡冒出
__________
取一支试管加入的过氧化氢溶液,把试管放入盛有热水的烧杯中
反应迅速,有大量气泡冒出
(5)上表中得到的结论是。
(6)在设计此实验时,需要改变的因素。
同学们经过讨论,一致认为影响过氧化氢分解速率的因素还有很多,如:过氧化氢溶液的浓度。
-
11、如图是实验室常用的实验仪器与装置。依据题目要求回答下列问题:
 (1)、写出标号仪器的名称①。(2)、甲同学用分解过氧化氢溶液的方法制取氧气,其文字表达式为。(3)、乙同学选择用高锰酸钾为原料制取一瓶纯净的氧气,应选择的装置组合是(填写序号)。(4)、将收集的氧气倒入装置F的烧杯中,观察到带火星的木条自下而上依次复燃,说明氧气具有的性质是。(5)、组装好B装置后,该同学先向分液漏斗中加入水,然后将导管另一端浸入水中,并打开分液漏斗的活塞,观察导管口是否有连续的气泡冒出,该操作的目的是。
(1)、写出标号仪器的名称①。(2)、甲同学用分解过氧化氢溶液的方法制取氧气,其文字表达式为。(3)、乙同学选择用高锰酸钾为原料制取一瓶纯净的氧气,应选择的装置组合是(填写序号)。(4)、将收集的氧气倒入装置F的烧杯中,观察到带火星的木条自下而上依次复燃,说明氧气具有的性质是。(5)、组装好B装置后,该同学先向分液漏斗中加入水,然后将导管另一端浸入水中,并打开分液漏斗的活塞,观察导管口是否有连续的气泡冒出,该操作的目的是。 -
12、某实验小组利用图1所示仪器进行“配制一定质量分数的氯化钠溶液”的实验:
 (1)、按实验要求,图1中还缺少玻璃仪器是(填名称)。(2)、小刚按图2的操作称取氯化钠,他称取的氯化钠实际质量为(该托盘天平以下用游码)。(3)、将配制好的氯化钠溶液装入试剂瓶时有少量溶液洒出,对所配制氯化钠溶液质量分数的影响是(选填“偏大、偏小”或“不影响”)。
(1)、按实验要求,图1中还缺少玻璃仪器是(填名称)。(2)、小刚按图2的操作称取氯化钠,他称取的氯化钠实际质量为(该托盘天平以下用游码)。(3)、将配制好的氯化钠溶液装入试剂瓶时有少量溶液洒出,对所配制氯化钠溶液质量分数的影响是(选填“偏大、偏小”或“不影响”)。 -
13、山东籍航天员王亚平在“天宫课堂”中介绍了空间站中的生活,在轨演示了水球变气球等炫酷的实验。“天宫”中水和氧气的最大化利用是生活保障的重要措施。如图是空间站资源再利用模拟图。
 (1)、在“水净化系统”中,高分子膜可以除去水中大分子杂质,与实验室常用的操作原理相同。(2)、“水电解系统”中生成氧气的反应属于反应(填基本反应类型)。(3)、下列说法正确的是__________。A、太空水和地球上的水化学性质相同 B、太空水制取过程既有物理变化又有化学变化 C、太空水中的水分子也在不断运动(4)、“氢氧燃料电池”中有催化剂,氢气与氧气在催化剂作用下能直接化合释放出电能,实现由化学能到电能的转化,所发生反应的文字表达式为。
(1)、在“水净化系统”中,高分子膜可以除去水中大分子杂质,与实验室常用的操作原理相同。(2)、“水电解系统”中生成氧气的反应属于反应(填基本反应类型)。(3)、下列说法正确的是__________。A、太空水和地球上的水化学性质相同 B、太空水制取过程既有物理变化又有化学变化 C、太空水中的水分子也在不断运动(4)、“氢氧燃料电池”中有催化剂,氢气与氧气在催化剂作用下能直接化合释放出电能,实现由化学能到电能的转化,所发生反应的文字表达式为。 -
14、我们从化学的视角来认识“空气”。(1)、从物质分类角度:新鲜的空气属于(填“混合物”或“纯净物”)。(2)、从构成物质的微粒角度(用“
 ”表示氧原子,“
”表示氧原子,“ ”表示氮原子):同温度下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,下列可表示空气微观模型的是__________(填序号)。 A、
”表示氮原子):同温度下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,下列可表示空气微观模型的是__________(填序号)。 A、 B、
B、 C、
C、 (3)、从实验的角度:某兴趣小组的同学利用下图测定空气中氧气含量,实验过程如图所示。对该实验的认识正确的是______。
(3)、从实验的角度:某兴趣小组的同学利用下图测定空气中氧气含量,实验过程如图所示。对该实验的认识正确的是______。 A、该实验中的铜粉可以换成碳粉 B、停止加热后,等装置冷却到室温读数 C、正确操作情况下,反应结束后,消耗的氧气的总体积应该是反应前注射器内气体体积的 D、实验结束后,硬质玻璃管内剩余的气体主要是氮气(4)、从污染角度:为了防止空气污染,保护美丽的蓝色天空,洁净的空气对人类非常重要。请你提出一条防治空气污染的合理建议:。
A、该实验中的铜粉可以换成碳粉 B、停止加热后,等装置冷却到室温读数 C、正确操作情况下,反应结束后,消耗的氧气的总体积应该是反应前注射器内气体体积的 D、实验结束后,硬质玻璃管内剩余的气体主要是氮气(4)、从污染角度:为了防止空气污染,保护美丽的蓝色天空,洁净的空气对人类非常重要。请你提出一条防治空气污染的合理建议:。 -
15、化学用语是简明扼要、信息丰富、国际通用的语言,请用化学用语填空。(1)、2个氢原子。(2)、保持二氧化碳化学性质的最小微粒。(3)、氦气。
-
16、逻辑推理是一种重要的化学思维方法。下列推理正确的是A、溶液具有均一性、稳定性,但均一、稳定的液体不一定是溶液 B、原子和分子都是构成物质的微观粒子,原子在化学变化中不能再分,所以分子在化学变化中也不能再分 C、离子是带电荷的微粒,所以带电荷的微粒一定是离子 D、化学变化通常伴随热量变化,则有热量变化的过程都是化学变化
-
17、图像能直观表达各种变化关系,加深对知识的理解,下列图像与其对应表述正确的是
 A、在某温度下,往接近饱和溶液中加入固体 B、电解水生成氢气和氧气的质量与反应时间的关系 C、在某温度下,向一定量饱和溶液中不断加入固体 D、在密闭容器中用足量铜粉测定空气中氧气的含量
A、在某温度下,往接近饱和溶液中加入固体 B、电解水生成氢气和氧气的质量与反应时间的关系 C、在某温度下,向一定量饱和溶液中不断加入固体 D、在密闭容器中用足量铜粉测定空气中氧气的含量 -
18、的转化利用是实现碳中和的重要途径。如图是与某种单质反应的微观示意图。下列说法正确的是
 A、乙的化学式为 B、整个反应过程中涉及到3种氧化物 C、反应前后各元素的化合价都未发生改变 D、反应前后分子数目没有改变
A、乙的化学式为 B、整个反应过程中涉及到3种氧化物 C、反应前后各元素的化合价都未发生改变 D、反应前后分子数目没有改变 -
19、“手持技术”又称为掌上实验室,是由计算机和微电子技术相结合的新型数字化实验手段,主要包括:数据采集器、传感器、计算机及配套软件组成。某实验小组想利用温度传感器,通过测量等质量的(10g)NaOH、NaCl、NH4NO3溶解于水时溶液温度的变化,探求其变化的规律。
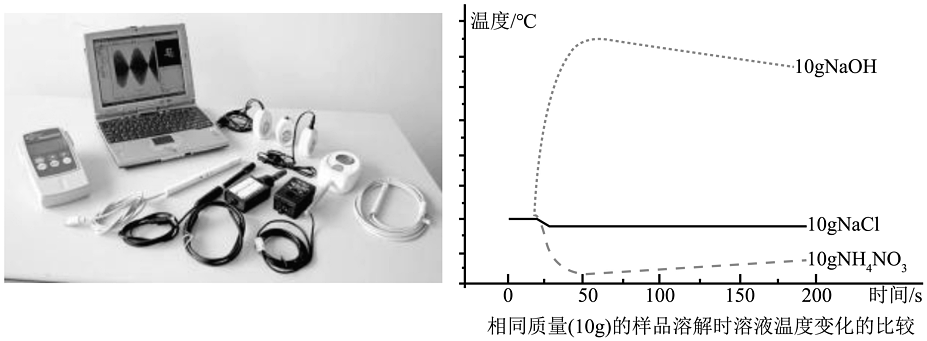
通过溶液相关知识和观察图像,下列说法错误的是
A、等质量的三种物质溶于水中NH4NO3使溶液温度降低 B、同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化 C、加入NaOH使溶液温度升高的原因是,溶质中离子扩散吸热 D、等质量的三种物质溶于水中NaCl溶液温度变化不大,但是略有降低 -
20、下列排列顺序正确的是A、净水的相对净化程度由低到高:蒸馏→吸附→过滤 B、硫元素化合价由低到高: C、地壳中元素含量由高到低: D、碳元素的质量分数由大到小: