-
1、A~E是初中化学常见的物质。B、C组成元素相同,A是气体单质,E是石灰石的主要成分,D、E均含同一种金属元素。它们之间的转化关系如图所示(“—”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质,部分物质和反应条件已略去)。
 (1)、A的化学式为。(2)、发生反应的化学方程式为;实验室常用该反应(填“检验”或“吸收”)C物质。(3)、反应的化学方程式为。(4)、B的一种用途是。(5)、的反应在自然界中称为。
(1)、A的化学式为。(2)、发生反应的化学方程式为;实验室常用该反应(填“检验”或“吸收”)C物质。(3)、反应的化学方程式为。(4)、B的一种用途是。(5)、的反应在自然界中称为。 -
2、中华传统文化中蕴藏着丰富的化学知识。(1)、用炭黑墨汁绘制的《清明上河图》久不褪色,原因是。(2)、活字印刷材料胶泥由等组成。胶泥在物质类别上属于(填“混合物”或“纯净物”)。(3)、毛笔笔杆常用竹管制作。竹管的主要成分为纤维素,化学式为 , 纤维素由种元素组成。(4)、《丹经》中记载,用硝石、硫黄、炭化的皂角经“伏火法”可制成火药,其爆炸发生反应的化学方程式是 , 则X为。
-
3、每年的3月22日是世界水日,水是人类宝贵的自然资源,根据所学知识回答下列问题:(1)、家用净水器利用活性炭的性,可在一定程度上净化水质。(2)、水的电解实验装置如图所示,请回答下列问题:

①量筒A收集到的气体是(填化学式);实验室检验该气体的方法是。
②若两只量筒规格均为10mL,接通电源一段时间后,小明观察到量筒B内液面下降至4mL处,则此时量筒A内液面下降至mL。
③在水中加入氢氧化钠的作用是。
④通过实验可以得出水是由(填名称)组成的。
-
4、建立宏观、微观和符号之间的联系是化学学科的特点。
 (1)、物质的组成及构成关系如图1所示,图中②表示的是。(2)、从宏观角度分析,水、二氧化碳和氧气三种物质的组成中都含有。(3)、氯化钠中含有的阳离子符号是。(4)、研究发现,氨气燃烧的产物没有污染且释放大量能量,其微观过程如图2所示。
(1)、物质的组成及构成关系如图1所示,图中②表示的是。(2)、从宏观角度分析,水、二氧化碳和氧气三种物质的组成中都含有。(3)、氯化钠中含有的阳离子符号是。(4)、研究发现,氨气燃烧的产物没有污染且释放大量能量,其微观过程如图2所示。①保持氨气化学性质的最小粒子是(填具体粒子名称)。
②写出微观反应的化学方程式:。
-
5、化学学科核心素养展现了化学课程对学生发展的重要价值,下列说法错误的是A、化学观念:化学变化常伴随着能量变化,生活中常见的物质燃烧都会放出热量 B、科学思维:稀有气体的原子都具有相对稳定结构,因此稀有气体的原子最外层一定有8个电子 C、科学探究与实践:在做氢气燃烧实验之前一定要验纯 D、科学态度与责任:实验后废液集中回收处理,防止污染环境
-
6、借助模型可以更好地认识物质的微观构成。下列模型可以用来表示“CO”的是A、
 B、
B、 C、
C、 D、
D、
-
7、关于碳循环和氧循环,下列说法错误的是A、碳循环和氧循环分别是指一氧化碳和氧气的循环 B、每个人都在参与碳、氧循环 C、绿色植物的生长过程,既涉及碳循环,又涉及氧循环 D、碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
-
8、化学是一门以实验为基础的学科。下列实验操作正确的是A、
 给液体加热
B、
给液体加热
B、 点燃酒精灯
C、
点燃酒精灯
C、 过滤
D、
过滤
D、 滴加液体
滴加液体
-
9、我们常喝的加钙牛奶中的“钙”是指A、单质 B、原子 C、分子 D、元素
-
10、洁净的空气对人类非常重要。下列气体不会污染空气的是A、水蒸气 B、一氧化碳 C、二氧化硫 D、二氧化氮
-
11、下列变化包含化学变化的是A、水分蒸发 B、液氮制冷 C、饭菜变馊 D、蔗糖溶水
-
12、下列实验操作错误的是A、
 过滤食盐水
B、
过滤食盐水
B、 测定溶液
C、
测定溶液
C、 滴管洗涤后插入原瓶
D、
滴管洗涤后插入原瓶
D、 称量氯化钠
称量氯化钠
-
13、《天工开物》中有“煤饼烧石成灰”的记载,“烧石成灰”是指高温煅烧石灰石(主要成分为)生成CaO和气体X。兴趣小组以石灰石为原料制备轻质碳酸钙的工艺如图所示。石灰石中含少量: , 不参加反应,也不溶于水。
 (1)、煅烧石灰石时,通常要将石灰石粉碎,这样做的目是。(2)、操作Ⅰ的名称为。气体X通入操作Ⅰ得到的滤液中,发生的反应(用化学方程式表示)。(3)、为测定该石灰石中碳酸钙的含量(碳酸钙占石灰石的质量百分数),兴趣小组取12.5g该石灰石样品,高温灼烧充分反应后,剩余固体质量为8.1g(杂质不发生反应)。请计算:该石灰石中碳酸钙的质量分数是多少?(写出计算过程)(4)、写出气体X在生活中的用途(写一条)
(1)、煅烧石灰石时,通常要将石灰石粉碎,这样做的目是。(2)、操作Ⅰ的名称为。气体X通入操作Ⅰ得到的滤液中,发生的反应(用化学方程式表示)。(3)、为测定该石灰石中碳酸钙的含量(碳酸钙占石灰石的质量百分数),兴趣小组取12.5g该石灰石样品,高温灼烧充分反应后,剩余固体质量为8.1g(杂质不发生反应)。请计算:该石灰石中碳酸钙的质量分数是多少?(写出计算过程)(4)、写出气体X在生活中的用途(写一条) -
14、
我国新能源汽车产业不仅推动了汽车技术的进步;也带动了相关产业链的发展。
Ⅰ.外观结构
化学材料在“新能源汽车”的推广中发挥着重要作用。
(1)车漆:汽车漆面保护膜采用TPU材料,能有效防止剐蹭、飞溅颗粒对车漆造成永久伤害。车身喷漆的防锈原理是。
(2)轮胎:汽车轮胎含有合成橡胶、炭黑和钢丝等材料,其中属于有机合成材料的是。
Ⅱ.动力转化
(3)电池为新能源汽车提供动力。依据图1甲,目前国内新能源汽车的电池多采用锂电池的主要原因是:(写一点)。

(4)磷酸亚铁锂电池常被用作动力源,请将制备原理补充完整:(填写化学式)。
Ⅲ.废料处理
废磷酸亚铁锂材料(主要成分为)的回收再利用工艺如图2。

(5)为高效回收锂,“酸浸”需提高锂元素浸出率,抑制磷元素、铁元素浸出率。如题图2甲,最佳反应温度为。
(6)沉锂:往浸出液(主要溶质为)中加饱和溶液,生成沉淀和另一种盐,化学方程式为。
(7)锂原子失去电子形成(填写微粒符号),锂、钠、钾等金属很容易失去电子,所以常被用作电池材料。研究表明,半径越大的金属离子越容易在电池正负极之间移动,充电速度越快。如图2乙,可得出结论:电池容量相同的这三种电池,充满电时间最短的是电池。
-
15、
松花蛋是我国特有的一种传统美食。化学兴趣小组同学进行了“松花蛋制作”的项目研究,请结合任务回答问题。
【任务一】初识松花蛋,查阅营养成分
(1)松花蛋,又称皮蛋,制作原料为鸡蛋,鸡蛋中富含的营养素为________,除此之外,还含有油脂、维生素及无机盐等多种营养素,具有较高的营养价值。【任务二】品尝松花蛋,感受松花蛋的酸碱性。
(2)同学们品尝松花蛋时,发现松花蛋略有涩味,推测松花蛋中含有碱性物质,生活中食用时可加入________(选填“料酒、食醋或酱油”)来减少涩味。【任务三】浸松花蛋粉,寻找涩味缘由
(3)取适量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌、过滤。向滤液中加入________溶液(填写指示剂名称),溶液变红证明滤液中含有碱性物质。【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱等。
【分析推理】
(4)松花蛋粉加水调和时发生如下反应:①;
②________
【提出猜想】
(5)猜想1:NaOH;猜想2:NaOH和;猜想3:NaOH和________(填化学式);(6)设计实验验证猜想实验方案
实验现象
实验结论
操作一:取少量滤液于试管中,向其中加入过量的稀盐酸
无明显实验现象
猜想________不成立
操作二:________
________
猜想2成立
【讨论交流】
(7)根据复分解反应发生的条件,操作1中除可用稀盐酸外,还可选用_______也能达到同样实验目的。A. 酸碱指示剂 B. 氯化钾溶液 C. 氢氧化钙溶液 D. 氯化钡溶液 -
16、加快能源转型升级,发展新质生产力。氢气是最理想的清洁能源,依据不同制取方式,可分为“绿氢”“灰氢”“蓝氢”“紫氢”和“金氢”等,如图带你认识“多彩”的氢。
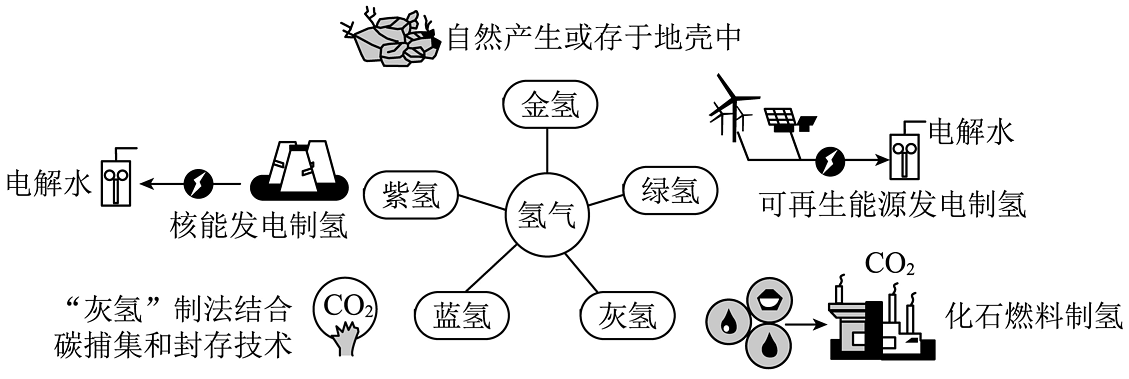
储氢是实现氢能广泛应用的重要环节,分为物理储氢和化学储氢,前者包括高压气态、低温液态、吸附等储存方式,后者将氢气转化为其他化合物进行储存。“液氨储氢”的原理是氢气与氮气在一定条件下生成氨气,进行储存。
(1)、下列选项,属于“绿氢”是_______(填字母)。A、煤燃烧发电制氢 B、风能发电制氢 C、核能发电制氢(2)、灰氢的制备过程发生的是(选填“物理”或“化学”)变化。(3)、“液氨储氢”的化学方程式。(4)、在电解水反应中,下面三个图出现的先后顺序是(填写字母)。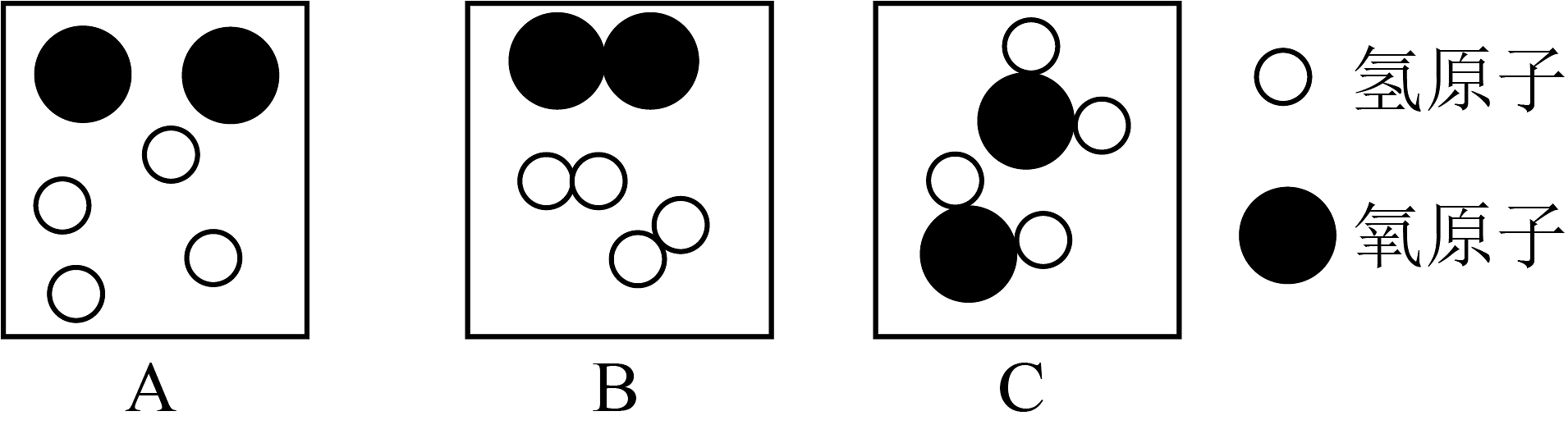 (5)、氢气燃烧发出色火焰,相比化石能源,氢能的优点有。
(5)、氢气燃烧发出色火焰,相比化石能源,氢能的优点有。 -
17、用三颈烧瓶收集一瓶 , 然后将三颈烧瓶与盛有盐酸、NaOH溶液的注射器和压强传感器密封连接(如图1)。检验气密性后,在时快速注入一种溶液,时快速注入第二种溶液,测得瓶内压强随时间变化曲线如图2,下列说法中正确的是
 A、时注入的溶液是盐酸 B、期间发生反应: C、后压强增大的原因是NaOH溶液与盐酸发生反应 D、期间压强不变且大于0可证明收集的气体不纯
A、时注入的溶液是盐酸 B、期间发生反应: C、后压强增大的原因是NaOH溶液与盐酸发生反应 D、期间压强不变且大于0可证明收集的气体不纯 -
18、下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
除去KCl中混有的固体
滴加过量溶液,过滤
B
鉴别CO和
分别通过灼热氧化铜
C
检验敞口放置的NaOH变质程度
加入适量溶液,过滤,向滤液加酚酞溶液,观察现象
D
除去中的少量HCl
通过盛有NaOH溶液的洗气瓶
A、A B、B C、C D、D -
19、和的溶解度曲线如图所示。下列说法正确的是
 A、溶质的质量分数大小比较: B、将饱和溶液从升温到无晶体析出 C、饱和溶液中溶质质量分数为37.5% D、混有少量的溶液,将其蒸发浓缩后降温结晶可提纯晶体
A、溶质的质量分数大小比较: B、将饱和溶液从升温到无晶体析出 C、饱和溶液中溶质质量分数为37.5% D、混有少量的溶液,将其蒸发浓缩后降温结晶可提纯晶体 -
20、下列实验方案设计合理的是A、
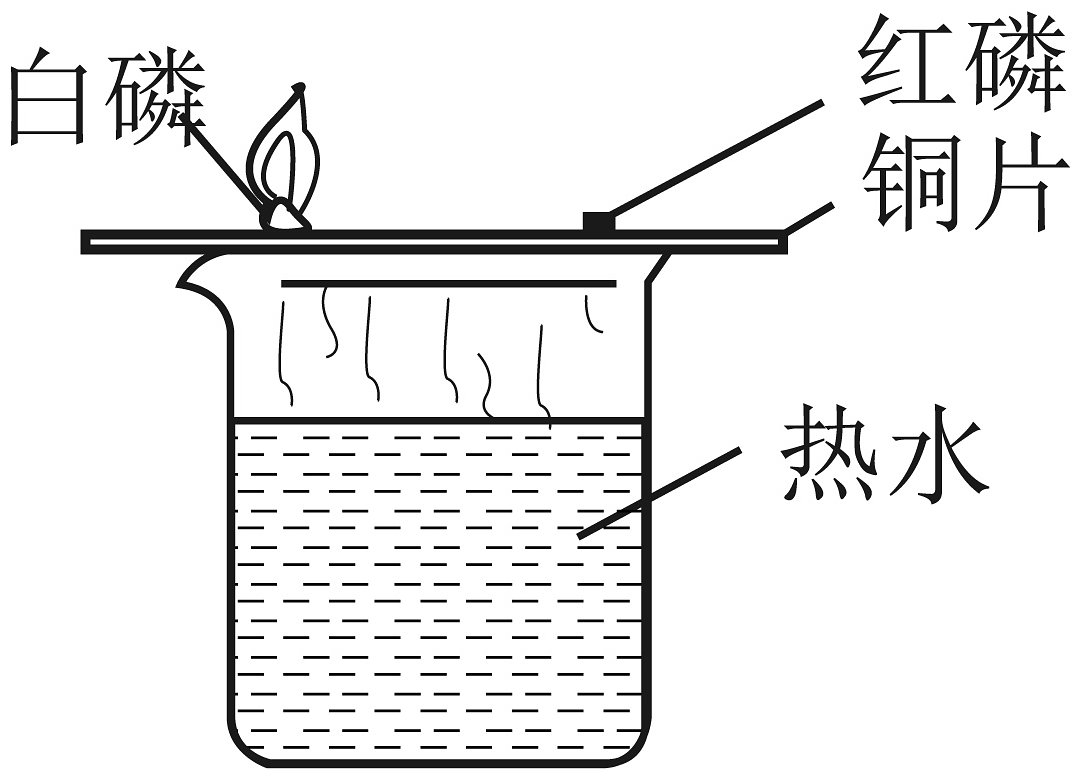 探究燃烧需要氧气
B、
探究燃烧需要氧气
B、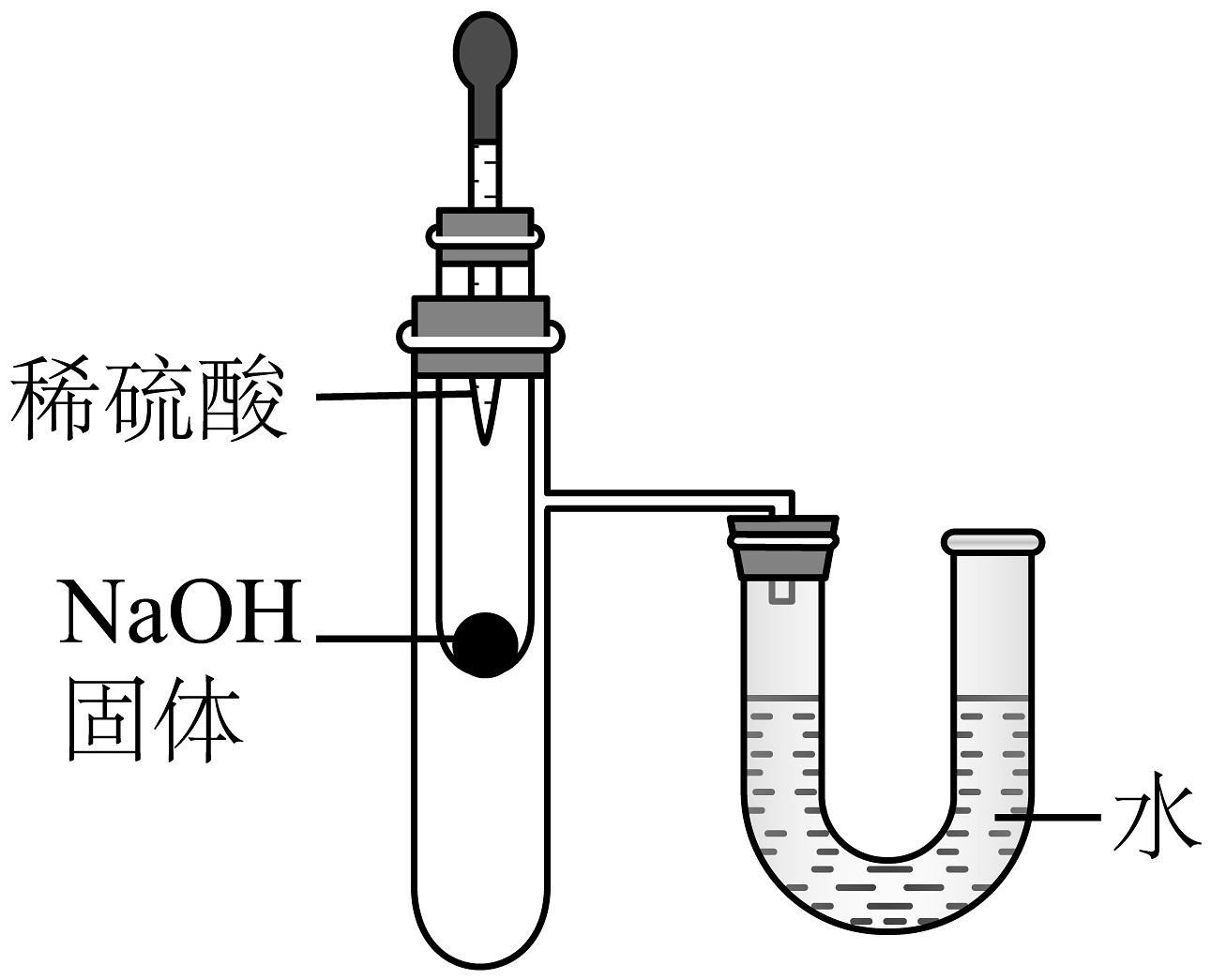 探究酸碱中和反应放热
C、
探究酸碱中和反应放热
C、 探究甲烷中含氢元素
D、
探究甲烷中含氢元素
D、 探究铁生锈的条件
探究铁生锈的条件