-
1、下列实验操作中,正确的是A、过滤泥水
 B、铁丝燃烧
B、铁丝燃烧 C、连接仪器
C、连接仪器 D、检查气密性
D、检查气密性
-
2、
某化学兴趣小组在老师的指导下进行课外实验,利用下列装置来探究磷单质在空气中燃烧后氧气浓度的变化情况。

【提出问题】足量红磷在密闭的四颈平底烧瓶内充分燃烧,熄灭后,容器中是否有氧气剩余?
【猜想假设】猜想一:有氧气剩余;猜想二:无氧气剩余。
【实验验证】该小组同学按如图1组装好实验装置,用高能激光笔分别照射燃烧匙上的红磷和白磷,红磷燃烧直至熄灭,白磷无明显变化;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷被点燃。
【实验结论】根据上述实验现象,得出如下结论
(1)结论1:猜想正确。
结论2:课本上“燃烧红磷测定空气中氧气含量”的方法是不严谨的,其理由是。
【拓展延伸】如图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图。
(2)在图中(选“A”、“B”、“C”、“D”或“E”)点时红磷燃烧停止。请你解释曲线DE段氧气浓度变化的主要原因。
(3)小组同学查看了实验过程中装置内的气压变化情况,发现红磷燃烧后虽然氧气被消耗,但装置内气压并没有立刻减小,而是先增大然后逐渐减小,请从微观角度解释气压先增大后减小的原因:。
(4)小组同学查阅资料得知,能够较精确地验证空气中氧气体积分数的药品是铁丝,利用铁的锈蚀(铁与氧气、水的缓慢氧化),可以将空气中的氧气浓度消耗至0.2%。将足量细铁丝绒固定于试管底部,并倒扣在装有水的烧杯中(如图3),一段时间后你将看到的现象是。
-
3、根据下列实验装置图,回答问题:

 (1)、写出图一中有标号仪器的名称:a。(2)、实验室用高锰酸钾制取氧气的发生装置应该选用图一中(填“装置字母”),选用C装置收集氧气,实验时发现水槽中的水变成了紫红色,可能的原因是;上述反应的文字表达式。(3)、实验室用B装置来制取氧气的文字表达式为。组装好仪器后,应先 , 若用装满水的F装置收集氧气,气体应从(填“长”或“短”)管通入。与图一中B装置相比,图二装置的优点是。(4)、利用过氧化氢分解产生氧气的原理,小玲自制了图三所示的家庭简易制氧机。
(1)、写出图一中有标号仪器的名称:a。(2)、实验室用高锰酸钾制取氧气的发生装置应该选用图一中(填“装置字母”),选用C装置收集氧气,实验时发现水槽中的水变成了紫红色,可能的原因是;上述反应的文字表达式。(3)、实验室用B装置来制取氧气的文字表达式为。组装好仪器后,应先 , 若用装满水的F装置收集氧气,气体应从(填“长”或“短”)管通入。与图一中B装置相比,图二装置的优点是。(4)、利用过氧化氢分解产生氧气的原理,小玲自制了图三所示的家庭简易制氧机。①利用可以抽拉的线绳,可以实现二氧化锰与过氧化氢溶液的接触与分离,这样设计的优点是(答一点)。
②若想监测产生氧气的气流速度,图三中有一处不足之处,改进措施是将(填“a”或“b”)端导管伸入水面下。
-
4、阅读下面科普短文。
葡萄酒的配料表中经常看到二氧化硫,二氧化硫有什么作用呢?
酿酒葡萄采摘后容易与空气中的氧气发生反应而腐烂变质。在低温环境下,添加二氧化硫作为保鲜剂可有效减缓酿酒葡萄的腐烂。4℃时采用不同浓度的二氧化硫对酿酒葡萄进行预处理,经过4周的储藏,酿酒葡萄的腐烂率如图所示。
葡萄酒的生产过程包括葡萄除梗、榨汁和葡萄汁发酵等步骤。葡萄汁的发酵由酵母菌来完成,但在发酵过程中会滋生某些杂菌,添加的二氧化硫作为灭菌剂可有效抑制这些杂菌的滋生。由于二氧化硫本身具有一定的毒性,在葡萄酒生产过程中应控制其用量。我国对葡萄酒中SO2最高限量的标准中要求,非甜型葡萄酒中SO2限量为250mg/L,甜型葡萄酒中SO2限量为400mg/L。
依据文章内容回答下列问题。
 (1)、葡萄腐烂变质的原因是。(2)、在低温(4℃)条件下,酿酒葡萄储存一周时,腐烂率最高的是______(填字母)。A、未添加SO2 B、添加低浓度SO2 C、添加高浓度SO2(3)、二氧化硫在葡萄汁发酵过程中起到的作用是。(4)、下列说法正确的是______(填字母)。A、葡萄汁发酵发生了化学变化 B、二氧化硫作为食品添加剂时应控制用量 C、在葡萄储存的4周内,高浓度SO2处理的葡萄腐烂率一定小于低浓度SO2处理的葡萄
(1)、葡萄腐烂变质的原因是。(2)、在低温(4℃)条件下,酿酒葡萄储存一周时,腐烂率最高的是______(填字母)。A、未添加SO2 B、添加低浓度SO2 C、添加高浓度SO2(3)、二氧化硫在葡萄汁发酵过程中起到的作用是。(4)、下列说法正确的是______(填字母)。A、葡萄汁发酵发生了化学变化 B、二氧化硫作为食品添加剂时应控制用量 C、在葡萄储存的4周内,高浓度SO2处理的葡萄腐烂率一定小于低浓度SO2处理的葡萄 -
5、“宏观、微观、符号”三重表征是化学独特的表示物质及其变化的方式。
 (1)、图1中X应填。(2)、图2中B为某原子结构示意图,则m的值为。(3)、图2A~D中属于同种元素的是。(填字母)(4)、图3是溴元素的有关信息,回答下列问题:
(1)、图1中X应填。(2)、图2中B为某原子结构示意图,则m的值为。(3)、图2A~D中属于同种元素的是。(填字母)(4)、图3是溴元素的有关信息,回答下列问题:
①溴元素位于元素周期表的第周期。
②溴元素与图2中的B、D元素化学性质相似,原因是。
(5)、新型催化剂利用光能将二氧化碳和氢气转化为甲烷,助力缓解全球变暖,反应如图所示:
①能保持甲物质化学性质的最小粒子是。(用粒子名称表示)
②写出该反应的文字表达式。
-
6、如图是工业上制取氧气的主要步骤。
 (1)、经过步骤A处理后的空气属于(填“纯净物”或“混合物”)。(2)、步骤C的原理是利用氮气和氧气的不同,将氮气和氧气分离开来。(3)、从微观角度:用“
(1)、经过步骤A处理后的空气属于(填“纯净物”或“混合物”)。(2)、步骤C的原理是利用氮气和氧气的不同,将氮气和氧气分离开来。(3)、从微观角度:用“ ”表示氮原子,“
”表示氮原子,“ ”表示氧原子。同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,如图可表示空气微观模型的是______(填标号)。 A、
”表示氧原子。同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,如图可表示空气微观模型的是______(填标号)。 A、 B、
B、 C、
C、
-
7、规范的实验操作是安全实验的前提和实验成功的保证,请回答下面的问题:(1)、量取液体读数时,视线要与量筒内液体保持水平,再读出数值;某学生量取液体,俯视读数为50mL,将液体倒出一部分后,仰视读数为40mL,则该同学实际倒出的液体体积10mL(选填“大于”或“小于”或“等于”)。(2)、用托盘天平称取9.5g(1g以下用游码)食盐固体,称量过程中发现指针向右偏转,这时要进行的操作是。如果某同学称量结束后才发现砝码放在了左盘,则他实际称取的食盐的质量是g。(3)、做硫在氧气中燃烧的实验时需要在集气瓶瓶底放少量水,作用是;做铁丝在氧气中燃烧的实验时也需要在集气瓶瓶底放少量水,作用是。
-
8、一种有趣的钟表式元素周期表如图所示,该钟表的整点时间小时数与对应元素的质子数相等。下列说法中正确的是
 A、2:00与12:00对应的两种元素化学性质相似 B、5:00对应的元素属于金属元素 C、9:00对应元素的原子易得到电子 D、10:00对应的元素位于元素周期表第三周期
A、2:00与12:00对应的两种元素化学性质相似 B、5:00对应的元素属于金属元素 C、9:00对应元素的原子易得到电子 D、10:00对应的元素位于元素周期表第三周期 -
9、推理是学习化学的一种重要方法,以下推理合理的是A、阳离子带正电荷,所以带正电荷的粒子一定是阳离子 B、因为水和过氧化氢的组成元素相同,所以它们的化学性质相同 C、物质发生化学变化时伴随有能量变化,所以有放热现象的变化一定是化学变化 D、化学反应前后原子种类不变,所以化学反应前后元素种类一定不变
-
10、下列反应中既不是化合反应,又不是分解反应的是A、加热高锰酸钾制氧气 B、木炭在氧气中燃烧 C、石蜡在空气中燃烧 D、红磷在空气中燃烧
-
11、下列对实验现象的描述错误的是A、木炭在氧气中燃烧发白光 B、铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁 C、红磷在空气中燃烧产生白烟 D、硫在空气中燃烧发出微弱的淡蓝色火焰
-
12、科学家受光合作用启发,在催化剂作用下,利用阳光将水、二氧化碳转化为氧气和异丙醇(C3H8O)燃料,构建了一个安全、高效的人工光合作用系统,统称“人工树叶”,装置如图:
 (1)、图中
(1)、图中 代表的是(选填序号①二氧化碳分子,②水分子)。 (2)、异丙醇中碳、氢、氧元素质量比为 , 异丙醇中碳元素的质量分数为。(3)、现有44g二氧化碳,则根据该反应,理论上可获得g异丙醇(已知二氧化碳中碳元素全部转移至异丙醇中)。
代表的是(选填序号①二氧化碳分子,②水分子)。 (2)、异丙醇中碳、氢、氧元素质量比为 , 异丙醇中碳元素的质量分数为。(3)、现有44g二氧化碳,则根据该反应,理论上可获得g异丙醇(已知二氧化碳中碳元素全部转移至异丙醇中)。 -
13、
纳米级Cu2O因具有优良的催化性能备受关注。某兴趣小组开展了系列研究。
I.纳米级Cu2O的用途研究
【查阅资料】
①氨气是一种有刺激性气味的气体,在高浓度氧气中才能燃烧,生成氮气和水。
②在纳米级Cu2O的催化作用下,氨气与氧气在一定温度下发生以下化学反应生成NO,工业上用NO制备硝酸、氮肥等化工产品。
【实验1】
(1)设计图1的实验装置验证氨气在氧气中燃烧:将过量的氧气与氨气分别从a、b两管进气口通入,并在b管上端点燃氨气。实验组需先通入氧气,后通入氨气,理由是。
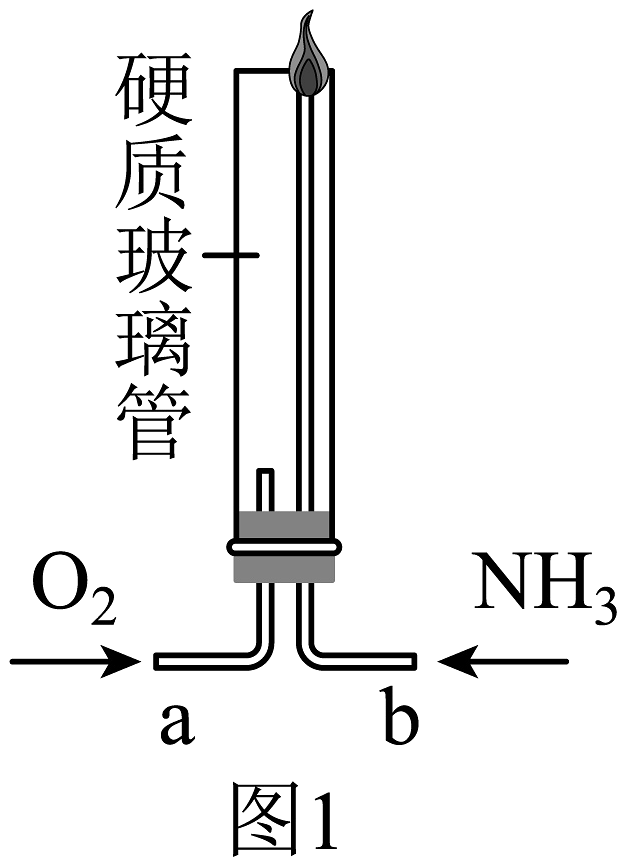
【实验2】
(2)设计如图2实验装置,根据气体成分分析数据,同学们绘制了曲线图(见图3),发现在纳米级Cu2O的催化作用下,300℃时以生产为主。若利用后续处理装置模拟硝酸的工业制法,最好将电热丝的温度控制在℃左右。

Ⅱ.纳米级Cu2O的制备研究
利用某些特殊的细菌,在一定条件下将某岩石中的不溶性硫化铜(CuS)转化为可溶性硫化铜,进得纳米级Cu2O,其流程如图4:

(3)在细菌作用下,岩石中的硫化铜(CuS)与空气中的氧气反应生成硫酸铜,反应的符号表达式为。
(4)物质所含元素化合价发生改变的反应称为氧化还原反应,在图4流程中,主要反应属于氧化还原反应的步骤是(填序号),Cu2O中铜元素的化合价是。
(5)经测定该岩石由硫化铜(CuS)和其他不含铜元素的物质组成。现用2000g该岩石制得43.2g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是g。
-
14、
学习了二氧化锰对过氧化氢分解有催化作用的知识后,我们对催化剂已有了初步的认识。
某同学想:氧化铜(CuO)能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
【猜想】
(1)I.氧化铜不是催化剂,也不参与反应,反应前后质量和化学性质不变。
II.氧化铜参与反应产生氧气,反应前后质量和化学性质发生改变。
III.氧化铜是反应的催化剂,反应前后________。
【实验】
用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:

【结论】猜想III成立。
(2)请补充能证明猜想Ⅲ成立的实验现象:步骤③现象为________,步骤③的目的是________,步骤⑥中固体质量为________g。
(3)步骤⑦的目的是________。
(4)过氧化氢能被CuO催化分解放出O2的符号表达式为________。
【拓展探究】
(5)欲比较催化剂氧化铜和二氧化锰对过氧化氢分解速率的影响,实验时需要控制相同的量有_______(填字母序号)。
A. 过氧化氢溶液的浓度、体积 B. 过氧化氢溶液的温度 C. 催化剂的质量 D. 催化剂的种类 -
15、某兴趣小组根据如图所示装置进行试验,请你参与并回答:
 (1)、写出标号仪器的名称:①;②。(2)、实验室选用装置C制取氧气的符号表达式 , 若要收集纯净的氧气做铁丝燃烧实验,选择的收集装置为 , 铁丝燃烧的符号表达式为。(3)、若用A装置制氧气,首先利用注射器可以检查装置A的气密性。如图E所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢向外拉动,若观察到 , 则装置不漏气。发生装置还可选用B,相对于A而言,B的优点是。(4)、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用装置制取甲烷,收集气体时可选用。(5)、实验室制取气体时,下列因素中不需要考虑的是______(填字母)。A、药品易得,且含有要制备气体的组成元素 B、反应条件易于控制,反应速率适中 C、操作简便易行,安全可靠,节能环保 D、所要制取气体是否溶于水
(1)、写出标号仪器的名称:①;②。(2)、实验室选用装置C制取氧气的符号表达式 , 若要收集纯净的氧气做铁丝燃烧实验,选择的收集装置为 , 铁丝燃烧的符号表达式为。(3)、若用A装置制氧气,首先利用注射器可以检查装置A的气密性。如图E所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢向外拉动,若观察到 , 则装置不漏气。发生装置还可选用B,相对于A而言,B的优点是。(4)、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用装置制取甲烷,收集气体时可选用。(5)、实验室制取气体时,下列因素中不需要考虑的是______(填字母)。A、药品易得,且含有要制备气体的组成元素 B、反应条件易于控制,反应速率适中 C、操作简便易行,安全可靠,节能环保 D、所要制取气体是否溶于水 -
16、
如图为工业上以空气、煤等为原料经过一定步骤合成尿素的流程图(部分产物已略去)。

第一步:分离空气的常用方法有以下两种:
方法I.将空气液化后再气化。
(1)分离液态空气法利用氧气和氮气的________不同,液态空气汽化时首先分离出________。
方法II.用碳分子筛分离。


【查阅资料】
①在同等条件下,碳分子筛对不同气体的吸附强度不同,如图2所示;
②碳分子筛可以再生,能重复使用。
(2)根据图2所示,被吸附的气体主要是________,要增强碳分子筛的吸附能力,可采取的方法________。
(3)对于该工艺的说法准确的是______(填字母序号)。
A. 碳分子筛再生的方法是降低吸附塔压强,利用N2吹扫,使被吸附气体和碳分子筛分离 B. 相对于分离液态空气,该工艺的优点是无需将空气液化 C. 碳分子筛可以重复使用,成本低廉 第二步:合成尿素:
(4)流程图中步骤②的反应属于________(填基本反应类型)反应;
(5)根据流程图推断尿素中一定有的元素是________。
-
17、太湖是无锡的亮眼的名片。(1)、验水:太湖水属于(选填“混合物”或“纯净物”)。检验太湖水是硬水还是软水,可选用的试剂是。(2)、探水:电解水实验中生成的两种气体的体积与时间的关系如图1所示,其中表示氢气的是(选填“a”或“b”),写出电解水的符号表达式。该反应证明水由组成。
 (3)、净水:图2是可将太湖水净化为饮用水的简易装置。
(3)、净水:图2是可将太湖水净化为饮用水的简易装置。①活性炭层的作用是。
②过滤须考虑过滤器材质孔径大小。某微粒的直径为10μm,装置中能把该微粒“筛”出来的是(填字母)
A.孔径20μm过滤网 B.孔径10μm过滤网 C.孔径6μm过滤网
-
18、中国计划在2060年实现“碳中和”,彰显了大国担当。资源化利用CO2是实现“碳中和”的重要途径。如图是CO2转化为甲醇(CH3OH)的微观示意图,请回答:
 (1)、该反应前后共有种化合物。(2)、写出该反应的符号表达式。(3)、该反应中发生变化的粒子是(填“分子”或“原子”)。
(1)、该反应前后共有种化合物。(2)、写出该反应的符号表达式。(3)、该反应中发生变化的粒子是(填“分子”或“原子”)。 -
19、“笔、墨、纸、砚”被称为文房四宝,承载着优秀的中华传统文化。(1)、狼毫笔,笔杆常用竹管制作。竹管的主要成分为纤维素,化学式为(C6H10O5)n , 纤维素由种元素组成。(2)、朱砂墨,由朱砂等原料制成,朱砂其化学成分是硫化汞(HgS),硫化汞炼汞的原理HgS+O2Hg+X,X的化学式为。(3)、宣纸,制作宣纸时,有道工序是用竹帘从纸浆中“捞纸”,“捞纸”相当于下列操作中的(填字母)。
a.蒸馏 b.过滤 c.吸附 d.沉淀
(4)、端砚,清洗砚台不宜用硬物大力擦拭,说明制作砚台的材料具有的性质是。 -
20、分类是学习化学的一种重要方法。请按照要求将以下物质进行分类:①汞、②洁净的空气、③冰水混合物、④澄清石灰水、⑤二氧化碳、⑥硫酸铜、⑦液氧、⑧氯化钠。(1)、属于混合物的是(填序号,下同)。(2)、属于单质的是。(3)、属于氧化物的是。(4)、由分子构成的是。(5)、由离子构成的是。