-
1、
纳米级Cu2O因具有优良的催化性能备受关注。某兴趣小组开展了系列研究。
I.纳米级Cu2O的用途研究
【查阅资料】
①氨气是一种有刺激性气味的气体,在高浓度氧气中才能燃烧,生成氮气和水。
②在纳米级Cu2O的催化作用下,氨气与氧气在一定温度下发生以下化学反应生成NO,工业上用NO制备硝酸、氮肥等化工产品。
【实验1】
(1)设计图1的实验装置验证氨气在氧气中燃烧:将过量的氧气与氨气分别从a、b两管进气口通入,并在b管上端点燃氨气。实验组需先通入氧气,后通入氨气,理由是。
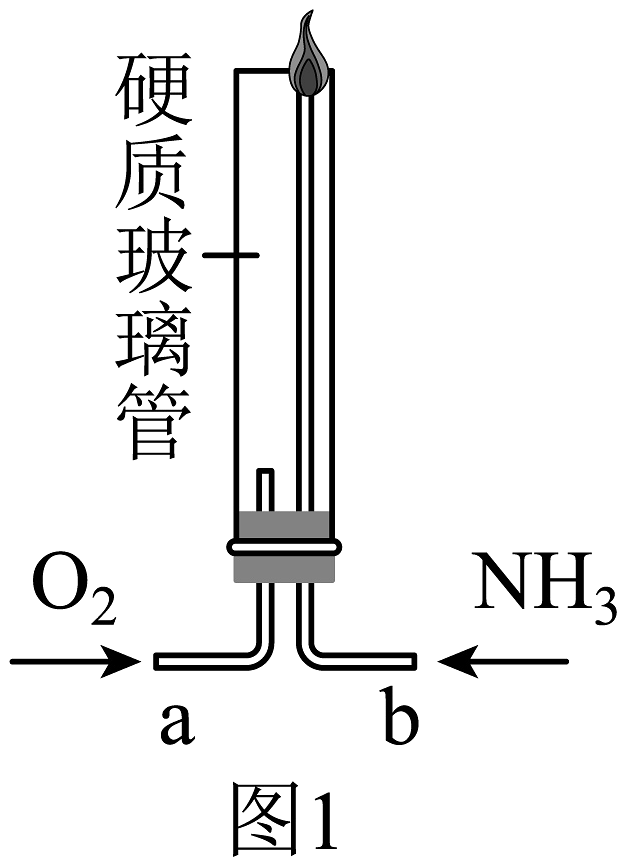
【实验2】
(2)设计如图2实验装置,根据气体成分分析数据,同学们绘制了曲线图(见图3),发现在纳米级Cu2O的催化作用下,300℃时以生产为主。若利用后续处理装置模拟硝酸的工业制法,最好将电热丝的温度控制在℃左右。

Ⅱ.纳米级Cu2O的制备研究
利用某些特殊的细菌,在一定条件下将某岩石中的不溶性硫化铜(CuS)转化为可溶性硫化铜,进得纳米级Cu2O,其流程如图4:

(3)在细菌作用下,岩石中的硫化铜(CuS)与空气中的氧气反应生成硫酸铜,反应的符号表达式为。
(4)物质所含元素化合价发生改变的反应称为氧化还原反应,在图4流程中,主要反应属于氧化还原反应的步骤是(填序号),Cu2O中铜元素的化合价是。
(5)经测定该岩石由硫化铜(CuS)和其他不含铜元素的物质组成。现用2000g该岩石制得43.2g纯氧化亚铜(Cu2O),该纯氧化亚铜(Cu2O)中铜元素的质量是g。
-
2、
学习了二氧化锰对过氧化氢分解有催化作用的知识后,我们对催化剂已有了初步的认识。
某同学想:氧化铜(CuO)能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
【猜想】
(1)I.氧化铜不是催化剂,也不参与反应,反应前后质量和化学性质不变。
II.氧化铜参与反应产生氧气,反应前后质量和化学性质发生改变。
III.氧化铜是反应的催化剂,反应前后________。
【实验】
用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:

【结论】猜想III成立。
(2)请补充能证明猜想Ⅲ成立的实验现象:步骤③现象为________,步骤③的目的是________,步骤⑥中固体质量为________g。
(3)步骤⑦的目的是________。
(4)过氧化氢能被CuO催化分解放出O2的符号表达式为________。
【拓展探究】
(5)欲比较催化剂氧化铜和二氧化锰对过氧化氢分解速率的影响,实验时需要控制相同的量有_______(填字母序号)。
A. 过氧化氢溶液的浓度、体积 B. 过氧化氢溶液的温度 C. 催化剂的质量 D. 催化剂的种类 -
3、某兴趣小组根据如图所示装置进行试验,请你参与并回答:
 (1)、写出标号仪器的名称:①;②。(2)、实验室选用装置C制取氧气的符号表达式 , 若要收集纯净的氧气做铁丝燃烧实验,选择的收集装置为 , 铁丝燃烧的符号表达式为。(3)、若用A装置制氧气,首先利用注射器可以检查装置A的气密性。如图E所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢向外拉动,若观察到 , 则装置不漏气。发生装置还可选用B,相对于A而言,B的优点是。(4)、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用装置制取甲烷,收集气体时可选用。(5)、实验室制取气体时,下列因素中不需要考虑的是______(填字母)。A、药品易得,且含有要制备气体的组成元素 B、反应条件易于控制,反应速率适中 C、操作简便易行,安全可靠,节能环保 D、所要制取气体是否溶于水
(1)、写出标号仪器的名称:①;②。(2)、实验室选用装置C制取氧气的符号表达式 , 若要收集纯净的氧气做铁丝燃烧实验,选择的收集装置为 , 铁丝燃烧的符号表达式为。(3)、若用A装置制氧气,首先利用注射器可以检查装置A的气密性。如图E所示,在锥形瓶内装适量的水,使长颈漏斗末端浸没在液面以下,将活塞缓慢向外拉动,若观察到 , 则装置不漏气。发生装置还可选用B,相对于A而言,B的优点是。(4)、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用装置制取甲烷,收集气体时可选用。(5)、实验室制取气体时,下列因素中不需要考虑的是______(填字母)。A、药品易得,且含有要制备气体的组成元素 B、反应条件易于控制,反应速率适中 C、操作简便易行,安全可靠,节能环保 D、所要制取气体是否溶于水 -
4、
如图为工业上以空气、煤等为原料经过一定步骤合成尿素的流程图(部分产物已略去)。

第一步:分离空气的常用方法有以下两种:
方法I.将空气液化后再气化。
(1)分离液态空气法利用氧气和氮气的________不同,液态空气汽化时首先分离出________。
方法II.用碳分子筛分离。


【查阅资料】
①在同等条件下,碳分子筛对不同气体的吸附强度不同,如图2所示;
②碳分子筛可以再生,能重复使用。
(2)根据图2所示,被吸附的气体主要是________,要增强碳分子筛的吸附能力,可采取的方法________。
(3)对于该工艺的说法准确的是______(填字母序号)。
A. 碳分子筛再生的方法是降低吸附塔压强,利用N2吹扫,使被吸附气体和碳分子筛分离 B. 相对于分离液态空气,该工艺的优点是无需将空气液化 C. 碳分子筛可以重复使用,成本低廉 第二步:合成尿素:
(4)流程图中步骤②的反应属于________(填基本反应类型)反应;
(5)根据流程图推断尿素中一定有的元素是________。
-
5、太湖是无锡的亮眼的名片。(1)、验水:太湖水属于(选填“混合物”或“纯净物”)。检验太湖水是硬水还是软水,可选用的试剂是。(2)、探水:电解水实验中生成的两种气体的体积与时间的关系如图1所示,其中表示氢气的是(选填“a”或“b”),写出电解水的符号表达式。该反应证明水由组成。
 (3)、净水:图2是可将太湖水净化为饮用水的简易装置。
(3)、净水:图2是可将太湖水净化为饮用水的简易装置。①活性炭层的作用是。
②过滤须考虑过滤器材质孔径大小。某微粒的直径为10μm,装置中能把该微粒“筛”出来的是(填字母)
A.孔径20μm过滤网 B.孔径10μm过滤网 C.孔径6μm过滤网
-
6、中国计划在2060年实现“碳中和”,彰显了大国担当。资源化利用CO2是实现“碳中和”的重要途径。如图是CO2转化为甲醇(CH3OH)的微观示意图,请回答:
 (1)、该反应前后共有种化合物。(2)、写出该反应的符号表达式。(3)、该反应中发生变化的粒子是(填“分子”或“原子”)。
(1)、该反应前后共有种化合物。(2)、写出该反应的符号表达式。(3)、该反应中发生变化的粒子是(填“分子”或“原子”)。 -
7、“笔、墨、纸、砚”被称为文房四宝,承载着优秀的中华传统文化。(1)、狼毫笔,笔杆常用竹管制作。竹管的主要成分为纤维素,化学式为(C6H10O5)n , 纤维素由种元素组成。(2)、朱砂墨,由朱砂等原料制成,朱砂其化学成分是硫化汞(HgS),硫化汞炼汞的原理HgS+O2Hg+X,X的化学式为。(3)、宣纸,制作宣纸时,有道工序是用竹帘从纸浆中“捞纸”,“捞纸”相当于下列操作中的(填字母)。
a.蒸馏 b.过滤 c.吸附 d.沉淀
(4)、端砚,清洗砚台不宜用硬物大力擦拭,说明制作砚台的材料具有的性质是。 -
8、分类是学习化学的一种重要方法。请按照要求将以下物质进行分类:①汞、②洁净的空气、③冰水混合物、④澄清石灰水、⑤二氧化碳、⑥硫酸铜、⑦液氧、⑧氯化钠。(1)、属于混合物的是(填序号,下同)。(2)、属于单质的是。(3)、属于氧化物的是。(4)、由分子构成的是。(5)、由离子构成的是。
-
9、化学用语是学习化学的重要工具,是国际通用的化学语言,请用化学用语填空。(1)、保持氮气化学性质的最小粒子是。(2)、两个铵根离子。(3)、标出硫酸铜中硫元素的化合价。(4)、氦气。(5)、已知氯酸钾的化学式为KClO3 , 则氯酸的化学式是。
-
10、近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如图所示:
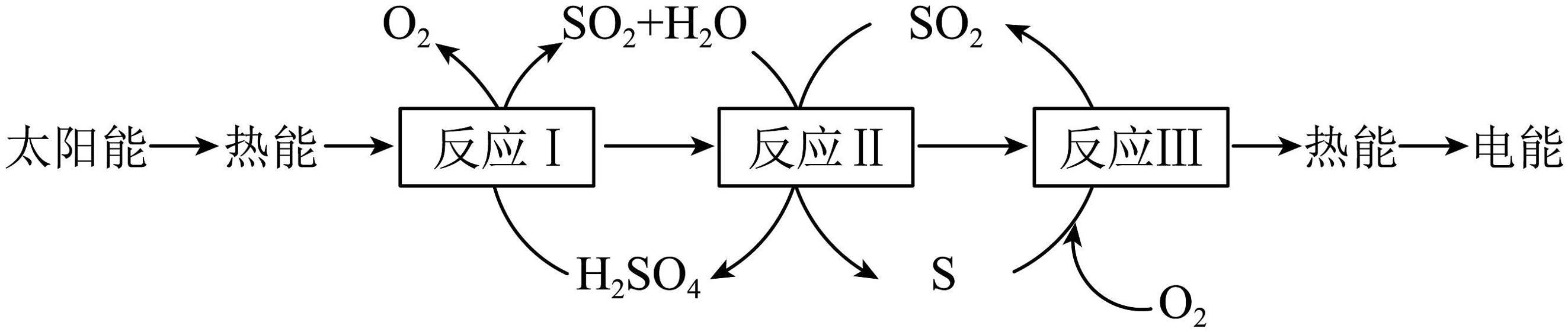
下列说法不正确的是
A、反应I为化合反应,反应Ⅲ为分解反应 B、在催化剂条件下,反应Ⅱ的表达式是 C、在点燃的条件下,反应Ⅲ生成二氧化硫并放出热量 D、反应I中有三种物质生成 -
11、如图装置是用透明笔管和笔帽探究微粒性质的微型实验。下列关于此实验的说法中不正确的是
 A、酚酞溶液从左至右同时变红 B、实验证明微粒是不停运动的 C、该实验的优点是节约和环保 D、热纸巾捂住笔帽能加速实验
A、酚酞溶液从左至右同时变红 B、实验证明微粒是不停运动的 C、该实验的优点是节约和环保 D、热纸巾捂住笔帽能加速实验 -
12、下列实验设计正确的是A、用托盘天平称取5.62g蔗糖 B、用10mL量筒量取4.82mL水 C、用带火星的小木条鉴别氧气和氮气 D、用品尝的方法区分糖水和石灰水
-
13、某同学用量筒量取液体:量筒放在水平桌面上,面对刻度,仰视液体凹液面最低处读数为19mL,倒出一部分液体后,又俯视凹液面最低处读数为9mL,这位同学取出液体的体积是A、10mL B、小于10mL C、大于10mL D、无法判断
-
14、下列物质的用途中,主要利用其物理性质的是A、氧气用于切割金属 B、氮气用作粮食保护气 C、氢气用于火箭燃料 D、稀有气体通电发出不同颜色光
-
15、化学概念间有包含、并列、交叉等不同关系。下列选项符合如图所示关系的是

A
B
C
D
X
化合反应
氧化物
物理变化
化学反应
Y
氧化反应
化合物
化学变化
化合反应
A、A B、B C、C D、D -
16、下列有关物质燃烧现象的描述正确的是A、木炭在氧气中燃烧,发出白光 B、铁丝在氧气中燃烧火星四射,有四氧化三铁黑色固体生成 C、磷在氧气中燃烧,产生大量白雾 D、硫在空气中燃烧,火焰呈明亮的蓝紫色,生成有刺激性气味的气体
-
17、下列错误的实验操作,不会引发安全事故的是A、
 闻气体气味
B、
闻气体气味
B、 点燃酒精灯
C、
点燃酒精灯
C、 加热液体
D、
加热液体
D、 称量药品
称量药品
-
18、用如图所示装置制取干燥的CO2。
 (1)、装置A中,盛放稀盐酸的仪器的名称是 , 装置A中发生反应的化学方程式为。(2)、装置B中饱和NaHCO3溶液的作用是。(3)、装置C中试剂X应该选用 (填字母)。A、稀H2SO4 B、浓H2SO4 C、NaOH溶液
(1)、装置A中,盛放稀盐酸的仪器的名称是 , 装置A中发生反应的化学方程式为。(2)、装置B中饱和NaHCO3溶液的作用是。(3)、装置C中试剂X应该选用 (填字母)。A、稀H2SO4 B、浓H2SO4 C、NaOH溶液 -
19、甲酸(HCOOH)在热的浓硫酸催化下可发生分解反应产生一氧化碳和水。某同学利用下图装置进行了相关实验,下列说法不正确的是
 A、可用注射器代替长颈漏斗添加甲酸 B、气球用于收集有害气体,防止空气污染 C、硬质玻璃管内可观察到黑色粉末逐渐变红 D、浓硫酸在反应前后的质量和性质不变
A、可用注射器代替长颈漏斗添加甲酸 B、气球用于收集有害气体,防止空气污染 C、硬质玻璃管内可观察到黑色粉末逐渐变红 D、浓硫酸在反应前后的质量和性质不变 -
20、为测定某Na2CO3溶液的溶质质量分数,化学小组的同学取Na2CO3溶液100g,向其中滴加一定浓度的CaCl2溶液,至不再产生沉淀为止,共用去CaCl2溶液50g。过滤,得到滤液145g。请计算:
(1)该反应生成沉淀 g;
(2)该Na2CO3溶液中溶质的质量分数。 (提示:Na2CO3+CaCl2=CaCO3↓+2NaCl)