-
1、俗语中常常蕴含着丰富的化学知识。下列俗语涉及化学变化的是A、铁杵磨成针 B、众人拾柴火焰高 C、摸着石头过河 D、秋风扫落叶
-
2、氢能源是最理想的“绿色能源”之一。我国氢能源的发展规划分为“灰氢”、“蓝氢”和“绿氢”三个阶段,具体如下图所示。

回答下列问题:
(1)、煤炭生成“灰氢”属于(填“物理变化”或“化学变化”)。(2)、在制备“绿氢”中,利用风力发电电解水制备氢气,其化学方程式为 , 若产生1000L氢气,能同时得到L的氧气。(3)、通过反应制备“蓝氢”,若制取4t氢气,理论上需要的质量为多少?(写出计算过程)(4)、是一种储氢材料,完全吸氢后得到和 , 单位质量的分解释放出氢气的质量随时间的变化如图2所示,其中温度、、由小到大的顺序是。
-
3、氨气是合成氮肥的重要原料,如图1所示是合成氨的新方法。
 (1)、i、传统方法是利用氮气和氢气在高温高压条件下生成氨气,该反应的化学方程式为。
(1)、i、传统方法是利用氮气和氢气在高温高压条件下生成氨气,该反应的化学方程式为。ii.反应器2:常温下,与发生的化学方程式为 , 反应前后氮元素的化合价(填“升高”“降低”或“不变”)。
iii.反应器3:一定条件下,可与发生反应产生和氢氧化锂,其中与的分子个数比为。
iv.氨气产率随反应所用电压的变化如图2所示,电压为V氨气产率最高。
(2)、流程中可循环利用的物质是 , 与传统方法相比,新方法的优点有(写一条)。 -
4、
为验证质量守恒定律,某兴趣小组做了以下实验进行探究。
【实验一】将水加入酒精中,一段时间后,称量混合液,质量仍为。
(1)该实验________(填“能”或“不能”)验证质量守恒定律,原因是________。
【实验二】如图1,用细铜丝吊着一根长玻璃棒,两端分别绕上粗铜丝,并使玻璃棒保持水平,然后用酒精灯给a端铜丝加热1~2分钟。

(2)冷却后,观察到铜丝变黑、玻璃棒________(填“a”或“b”)端下沉。
【实验三】称取镁条和陶土网的质量为(如图2所示),然后在空气中点燃镁条;反应结束后将所得物质与陶土网一起再次称量,质量为。
(3)写出镁条燃烧的化学方程式________。
(4)根据质量守恒定律可知:生成氧化镁的质量大于参加反应的镁条的质量;而实验事实是 , 可能原因是________。
【分析与总结】
(5)根据以上实验可知,验证质量守恒定律时对于有气体参加的反应,应在________容器中进行实验。
【拓展实验】
兴趣小组按如图3装置改进实验,验证了质量守恒定律,却发现产物白色固体中还有少量黄色固体。查阅资料得知:镁能与氮气剧烈反应生成黄色的氮化镁固体。
【反思与交流】
(6)空气中的含量远大于的含量,而镁条在空气中燃烧生成的却远多于 , 原因是________。
(7)图3实验中气球的作用有_____(填字母)。
A. 使装置密闭 B. 可缓冲气压 C. 防止橡皮塞被弹飞 -
5、下图是实验室常用的实验仪器与装置,回答下列问题。
 (1)、写出图中仪器I的名称:。(2)、实验室用高锰酸钾制取较纯净的氧气,应选择的发生和收集装置为 , 该反应的化学方程式为 , 最终收集到的氧气不纯的原因可能是;如用F装置来收集,氧气应从(填“a”或“b”)管通入。(3)、收集一瓶并进行性质检验。
(1)、写出图中仪器I的名称:。(2)、实验室用高锰酸钾制取较纯净的氧气,应选择的发生和收集装置为 , 该反应的化学方程式为 , 最终收集到的氧气不纯的原因可能是;如用F装置来收集,氧气应从(填“a”或“b”)管通入。(3)、收集一瓶并进行性质检验。操作
现象
结论

硫燃烧时,(填字母),生成刺激性气味的气体
a.产生大量白烟
b.发出淡蓝色火焰
c.发出蓝紫色火焰
具有氧化性
集气瓶中水的作用是。
(4)、我国新型战略核潜艇具备相当强的水下续航和高速航行能力,为了探究潜艇用制氧器,小亮以爆炸盐(溶于水会产生和)和为原料设计了以右图所示简易装置: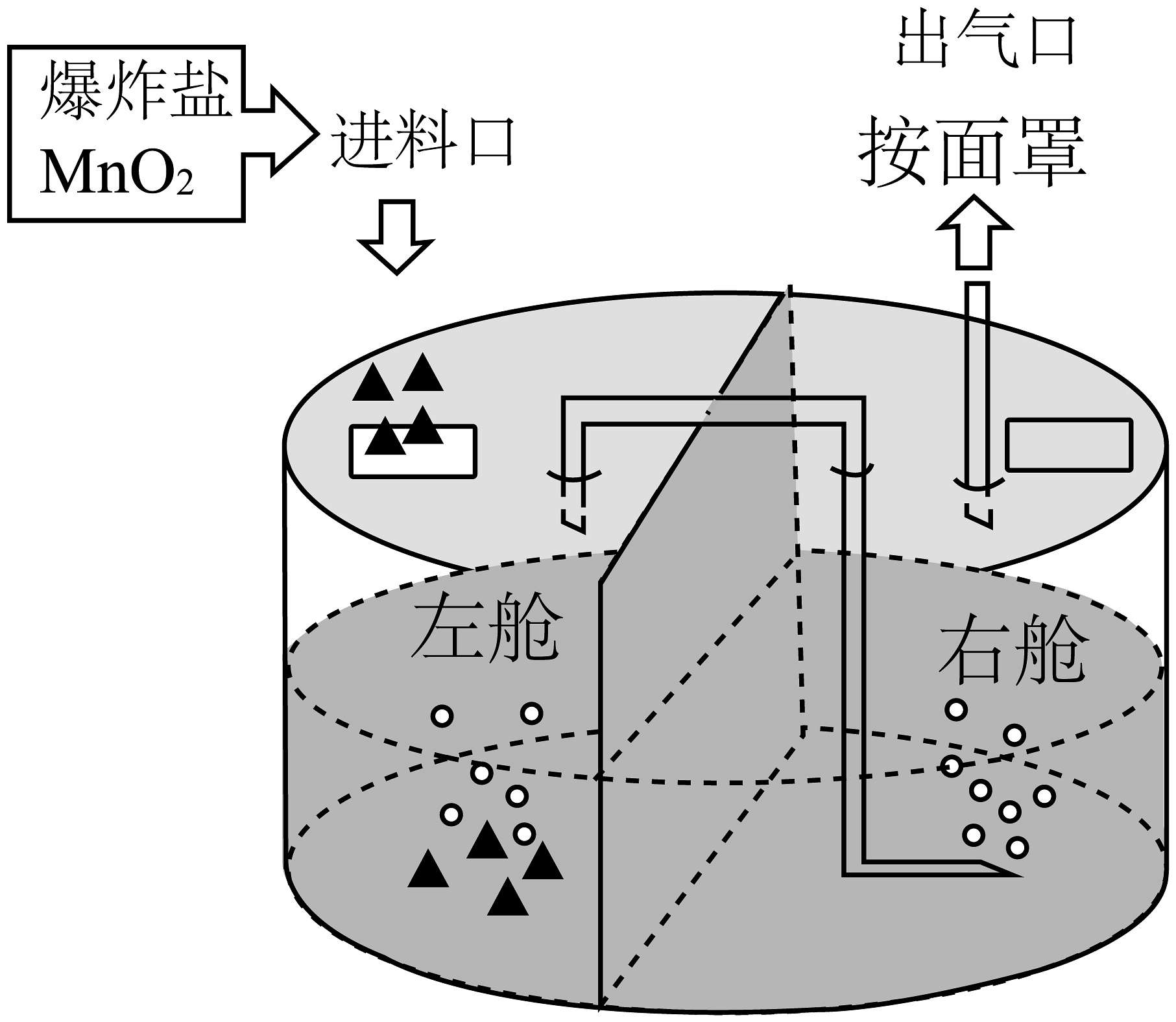
加料后,在反应中起作用。右舱中水的作用是(答出一个即可)。
-
6、二氧化氯是一种广谱、高效、无毒的杀菌剂,在污水处理、水产、食品加工等行业广泛应用。
工业生产中一般是用还原剂将氯酸钠等还原成 , 常见的还原剂有二氧化硫、盐酸、氯化钠、甲醇等,但均需在高酸度条件下反应,对设备要求较高,同时副产大量 , 产品纯度不高,后续处理费用较大。

用过氧化氢作还原剂,产品纯度高、反应速率快,并且副产氧气。现今正研究温度、压力、酸度以及和氯酸钠的质量比等对作还原剂生产的影响。其中温度对氯酸钠转化率和二氧化氯收率的影响如图所示。
实验表明,用作还原剂,在一定条件下能保证纯度100%的同时,氯酸钠的转化率大于88%,的收率在90%以上,解决以往各种方法中纯度、氯酸钠的转化率和收率不可兼得的问题。
依据文章内容回答下列问题:
(1)、二氧化氯()中氯元素的化合价为。(2)、现有的生产方法存在的问题有(写一条)。(3)、甲醇()中碳元素和氢元素的质量比为。(4)、用过氧化氢还原氯酸钠发生的反应,其化学方程式如下: , 由此推测X的化学式为;过氧化氢可用于实验室制取氧气,其化学方程式是。(5)、实验数据表明,温度对氯酸钠转化率的影响是。(6)、依据图像综合考虑,用过氧化氢作还原剂制备应选择的温度是。 -
7、鉴照古今变化,传承奋进力量。
 (1)、出行——明朝末年从南昌到北京约需半年时间,如今乘坐高铁几小时便可到达,制造高铁使用的铝合金中的铝由(选填“分子”、“原子”或“离子”)构成。(2)、记录——古代用墨书写的典籍保存至今也不变色,如今可将信息存储在芯片上,芯片中含有的某元素在元素周期表中的部分信息如图1所示,该元素的名称是 , 其相对原子质量为。(3)、净水——明代《天工开物》一书记载了明矾净水,钾原子的结构示意图如图2所示,钾原子易(填“得到”或“失去”)电子,写出明矾中钾离子的符号是;如今使用高铁酸钾()不仅能净水,还能消毒,其中高铁酸钾由种金属元素组成。(4)、工具:“一尺之棰,日取其半,万世不竭”是古代人对物质构成奥秘的表达;如今可以借助各种精密仪器探索,通过微观图示更清晰地表示物质的构成。提起压在容器中水面上方的活塞,容器中的水发生汽化(从液态变为气态),如图所示。
(1)、出行——明朝末年从南昌到北京约需半年时间,如今乘坐高铁几小时便可到达,制造高铁使用的铝合金中的铝由(选填“分子”、“原子”或“离子”)构成。(2)、记录——古代用墨书写的典籍保存至今也不变色,如今可将信息存储在芯片上,芯片中含有的某元素在元素周期表中的部分信息如图1所示,该元素的名称是 , 其相对原子质量为。(3)、净水——明代《天工开物》一书记载了明矾净水,钾原子的结构示意图如图2所示,钾原子易(填“得到”或“失去”)电子,写出明矾中钾离子的符号是;如今使用高铁酸钾()不仅能净水,还能消毒,其中高铁酸钾由种金属元素组成。(4)、工具:“一尺之棰,日取其半,万世不竭”是古代人对物质构成奥秘的表达;如今可以借助各种精密仪器探索,通过微观图示更清晰地表示物质的构成。提起压在容器中水面上方的活塞,容器中的水发生汽化(从液态变为气态),如图所示。
最能表示水汽化后相同空间内粒子分布的是_____(填字母)
A、 B、
B、 C、
C、 D、
D、
-
8、长期以来,许多化学家通过大量的严谨的科学实验,证明了质量守恒定律是普遍存在的客观事实。在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图。下列说法中不正确的
 A、甲为生成物 B、丙可能为该反应的催化剂 C、参加反应的乙、丁质量比为 D、丁的相对分子质量是甲的2倍
A、甲为生成物 B、丙可能为该反应的催化剂 C、参加反应的乙、丁质量比为 D、丁的相对分子质量是甲的2倍 -
9、下列能得到实验目的的是




A.验证分子在不断运动
B.测空气中氧气的含量
C.验证水是由氢气和氧气组成
D.探究石蜡中含有氢元素
A、A B、B C、C D、D -
10、水果中含有柠檬酸 , 可促进消化。下列有关柠檬酸的说法中,正确的是A、柠檬酸由6个碳原子、8个氢原子和7个氧原子构成 B、柠檬酸中碳元素的质量分数为6.25% C、柠檬酸由碳、氢、氧三种元素组成 D、柠檬酸的相对分子质量为
-
11、某项目学习小组收集到一瓶浑浊的河水,模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示,请回答下面小题:
 (1)、若经过操作①后,所得液体C中仍有浑浊,下列说法不正确的是A、漏斗内的滤纸破损 B、漏斗下端没有靠在烧杯内壁 C、漏斗内液面高于滤纸的边缘 D、进行该操作时烧杯和漏斗没有清洗干净(2)、结合以上操作过程下列说法不正确的是
(1)、若经过操作①后,所得液体C中仍有浑浊,下列说法不正确的是A、漏斗内的滤纸破损 B、漏斗下端没有靠在烧杯内壁 C、漏斗内液面高于滤纸的边缘 D、进行该操作时烧杯和漏斗没有清洗干净(2)、结合以上操作过程下列说法不正确的是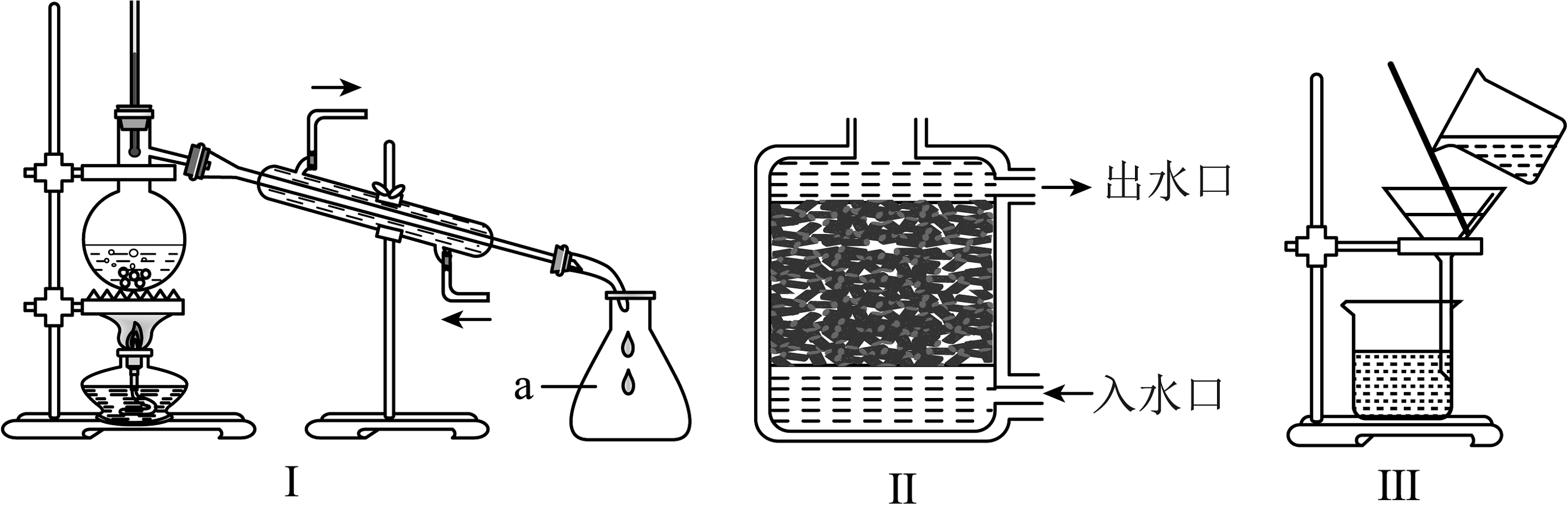 A、操作①对应的操作图是III,该操作可以不需要玻璃棒 B、操作②对应的操作图是II,活性炭的作用可以吸附色紫和异味等 C、操作③对应的操作图是I,得到蒸馏水是纯净物 D、取液体D于试管中加热,发现有较多水垢产生,说明液体D是硬水
A、操作①对应的操作图是III,该操作可以不需要玻璃棒 B、操作②对应的操作图是II,活性炭的作用可以吸附色紫和异味等 C、操作③对应的操作图是I,得到蒸馏水是纯净物 D、取液体D于试管中加热,发现有较多水垢产生,说明液体D是硬水 -
12、用分子的性质可以解释下列现象,其中不正确的是A、氧化汞分解成汞和氧气——分子可分 B、1滴水中水分子个数为——分子很小 C、酒香不怕巷子深——分子在不断运动 D、氧气经压缩储存在钢瓶中——分子体积变小
-
13、下列实验操作正确的是




A.加热液体
B.闻气体
C.液体读数
D.使用滴管
A、A B、B C、C D、D -
14、科学家对人类文明和社会可持续发展作出了重要贡献。下列选项正确的是A、拉瓦锡编制了元素周期表 B、门捷列夫提出了近代原子学说 C、闵恩泽为石油化工催化剂制造奠定基础 D、道尔顿确定了空气的组成
-
15、
催化剂可显著提高反应效率,某研究性学习小组在做与催化剂有关的课题,开展了以下探究。
【活动一】探究影响过氧化氢分解速率的因素
探究1:温度对过氧化氢分解速率的影响
(1)小金为了探究温度对过氧化氢分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:

实验1
实验2
二氧化锰的质量/g
0.5
0.5
的过氧化氢的体积/
40
待填
水浴温度/
20
80
①实验2中应加入过氧化氢。
②在两次实验中,可通过收集相同体积气体所需的来比较过氧化氢分解反应速率的大小。
探究2:催化剂的种类对过氧化氢分解速率的影响
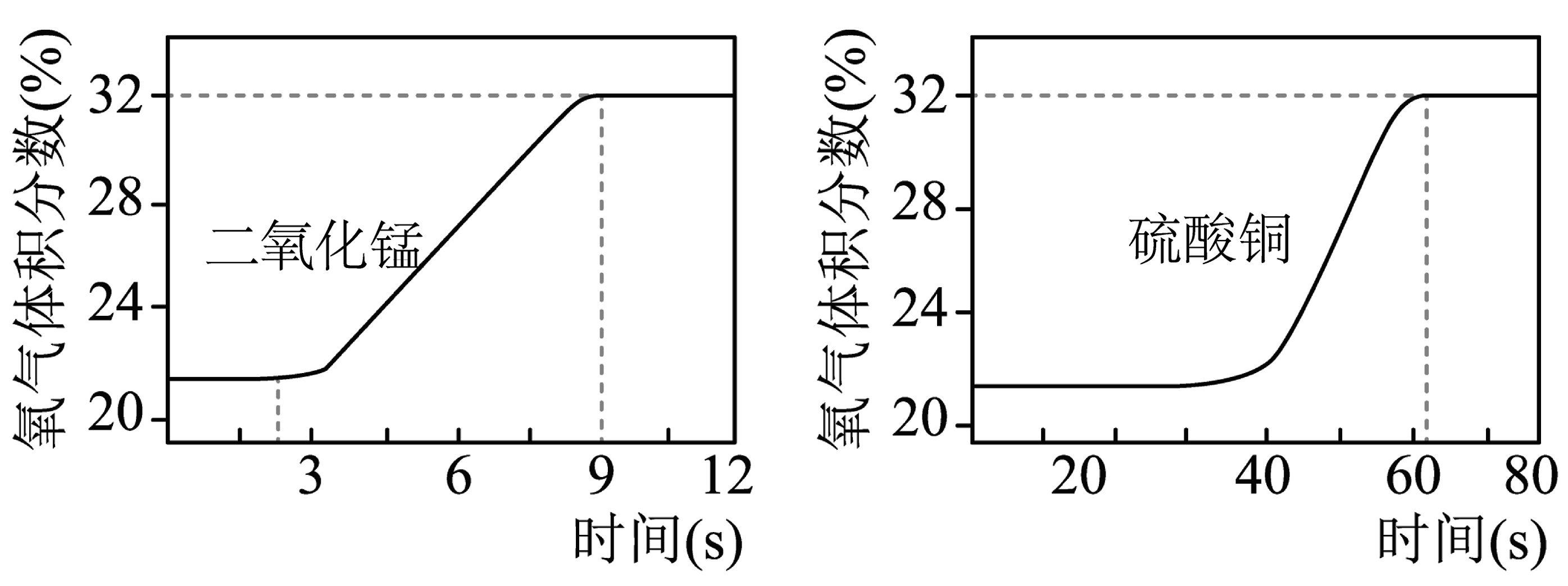
(2)硫酸铜对过氧化氢分解也有催化作用。为比较二氧化锰和硫酸铜对过氧化氢分解快慢的不同影响,用如图装置进行实验;启动传感器,注入过氧化氢溶液。氧气体积分数随时间变化情况如下:
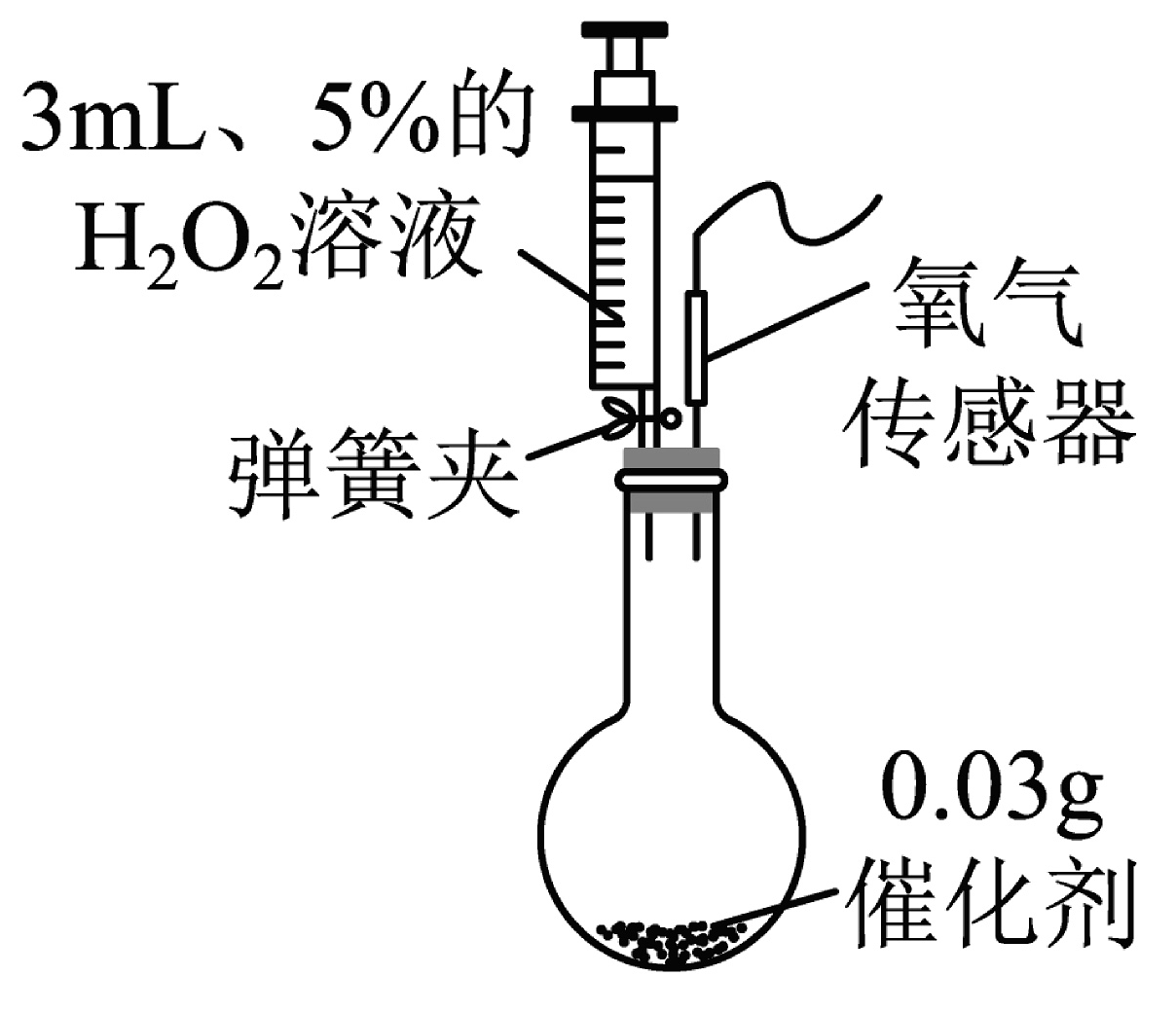
①初始时氧气的体积分数不为0,原因是。
②通过分析下图可知使过氧化氢分解较快的催化剂是。
-
16、实验室制取气体所需装置如下图所示。

请回答以下问题:
(1)、装置B中标“a”的仪器名称是。(2)、用高锰酸钾制取氧气的文字表达式(或符号表达式)是 , 制取并收集较纯净的氧气应选择的装置是(填字母序号)。(3)、若用D装置收集氧气时,检验是否收集满的方法是。(4)、若用F装置来收集氧气,则氧气应从(填“b”或“c”)端通入。 -
17、每年的3月22日是第三十届世界水日”。人类生命活动离不开水。某实践小组参观本地城市污水处理厂,流程示意图如下。请回答下列问题:
 (1)、格栅的作用相当于化学实验操作中的。(2)、活性炭的主要作用是。(3)、如图是水通电分解的示意图,a管中产生的气体为(填化学式),写出该反应的符号表达式: , 该反应的基本反应类型为(填“化合”或“分解”)反应。
(1)、格栅的作用相当于化学实验操作中的。(2)、活性炭的主要作用是。(3)、如图是水通电分解的示意图,a管中产生的气体为(填化学式),写出该反应的符号表达式: , 该反应的基本反应类型为(填“化合”或“分解”)反应。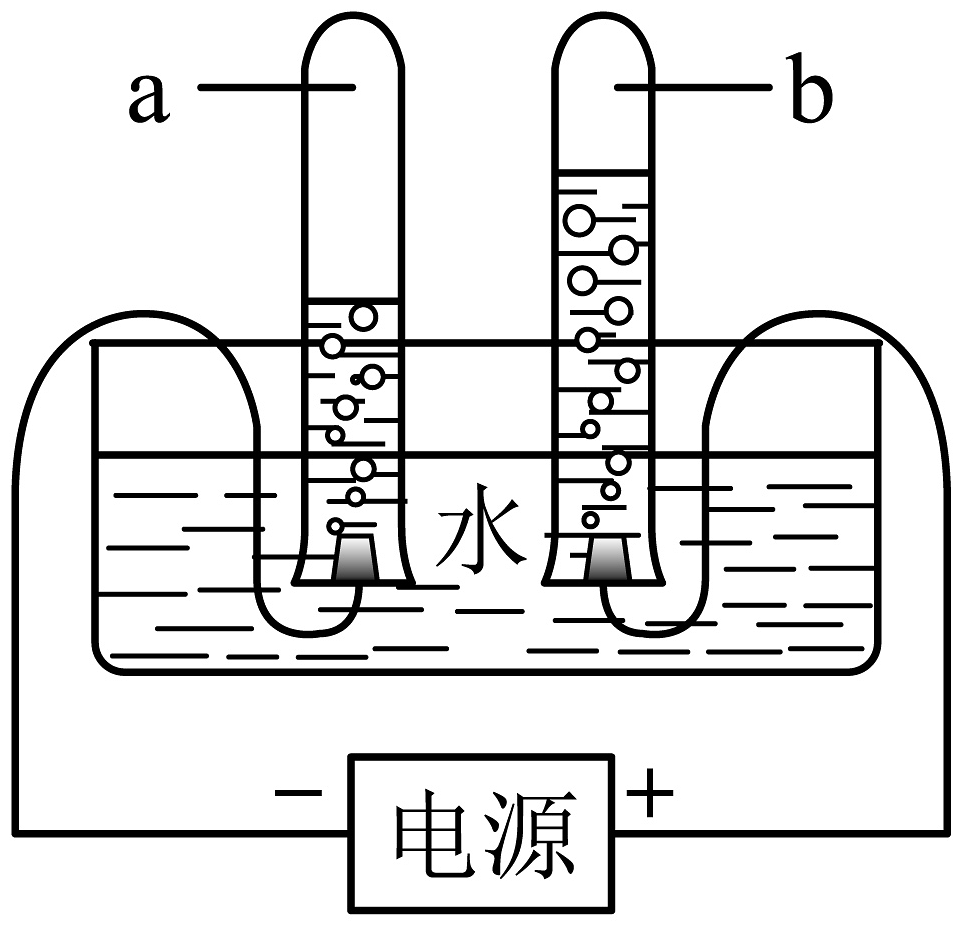
-
18、阅读下列科普短文,回答相关问题。
某校组装了一个微型空气质量“检测站”。某同学查阅资料可知,空气污染物中虽含有臭氧,但其所起的作用非常重要,它能吸收太阳光中绝大部分的紫外线,使地球上的生物免受紫外线的伤害,是一切生物的保护层。与氧气()不同,臭氧()通常状况下是淡蓝色气体,有鱼腥味。不移定,一旦受热极易转化成 , 并放出大量热。下图为检测设备采集到的某市两天的空气质量报告,坐标轴为空气质量指数与空气质量指数类别的关系,回答下列问题。
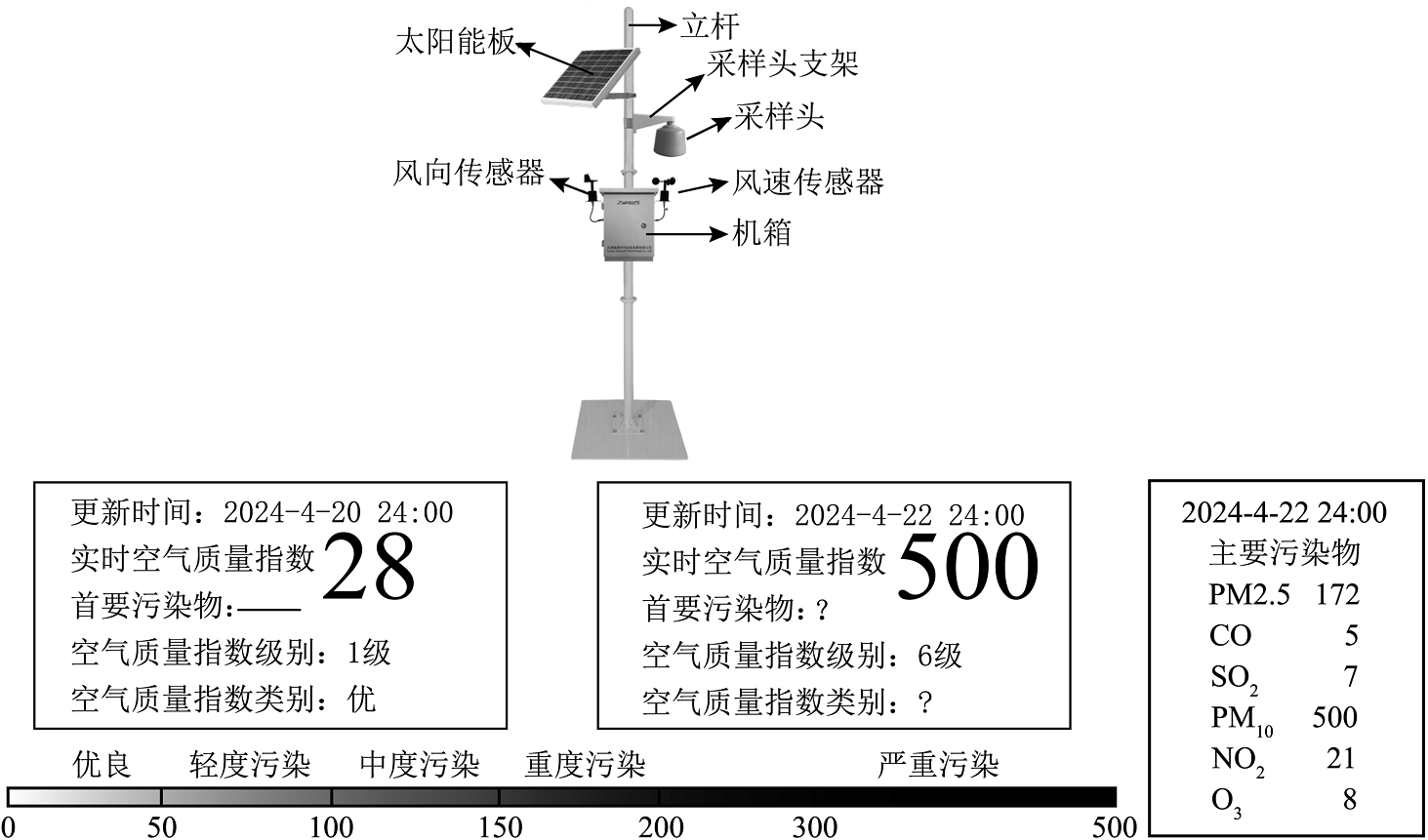 (1)、从微观的视角说明与化学性质不同的原因是。(2)、氧气()转化成臭氧()属于变化(填“物理”、“化学”)变化。(3)、由图可知,4月22日空气质量指数类别是 , 其首要污染物是。(4)、下列做法有利于改善空气污染的是_________(填字母序号)。A、开发使用清洁能源 B、工业废气加高烟囱排放 C、多植树造林 D、露天焚烧垃圾
(1)、从微观的视角说明与化学性质不同的原因是。(2)、氧气()转化成臭氧()属于变化(填“物理”、“化学”)变化。(3)、由图可知,4月22日空气质量指数类别是 , 其首要污染物是。(4)、下列做法有利于改善空气污染的是_________(填字母序号)。A、开发使用清洁能源 B、工业废气加高烟囱排放 C、多植树造林 D、露天焚烧垃圾 -
19、2023年8月24日,日本福岛第一核电站启动核污染水排海。核污染水中包含大量放射性物质,其中有大量的氚原子,氚一旦进入人体可能从人体内部对人造成辐射损害,导致细胞死亡、DNA遗传损伤。(1)、核污染水中还有一类危害较大的是碘(131为相对原子质量),碘的原子序数为53,则中子数。(2)、核污染水中含有大量的放射性镭()元素,在化合物中通常显价,该金属的氧化物的化学式为。(3)、氚原子的质子数为1,中子数为2,下列关于氚原子的说法正确的是_________(填字母序号)。A、一个氚原子只有1个电子 B、氚原子是氢元素的一种原子 C、氚原子具有相对稳定的结构
-
20、空气是人类宝贵的资源。工业制取氧气主要有下列步骤。
 (1)、从步骤②可以得出氮气的沸点比氧气的沸点(填“高”或“低”)。(2)、贮存在蓝色钢瓶里的“工业液氧”是(填“纯净物”或“混合物)。(3)、如用“
(1)、从步骤②可以得出氮气的沸点比氧气的沸点(填“高”或“低”)。(2)、贮存在蓝色钢瓶里的“工业液氧”是(填“纯净物”或“混合物)。(3)、如用“ ”表示氮原子,“
”表示氮原子,“ ”表示氧原子。若空气中其它成分忽略不计,下列图中能表示空气的微观模型是_________(填字母序号)。 A、
”表示氧原子。若空气中其它成分忽略不计,下列图中能表示空气的微观模型是_________(填字母序号)。 A、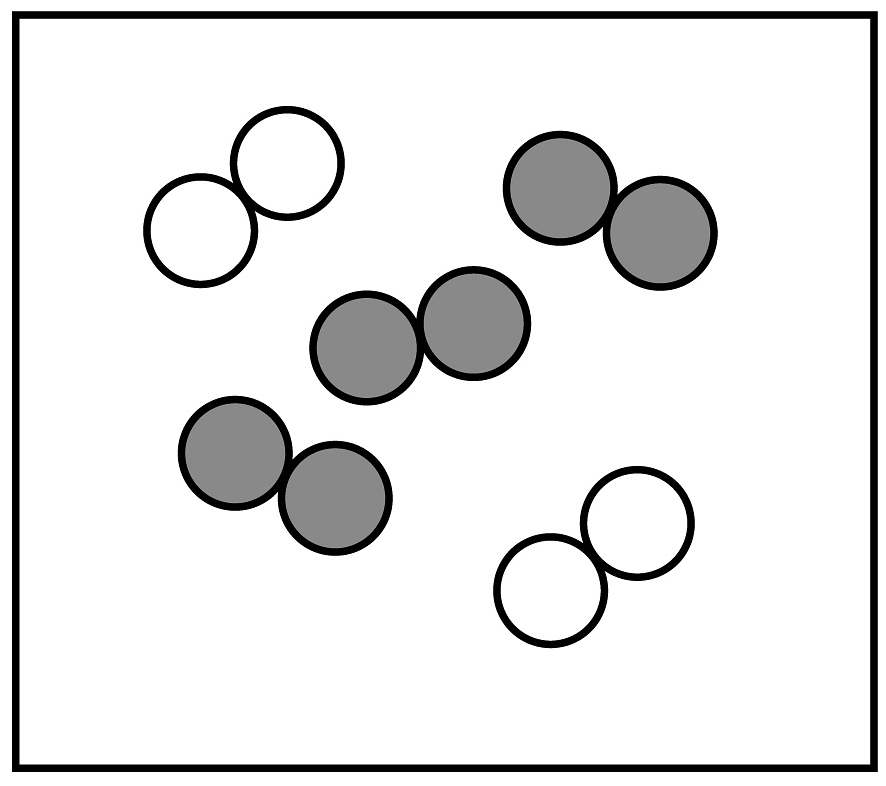 B、
B、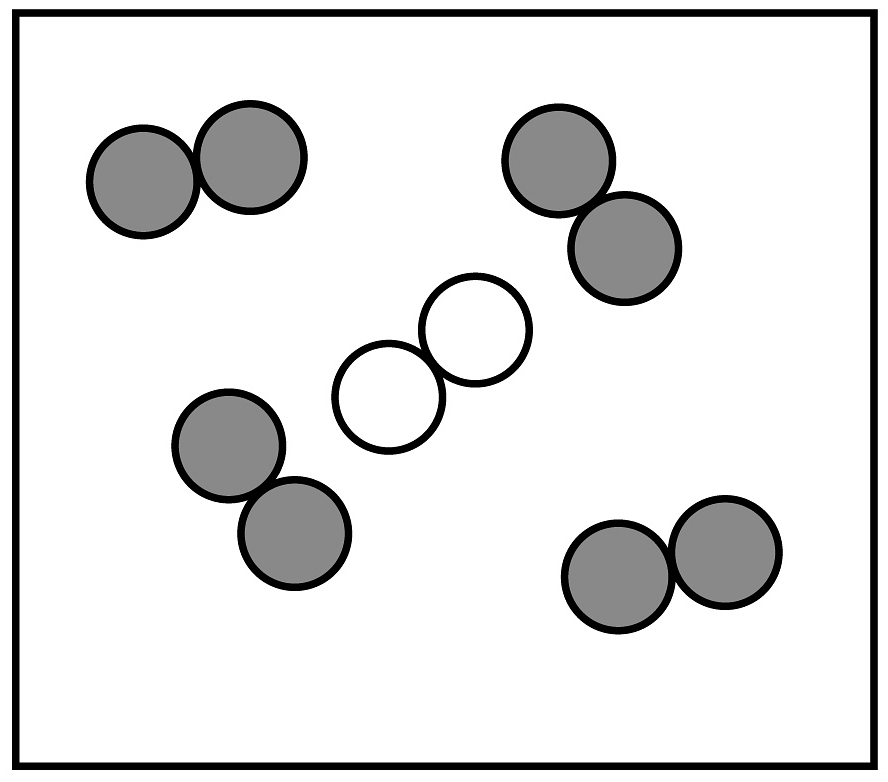 C、
C、