-
1、下图实验操作符合安全要求的是A、
 B、
B、 C、
C、 D、
D、
-
2、某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
反应前物质的质量/g
充分反应后物质的质量/g
过氧化氢溶液
二氧化锰
固体与液体混合物质量
68.0
0.1
66.5
请计算:
(1)该同学制得氧气的质量为_____。
(2)该同学所用过氧化氢溶液的溶质质量分数________。(相对原子质量:H-1 O-16)
-
3、实验探究一:课本第二单元课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤
实验现象
实验结论及解释
Ⅰ.
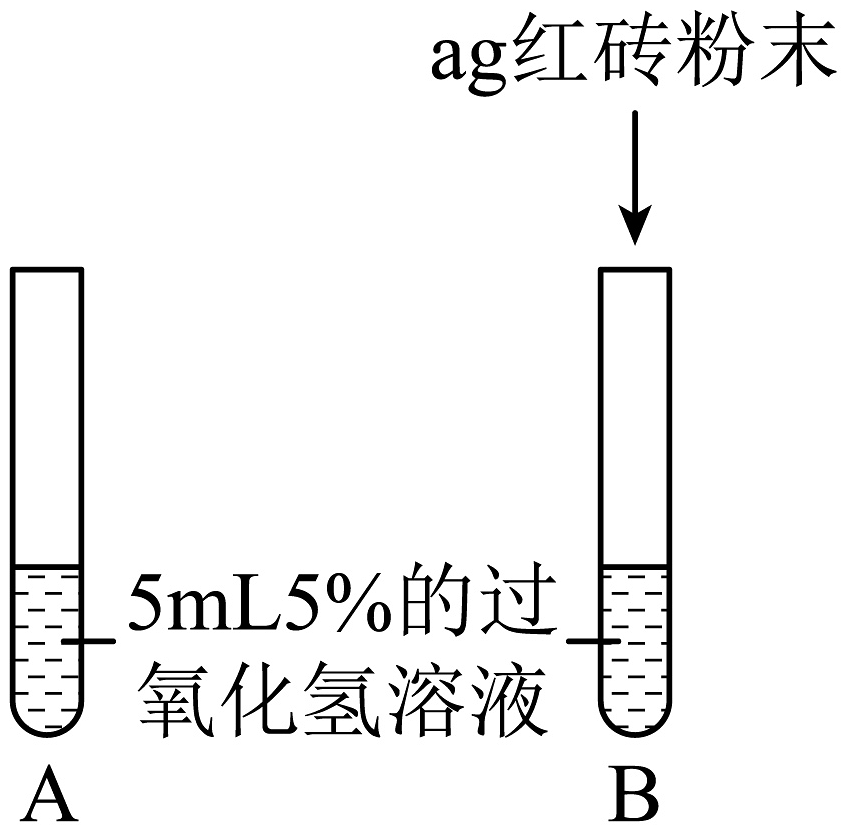
A中无明显现象,B中产生大量能使带火星木条复燃的气体
①产生的气体是
②红砖粉末能改变过氧化氢分解速率
Ⅱ.向B试管中重新加5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣
①又产生大量能使带火星木条复燃的气体
②滤渣质量等于ag
红砖粉末的在反应前后均没有发生变化,能做过氧化氢分解的催化剂
Ⅲ.
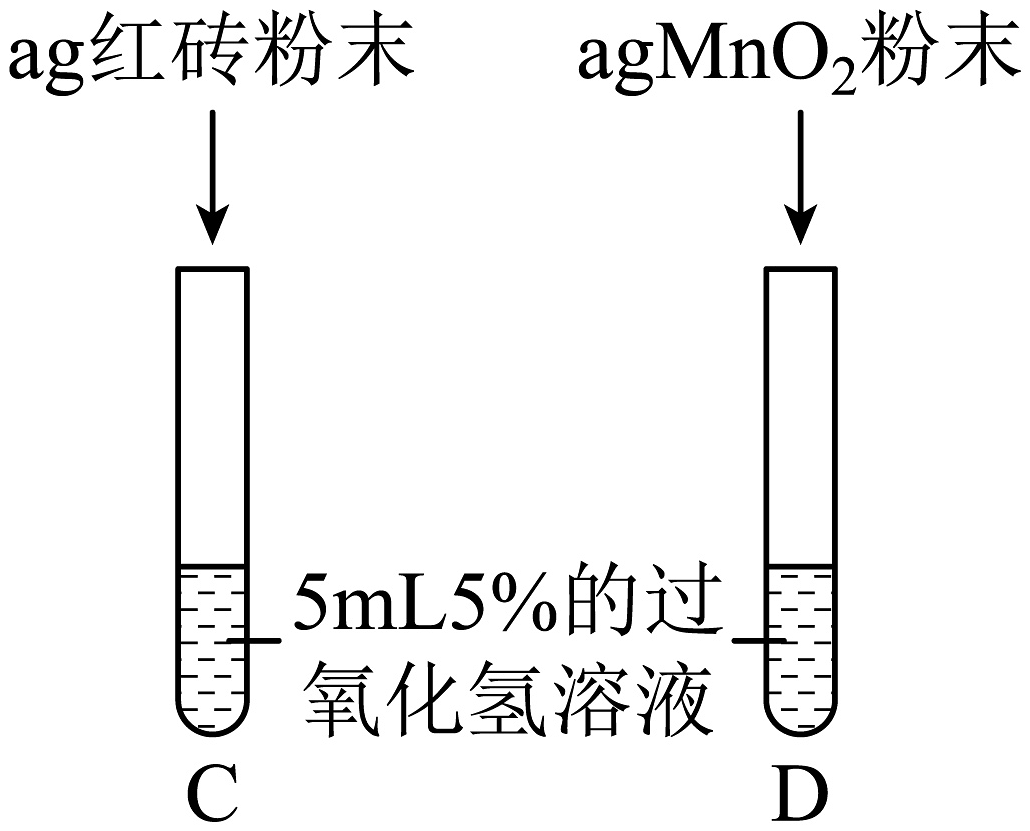
两试管中均产生气泡且
红砖粉末的催化效果没有二氧化锰粉末好

Ⅳ.木炭在氧气中燃烧比在空气中燃烧更剧烈,说明了影响木炭燃烧剧烈程度的因素是
-
4、某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:

实验Ⅰ:称量镁条,在空气中点燃,待反应结束后,将生成物全部回收再称量。
实验Ⅱ:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会再称量。
实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)过一会再称量。数据见下表:
(1)、在实验Ⅰ中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释。(2)、实验Ⅲ中发生反应的化学方程式为。(3)、实验Ⅰ、Ⅱ不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路:。编号
实验Ⅰ
实验Ⅱ
实验Ⅲ
反应前质量/g
4.8
112.6
118.4
反应后质量/g
8.0
112.4
118.4
-
5、请回忆你曾观察、学习过的一组实验。取四朵用石蕊溶液染成紫色的干燥的纸花,分别按下图进行实验。

(1)请根据图示进行思考并回答下表中的问题:
(I)
(Ⅱ)
(Ⅲ)
(Ⅳ)
现象
紫色纸花变红
紫色纸花不变色
紫色纸花不变色
。
分析
①实验(Ⅲ)验证了。②实验(Ⅳ)验证了。
(2)实验(Ⅳ)结束后,将纸花用酒精灯小心加热供烤后纸花又变紫,说明碳酸 , 写出该反应的化学方程式为。
-
6、蔗糖是储藏在某些植物中的糖,它的化学式为 , 是食品中常用的甜味剂。请回答下列问题:(1)、蔗糖是由种元素组成的,其中氢元素和氧元素的质量比为(填最简整数比)。(2)、计算34.2 g蔗糖中含有碳元素的质量。(写出计算过程)
-
7、以下实验装置是实验室制取气体的常用装置,请根据要求回答下列问题:
 (1)、写出图A中标有序号仪器的名称:;。(2)、若用石灰石和稀盐酸混合制取二氧化碳,应选用的发生装置和收集装置是 , 该反应的化学方程式是。若要验证制得的气体是否为二氧化碳,可将产生的气体通入(填试剂名称),该反应的化学方程式是。(3)、实验室中常用加热氯化铵和熟石灰的固体混合物的方法来制取氨气,氨气易溶于水且密度比空气小。应选用的发生和收集装置是(填装置字母)。(4)、实验过程中通常使用F装置除去气体中的水蒸气,气体应从F装置(选填“a”或“b”)端通入,此处利用了浓硫酸的吸水性。
(1)、写出图A中标有序号仪器的名称:;。(2)、若用石灰石和稀盐酸混合制取二氧化碳,应选用的发生装置和收集装置是 , 该反应的化学方程式是。若要验证制得的气体是否为二氧化碳,可将产生的气体通入(填试剂名称),该反应的化学方程式是。(3)、实验室中常用加热氯化铵和熟石灰的固体混合物的方法来制取氨气,氨气易溶于水且密度比空气小。应选用的发生和收集装置是(填装置字母)。(4)、实验过程中通常使用F装置除去气体中的水蒸气,气体应从F装置(选填“a”或“b”)端通入,此处利用了浓硫酸的吸水性。 -
8、以CO2为碳源,与电解水产生的H2经催化可转化为高附加值的产品,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2和H2转化为A或B等物质,反应原理如图所示(部分产物略去):

请回答下列问题:
(1)B的化学式是。
(2)根据催化剂的特性可知,催化剂在该反应前后,其质量和不变。
(3)在催化剂I中发生反应的化学方程式是。
-
9、用化学用语填空:(1)、3个铝离子;(2)、标出氯化锌中锌元素的化合价是。
-
10、小莉、小晶两位同学用如下两种不同的方法,配制100g溶质质量分数为5%的氯化钠溶液。小莉用固体氯化钠和水配制溶液:(1)、小莉实验时应量取水的体积是mL(水的密度可近似看作)。(2)、若小莉量取水时俯视读数,则所配溶液的溶质质量分数5%(填“>”“<”或“=”)。
-
11、如图中A、B、C、D是四种粒子的结构示意图。

请回答下列问题:
(1)、图中A、B、C、D属于种元素的粒子;(2)、A与C形成化合物的化学式是。 -
12、下列物质的用途,主要利用其化学性质的是A、活性炭可除去冰箱中的异味 B、铁锅作炊具 C、氮气用作焊接金属的保护气 D、汽油可用于擦拭衣物上的油污
-
13、下列实验现象的描述,正确的是A、硫在氧气中燃烧发出蓝紫色火焰,放热,生成二氧化硫 B、红磷在空气中燃烧,产生大量白雾 C、碳在氧气中剧烈燃烧,发白光,产生白色气体 D、加热后的铁丝伸入盛有氧气的集气瓶中剧烈燃烧,火星四射,放热,生成黑色固体。
-
14、化学符号是学习化学的重要工具。下列对①~④所示化学符号的意义叙述正确的是
①N②Mg③④
A、①②④都表示一个分子 B、③中的2表示一个镁离子带2个单位的正电荷 C、④表示分子中含有氢分子和氧分子 D、②和③属于同种元素,所以它们的化学性质相同 -
15、下列化学方程式书写正确的是A、 B、 C、 D、
-
16、下列物质是化合物的是A、空气 B、氯酸钾 C、澄清石灰水 D、红磷
-
17、化学是一门以实验为基础的科学,结合下列装置回答问题。
 (1)、仪器a的名称是。(2)、实验室用装置A制取氧气,试管内放入的药品一般是。用装置C收集氧气时,当观察到的现象时再开始收集。(3)、实验室用装置B制取氧气,发生反应的化学方程式为 , 该实验主要操作步骤有:①检查装置的气密性;②收集并验满气体;③装入药品;④组装仪器。正确的操作顺序是(填序号)。(4)、装置D是密封良好并充满空气的单气阀充气袋,若用它来收集一袋较纯净的氧气,则收集前需对D进行的操作是。(5)、如装置E所示,将充满二氧化碳的试管倒扣在盛有紫色石蕊溶液的水槽中,一段时间后可观察到试管内液面上升且溶液变红,原因是。
(1)、仪器a的名称是。(2)、实验室用装置A制取氧气,试管内放入的药品一般是。用装置C收集氧气时,当观察到的现象时再开始收集。(3)、实验室用装置B制取氧气,发生反应的化学方程式为 , 该实验主要操作步骤有:①检查装置的气密性;②收集并验满气体;③装入药品;④组装仪器。正确的操作顺序是(填序号)。(4)、装置D是密封良好并充满空气的单气阀充气袋,若用它来收集一袋较纯净的氧气,则收集前需对D进行的操作是。(5)、如装置E所示,将充满二氧化碳的试管倒扣在盛有紫色石蕊溶液的水槽中,一段时间后可观察到试管内液面上升且溶液变红,原因是。 -
18、电石渣是一种工业废渣,其主要成分为Ca(OH)2 , 含有少量MgO等杂质。以电石渣为原料生产纳米碳酸钙的制备方案如下图1所示。
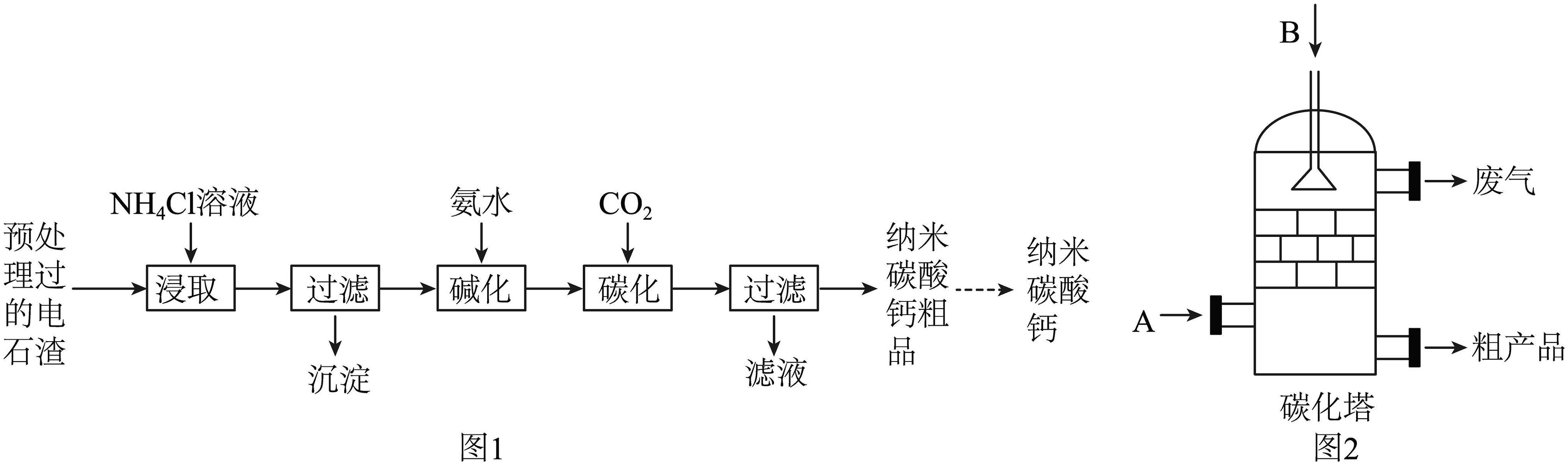
已知:
①电石渣中的杂质难溶于水,也不与NH4Cl溶液反应;
②“浸取”时的主要反应为 ;
③“碳化”时的主要反应为。
(1)、实验室进行过滤操作时,玻璃棒的作用是 , “沉淀”中主要含有的物质是。(2)、结合制备方案判断可循环利用的物质有和NH4Cl溶液。(3)、如图2所示,工业上将碱化后的溶液进行喷雾碳化,为使碱化后的溶液与CO2充分接触,应从(填“A”或“B”)处通入CO2。(4)、实际生产中,碳化反应的温度一般采用60℃,温度不宜过高的原因可能是(写一点即可)。(5)、碳化后得到的是纳米碳酸钙粗品,其表面一定含有的可溶性杂质是。 -
19、液体甲酸(HCOOH)具有清洁制氢的巨大潜能,其分解前后分子种类变化的微观示意图如下图所示。
 (1)、乙框中的物质是一种单质,请在乙框内将相应粒子图形补充完整。(2)、写出该反应的化学方程式: , 其基本反应类型为。(3)、化学反应都遵守质量守恒定律,这是因为在化学反应前后______(填字母序号)。A、原子的种类没有改变 B、分子的数目没有增减 C、原子的质量没有改变 D、原子的数目没有增减
(1)、乙框中的物质是一种单质,请在乙框内将相应粒子图形补充完整。(2)、写出该反应的化学方程式: , 其基本反应类型为。(3)、化学反应都遵守质量守恒定律,这是因为在化学反应前后______(填字母序号)。A、原子的种类没有改变 B、分子的数目没有增减 C、原子的质量没有改变 D、原子的数目没有增减 -
20、下表是硝酸钾和氯化钾在不同温度时的溶解度,请回答下列问题。
温度℃
20
30
40
50
60
溶解度/g
硝酸钾
31.6
45.8
63.8
85.5
110
氯化钾
34.0
37.0
40.0
42.6
45.5
(1)、两种物质中溶解度受温度影响较小的是。若硝酸钾中混有少量氯化钾,可采用方法提纯硝酸钾。(2)、使接近饱和的硝酸钾溶液变为饱和溶液的一种方法是。(3)、40℃时,将25g氯化钾加入50g水中,所得溶液质量为。(4)、从表中数据可知,在温度为的范围内,氯化钾和硝酸钾的溶解度相同。