-
1、“氢能将成为未来主要的能源”,以下为两条获得氢能的途径,请回答。
途径一:利用太阳能实施光电转换,电解水;
途径二:通直流电电解水
(1)、氢气作为新能源,其主要优点为___________(填序号,下同)。A、制取成本低 B、燃烧产物无污染 C、制备原料为水来源广 D、贮存方便安全(2)、途径一“光电转换”过程中,光能转化为能,可较好解决传统制氢过程中效率低、等问题。(3)、兴趣小组对我国的太空舱制取氧气系统(如、右图)进行了研究性学习。
①该系统中电源A极是极;将燃着的蜡烛放入b管收集的气体中,燃烧更旺,说明该气体具有的化学性质是。
②太空舱制氧原理的文字表达式为。反应过程中种类和数目均没有发生变化的微粒是(用符号表示)。
③升高温度能提高电解制氧效率,从微观角度解释原因是。
④太空舱制氧过程中消耗的水和生成的氧气的质量关系是。
 (4)、从微观视角看物质及其变化是化学特有的思维方式。下图分别是水蒸气液化、水通电分解、氢气燃烧的微观变化示意图。
(4)、从微观视角看物质及其变化是化学特有的思维方式。下图分别是水蒸气液化、水通电分解、氢气燃烧的微观变化示意图。
①图中分子本身没有改变的变化是(填字母)。
②图C中,从微观角度判断该变化是化学变化的依据是:。
③从上图ABC的微观图示中获得以下信息,其中正确的有。
A.原子在化学变化中不可分
B.化学变化的实质是分子改变原子重组
C.物理变化过程中分子种类不变
D.化学变化过程中原子种类和数目不变
-
2、过氧乙酸是一种绿色高效的消毒剂,常用于环境消毒。过氧乙酸是无色液体,有强烈刺激性气味,具有腐蚀性(尤其是对金属)、可燃性,遇热、遇碱易分解。(1)、认识过氧乙酸:它的物理性质有(答2点)。(2)、制备过氧乙酸:反应Ⅰ:一氧化碳和甲醇在一定条件下反应生成乙酸
反应Ⅱ:乙酸与过氧化氢在一定条件下反应生成过氧乙酸和水
写出反应Ⅱ的文字表达式 , 上述两个反应中属于化合反应的是反应(填反应序号)。
(3)、下列关于过氧乙酸使用的说法错误的是___________。A、应低温、避开火源贮存 B、环境消毒,浓度越大越好 C、谨防溅到眼睛和皮肤上 D、最好不要用金属容器盛放 -
3、某兴趣小组自制简易净水器进行跨学科实践活动,对河水进行净化。(1)、设计:河水中含有泥沙等不溶性杂质以及色素、异味,矿物质、微生物等。可以通过(填操作名称)去除泥沙等不溶性杂质。图1为活性炭吸附后的微观图示,活性炭具有结构,可以吸附色素和异味分子。

 (2)、净化:将饮用水瓶和纱布、活性炭等组合成如图2所示装置进行水的净化。其中,装置制作较合理的是(填“A”或“B”)。通过该装置净化后的水(选填“适宜”或“不宜")直接饮用。(3)、归纳:①混合物分离的一般思路和方法是(将序号排序)。
(2)、净化:将饮用水瓶和纱布、活性炭等组合成如图2所示装置进行水的净化。其中,装置制作较合理的是(填“A”或“B”)。通过该装置净化后的水(选填“适宜”或“不宜")直接饮用。(3)、归纳:①混合物分离的一般思路和方法是(将序号排序)。a.分析混合物成分 b.找到分离方法 c.寻找成分性质差异
②自制净水器净水材料的选择需要考虑的因素有 (写1条)。
(4)、应用:①模拟自来水厂对水源进行净化:a.吸附沉淀(用明矾) b.投药消毒c.静置沉淀 d.过滤等,其合理的步骤顺序是(填序号,下同)。②图3是从海水中获取淡水的简易装置。下列说法错误的是。
A.水杯中的水是纯净物 B.该过程中水分子大小发生改变
C.该过程中用到蒸馏的方法 D.获取淡水的快慢与温度有关
-
4、下列方法中所举示例错误的是
选项
方法
示例
A
观察法
变化中观察到有发光、放热现象即可说明发生了化学变化
B
分类法
根据所含物质种类,可将物质分为纯净物和混合物
C
归纳法
氧气由氧分子构成,氦气由氦原子构成,因此构成物质的微粒不止一种
D
类比法
分子在化学变化中可分,原子在化学变化中也可分
A、A B、B C、C D、D -
5、为探究不同电压对电解水速率的影响,用如图装置进行多次实验,并记录不同电压下生成20mL氢气所需时间。下列分析错误的是
 A、点燃a管气体产生淡蓝色火焰 B、该实验说明水中含有氢分子和氧分子 C、a管与b管中生成气体分子个数比为1:1 D、实验中电压越高电解水的速率越快
A、点燃a管气体产生淡蓝色火焰 B、该实验说明水中含有氢分子和氧分子 C、a管与b管中生成气体分子个数比为1:1 D、实验中电压越高电解水的速率越快 -
6、臭氧(O3)是一种常见的消毒剂。对氧气无声放电可获得臭氧,实验装置和反应的微观示意图如下图所示。下列说法错误的是
 A、图2乙中的粒子均可保持物质的化学性质 B、图2甲表示的是纯净物,丙表示的是混合物 C、参加反应的反应物和生成物的分子个数比为1:1 D、该反应既不是化合反应也不是分解反应
A、图2乙中的粒子均可保持物质的化学性质 B、图2甲表示的是纯净物,丙表示的是混合物 C、参加反应的反应物和生成物的分子个数比为1:1 D、该反应既不是化合反应也不是分解反应 -
7、钠是人体必需的元素,钠原子的结构示意图如下图所示。下列说法错误的是
 A、一个钠原子核内含有11个质子 B、钠原子在化学反应中易失去电子变成Na+阳离子 C、化学反应中,钠原子与氧原子结合生成NaO D、钠原子核外的11个电子能量相同
A、一个钠原子核内含有11个质子 B、钠原子在化学反应中易失去电子变成Na+阳离子 C、化学反应中,钠原子与氧原子结合生成NaO D、钠原子核外的11个电子能量相同 -
8、下列关于相对原子质量的说法正确的是A、就是原子的实际质量 B、是原子质量与12C原子质量的比值 C、是一个比值,单位为g D、相对原子质量越大,原子的实际质量就越大
-
9、如图是一定条件下某反应的微观示意图。下列说法错误的是
 A、反应前后,原子种类、数目不变 B、丙物质由原子直接构成的 C、分子在化学变化中可以再分 D、反应物和生成物都是由分子构成的
A、反应前后,原子种类、数目不变 B、丙物质由原子直接构成的 C、分子在化学变化中可以再分 D、反应物和生成物都是由分子构成的 -
10、化学概念间在逻辑上有如下关系:包含关系、并列关系、交叉关系。对下列概念间的关系说法正确的是A、分解反应与化合反应属于交叉关系 B、化学变化与物理变化属于并列关系 C、化学性质与物理性质属于包含关系 D、纯净物与混合物属于交叉关系
-
11、正确的化学实验操作是实验成功和人身安全的重要保证。下列实验操作错误的是A、给烧杯中的液体加热,需要垫上陶土网 B、实验室中没有腐蚀性的药品也不可以品尝 C、取用药品要控制用量,若没有说明用量,固体铺满试管底部即可 D、用滴管吸取液体时,伸入试剂中捏扁橡胶胶帽赶尽气体后再吸液
-
12、“科学思维”是化学学科的核心素养之一、下列解释错误的是A、闻到花香——分子在不断的运动 B、氧气和液氧都能支持燃烧——同种分子化学性质相同 C、食物变质——食物分子的间隔、大小发生变化 D、用水银温度计测量体温——温度升高,原子间隔变大
-
13、规范操作是实验成功和安全的保障。下列实验操作规范的是A、塞紧橡皮塞
 B、加热液体
B、加热液体 C、液体的倾倒
C、液体的倾倒 D、装入粉末药品
D、装入粉末药品
-
14、化学课上老师向硫酸铜溶液中加入氢氧化钠溶液,发现有蓝色沉淀生成,于是有同学思考“加入其它溶液也能有蓝色沉淀生成吗?”这属于科学探究中的A、设计实验 B、提出问题 C、交流反思 D、得出结论
-
15、人类利用化学科学知识在一个“纯天然”的地球上搭建起一个五彩缤纷、美轮美奂的人造世界。下列物质中,不属于用化学方法人工制造的是A、
 金属材料
B、
金属材料
B、 玻璃制品
C、
玻璃制品
C、 塑料制品
D、
塑料制品
D、 棉花纤维
棉花纤维
-
16、
《天工开物》记载古法造纸术的流程是原料浸泡、蒸煮、抄制、烘干。“创新”小组根据记载,利用回收的废纸进行“制造再生纸”跨学科实践活动,在蒸煮时加入了氢氧化钠。造纸后,为处理剩余的废液进行如下探究活动。
【查阅资料】
①BaCl2溶液呈中性;
②碱石灰是氢氧化钠与氧化钙的固体混合物。
【任务一】废液成分分析
【提出猜想】推测废液中含有氢氧化钠和碳酸钠中的一种或两种
【实验设计与实施】
【任务二】废液中碳酸钠含量测定
实验操作
实验现象
实验结论
步骤1:取少量废液于试管中,加入足量的氯化钡稀溶液。
①_______
废液中有Na2CO3
步骤2:取少量步骤1中的上层清液于试管中,滴加②_______
③_______
废液中有NaOH
(1)填写表中的空白①、②、③。
“创新”小组设计了如图所示的实验,取100g废液样品放入装置A的锥形瓶中,先通入一会儿N2 , 然后称量装置C、D的质量,再向锥形瓶中滴加足量稀硫酸,至不再产生气体,继续通一会儿N2后,测得装置C、D共增重2.2g。

(2)锥形瓶中不再产生气体后,需要继续通一会儿N2 , 其原因是。
(3)装置E的作用是。
(4)废液中碳酸钠的溶质质量分数是(写出计算过程,结果保留到0.1%)。
(5)装置B的作用是 , 如果缺少装置B,会使测定的碳酸钠含量(填“偏大”或“偏小”)。
【任务三】废液的处理
(6)为使废液中的碳酸钠转化为氢氧化钠循环利用,需根据废液中碳酸钠的含量,加入一定量的某种物质,该物质与碳酸钠反应的化学方程式是。
-
17、
“扬帆”小组对一瓶久置的NaOH固体的变质情况进行了实验探究。
【提出问题】NaOH变质了吗?
【作出猜想】①没有变质②已经变质
(1)请用化学方程式表示NaOH能变质的原因。
任务一:定性探究该NaOH固体是否变质
【实验活动1】
(2)设计方案进行如表实验:
实验方案
实验现象
实验结论
取少量该NaOH固体样品完全溶于水,加入过量稀盐酸
猜想②成立,依据是(用化学方程式表示)
【反思评价】有的同学提出此实验无法确定该NaOH固体变质程度。
任务二:定量探究该NaOH固体变质程度
【实验活动2】
(3)兴趣小组利用控制变量的方法进行实验,实验数据如表所示。
实验装置
实验序号
分别向左右容器内加入下列物质
温度升高值/℃
溶液pH

1
1.0gNaOH固体。
31.52
13.69
2
agNa2CO3固体。a的数值为。
10.03
11.92
3
1.0g该NaOH固体样品。
15.71
m
【实验结论】
(4)小组同学分析温度升高值数据,确定该NaOH固体变质程度是 , 请推测m的取值范围是。
【反思评价】兴趣小组充分认识到定量研究在化学实验中的重要作用。
【拓展延伸】
(5)生活中的管道疏通剂和炉具清洁剂成分中都含有NaOH,包装标签上应注明的注意事项是(写一条)。
-
18、铁黄(FeOOH)是一种颜料,以某硫铁矿废渣(主要成分 , 含有少量的 , 其余成分不考虑)为原料,制取铁黄,以下是制取工艺流程。
注:铁黄不与水反应,不与水和反应
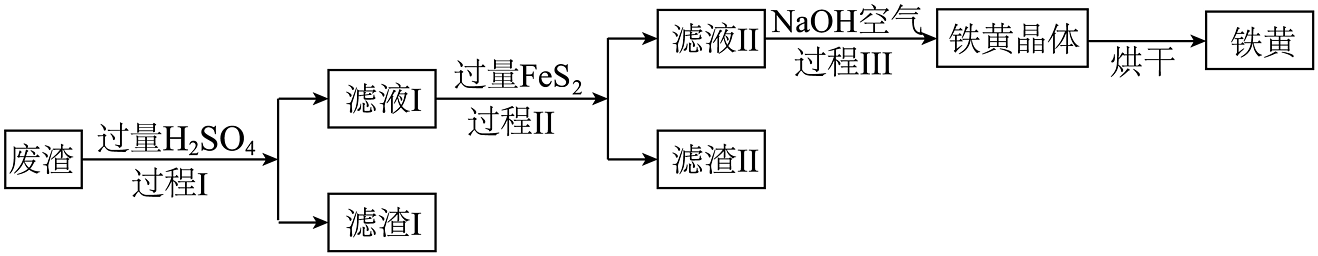 (1)、过程Ⅰ的化学方程式为 , 滤渣Ⅰ中的物质有(填化学式);(2)、过程Ⅱ的操作名称为;(3)、过程Ⅲ中的化学方程式为 , 该反应属于反应(填基本反应类型);(4)、①FeOOH随着温度的升高,可以加热分解成 , 写出其反应的化学方程式;
(1)、过程Ⅰ的化学方程式为 , 滤渣Ⅰ中的物质有(填化学式);(2)、过程Ⅱ的操作名称为;(3)、过程Ⅲ中的化学方程式为 , 该反应属于反应(填基本反应类型);(4)、①FeOOH随着温度的升高,可以加热分解成 , 写出其反应的化学方程式;②温度不同时,生成的颜色如下表:
温度/℃
400
700
750
800
颜色
橘红
鲜红
鲜红
暗红
如果思考乐希希同学想获得鲜红的 , 应把温度控制在。
-
19、“宏观-微观-符号”是化学独特的表示物质及其变化的方法。某兴趣小组对盐酸和硫酸的共性和差异性进行以下研究。回答下列问题。(1)、向稀盐酸和稀硫酸中分别滴加石蕊试液,试液变红,说明两种酸溶液中均存在(填微粒符号)。(2)、将表面生锈的铁钉投入到足量稀硫酸中,铁锈逐渐溶解,溶液变黄,铁钉表面产生气泡,该气体为;一段时间后,溶液慢慢变为黄绿色,图1是对溶液变为黄绿色的一种微观解释,参加反应的微粒是(填微粒符号)。
 (3)、分别向两份相同的Ba(OH)2溶液中匀速滴加相同pH的稀盐酸和稀硫酸,观察现象并绘制溶液电导率随时间变化曲线(图2)(电导率能衡量溶液导电能力大小,相同条件下,单位体积溶液中的离子总数越多,电导率越大)。
(3)、分别向两份相同的Ba(OH)2溶液中匀速滴加相同pH的稀盐酸和稀硫酸,观察现象并绘制溶液电导率随时间变化曲线(图2)(电导率能衡量溶液导电能力大小,相同条件下,单位体积溶液中的离子总数越多,电导率越大)。
①图2中曲线1表示向Ba(OH)2溶液中滴加;曲线2反应中的实验现象为。
②该实验说明,不同的酸中,由于不同,酸的性质也表现出差异。
-
20、某兴趣小组借助数字技术探究“稀盐酸与氢氧化钠溶液反应”,图1所示是室温下稀盐酸与稀氢氧化钠溶液反应的实验装置,图2是反应过程中的pH变化曲线。
 (1)、根据图2曲线判断,图1中的溶液B是(填“氢氧化钠”或“盐酸”)。(2)、图2中a点所示的溶液pH7(填“>”“<”或“=”),溶液呈现(填“酸性”“碱性”或“中性”)。(3)、c点所示的溶液中含有的溶质是(填化学式)。(4)、a点到b点pH变化的微观本质是。(5)、该过程发生反应的化学方程式为。
(1)、根据图2曲线判断,图1中的溶液B是(填“氢氧化钠”或“盐酸”)。(2)、图2中a点所示的溶液pH7(填“>”“<”或“=”),溶液呈现(填“酸性”“碱性”或“中性”)。(3)、c点所示的溶液中含有的溶质是(填化学式)。(4)、a点到b点pH变化的微观本质是。(5)、该过程发生反应的化学方程式为。