相关试卷
-
1、下列物质的鉴别中,所选试剂或方法不正确的是A、羊毛和棉线:在空气中灼烧 B、黄金和假黄金(铜锌合金):观察颜色 C、氧化铜和碳粉:加入稀盐酸 D、二氧化碳和氮气:加入澄清石灰水
-
2、劳动课上,小明在老师处领养了一盆发财树,养护一段时间后发现植物叶片发黄,为给发财树补充营养,小明应选用的物质是A、 B、KCl C、 D、
-
3、下列物质加入水中,充分搅拌,不能形成溶液的是A、食盐 B、蔗糖 C、花生油 D、小苏打
-
4、认真观察、记录和分析实验现象是学习化学的重要方法,下列有关实验现象的描述正确的是A、将银丝插入硫酸铜溶液中,可看到银丝表面有红色的铜生成 B、红磷在空气中燃烧,可观察到产生大量白色的烟雾 C、硫在氧气中燃烧,可观察到明亮的蓝紫色火焰,同时闻到刺激性的气味 D、木炭和氧化铜共热,可观察到红色固体变黑
-
5、2025年3月31日是我国第30个“全国中小学生安全教育日”,下列关于燃烧、灭火和自救的说法,错误的是A、图书馆书籍着火,用二氧化碳灭火器扑灭 B、室内起火,立即打开门窗呼救 C、吹灭生日蜡烛,是降低温度至蜡烛着火点以下 D、厨房油锅起火,立即用锅盖将其盖灭
-
6、分子、原子、离子等都是构成物质的微粒。下列物质由原子构成的是A、金刚石 B、水 C、硫酸铜 D、干冰
-
7、杭州亚运会开幕式主火炬的燃料——“零碳甲醇()”备受瞩目,这是全球首次对“零碳甲醇”的实践应用。目前,该燃料已广泛应用在船舶、汽车等领域。“零碳甲醇”是利用焦炉气中的副产品氢气和从工业尾气中捕捉的二氧化碳在一种纳米催化剂的作用下反应得到的,其微观示意图如图。有关该反应的说法,正确的是
 A、反应物均为化合物 B、该反应为分解反应 C、丁的化学式为 D、反应前后“纳米催化剂”的性质不变
A、反应物均为化合物 B、该反应为分解反应 C、丁的化学式为 D、反应前后“纳米催化剂”的性质不变 -
8、蔬菜中含有的维生素能增强人体对疾病的抵抗力,下列说法正确的是A、维生素C由碳、氢、氧三种元素组成 B、维生素C由20个原子构成 C、维生素C中碳元素和氧元素的质量比为1:1 D、维生素C的相对分子质量是176g
-
9、铈是一种常见的稀土元素,下图为元素周期表中铈元素的信息。下列有关说法正确的是
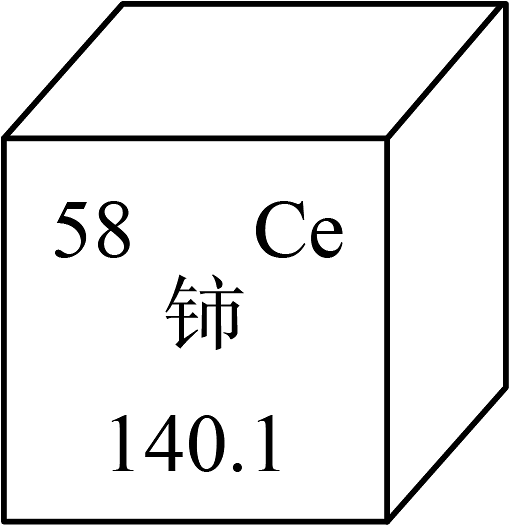 A、铈属于非金属元素 B、铈的元素符号为CE C、铈原子的相对原子质量为140.1 D、铈原子的原子序数为82.1
A、铈属于非金属元素 B、铈的元素符号为CE C、铈原子的相对原子质量为140.1 D、铈原子的原子序数为82.1 -
10、空气是一种宝贵的自然资源。下列有关空气及其成分描述错误的是A、氮气可充入食品包装袋中延长食品的保质期 B、氧气具有助燃性,可用作燃料 C、冰水共存物属于纯净物 D、稀有气体可用于制作霓虹灯
-
11、试管是实验室常用的仪器。下列有关试管的使用正确的是A、
 B、
B、 C、
C、 D、
D、
-
12、五育并举,让劳动成为一种教育。在下列劳动过程中一定发生化学变化的是A、淘米 B、生火 C、切菜 D、烧水
-
13、逻辑推理是一种重要的化学思维方法,以下推理合理的是A、分子、原子是不带电的粒子,则不带电的粒子一定是分子、原子 B、化合物中含有不同种元素,所以由不同种元素组成的纯净物一定是化合物 C、最外层电子数为8的粒子一定都是稀有气体元素的原子 D、碳酸盐与盐酸反应产生气体,则与盐酸反应生成气体的物质一定是碳酸盐
-
14、已知某固体混合物 A中含有 CuSO4、FeCl3、NaNO3、BaCl2、CaCO3五种物质中的两种或多种.按下述步骤进行实验探究,观察实验现象,并加以分析推理(设过程中所有发生的反应都恰好完全反应).
Ⅰ.取一定质量的该固体混合物 A放入一洁净烧杯中,向其中加入适量NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液C.
Ⅱ.另取一定质量的该固体混合物 A 放入另一洁净烧杯中,向其中加入适量H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液E.
Ⅲ.将所得溶液C和溶液E充分混合,再向混合后的溶液中加入适量 AgNO3溶液,待充分反应后,过滤,得白色沉淀F 和滤液G.
Ⅳ.根据上述实验过程和发生的现象作出相应的推理,填写以下空白:
(1)、在固体混合物 A 里,上述五种物质中肯定存在的物质是(写化学式)(2)、写出步骤Ⅲ中生成白色沉淀F的1个化学方程式:.(3)、在滤液G中,含有的金属阳离子共有种,该滤液中肯定存在的酸根离子是.(4)、在混合物A里,上述五种物质中肯定不存在的物质是(写化学式) , 得出此结论的理由是:. -
15、学习完“酸、碱、盐的性质”后,老师将两瓶未贴标签的饱和石灰水、饱和碳酸钠溶液摆放在实验桌上,让同学们区分.下面是“雄鹰小组”同学们的探究过程:(1)、【讨论与交流】
李壮(组长):区分两种物质的原理是,依据物质的性质,选择一种试剂与两种物质混合,产生两种不同的现象.大家据此来说一说区分两种溶液应选用哪种试剂,并说明理由.
王志:我认为可以选择稀盐酸,理由是稀盐酸与碳酸钠反应有气泡产生,稀盐酸与氢氧化钙反应无明显现象.
马凌:我选择的是碳酸钠溶液,理由是: .
张云:马凌,你说的我没有听懂,你能再给我讲一遍吗?
在大家的帮助下,张云不但弄明白了,还选出了其他两种溶液,如溶液和溶液,最后得到大家的赞许.
(2)、【实验探究】大家按照王志的方案进行了如图所示的实验.

实验中同学们根据观察到的现象,判断出甲试管中原溶液为碳酸钠溶液,乙试管中原溶液为石灰水.
大家对乙试管中现有溶液的溶质成分产生了探究兴趣.马凌经过认真思考后,又选择碳酸钠溶液作为检验试剂,进行了如下实验:
①马凌从乙试管中取少量溶液加入到另一支新试管中,再向此新试管中加入足量的碳酸钠溶液,观察到只有白色沉淀生成.于是,他得出结论:“溶液中的溶质有氢氧化钙”.但组长李壮对这个结论有疑问,理由是(用化学方程式表示).
②大家讨论完李壮的疑问后,制定出测定溶液酸碱度的方法来验证他的疑问,并查阅资料得到氯化钙溶液呈中性,大家都鼓励张云来做实验.
张云测出乙试管中剩余溶液的pH7(填“>”“<”或“=”),证实了马凌的结论是错误的.
(3)、【反思评价】判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑.探究活动结束了,同学们充分体验到探究的乐趣和学习成功的喜悦!
-
16、固体 A中可能含有 Na2SO4、CuSO4、Na2CO3、KNO3中的一种或几种,进行如下实验,观察、记录现象,并逐步推出结论.请完成下表:
实验步骤及现象
结 论
①将少许 A 溶于水得到无色溶液 B
A 中一定没有
②在 B 中加入足量 BaCl2 溶液,生成白色沉淀
A 中一定有
③在白色沉淀中加入足量稀盐酸,沉淀部分溶解
④另取少许 A 进行焰色反应,透过蓝色钴玻璃片,观察到火焰呈色
A 中还有 KNO3
-
17、实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物).已知:碳酸氢铵受热易分解,反应的化学方程式为:能被酸溶液吸收.

部分实验步骤如下:
Ⅰ.打开弹簧夹,通入一段时间的氮气;
Ⅱ.关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ.当样品反应完全,……,再停止加热,直到玻璃管冷却;
Ⅳ.实验完毕,测得装置B、C中药品的质量分别增加了m1、m2.
请回答下列问题:
(1)、NH4HCO3属于(选填“氮肥”“磷肥”“钾肥”或“复合肥”),装置B中盛放的液体是.(2)、装置C中发生反应的化学方程式为.(3)、步骤Ⅲ中,停止加热前应进行的操作是.(4)、该样品中碳酸氢铵的质量分数的表达式为(用含m1、m2的代数式表示). -
18、小强和小明两位同学对黄色的 FeCl3溶液产生了浓厚的兴趣,查阅资料获得如下信息:
①FeCl3能与 Cu、Fe、Al等金属反应生成 FeCl2 , 如:CuCl2;
②FeCl3溶液能使无色的苯酚溶液变成紫色
【提出问题】①FeCl3溶液与金属铝反应有哪些现象?
②FeCl3溶液中的哪种粒子使苯酚溶液变成紫色
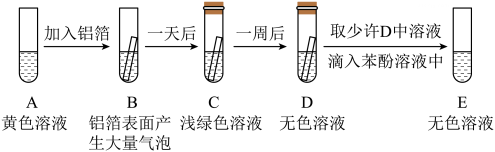
【实验探究】取适量FeCl3溶液于试管中,进行如下实验:
【思考与交流】
①实验前,铝箔表面需要进行打磨处理,其目的是.
②FeCl3溶液的 pH7(填“>”“<”或“=”).
③溶液由黄色变成浅绿色的化学反应方程式为.
④D中无色溶液的溶质是(填化学式).
⑤经分析,小强同学认为是Fe3+使苯酚溶液变成紫色,但小明同学认为若要得出此结论还需补做如下实验:在苯酚溶液中滴加稀盐酸,观察溶液是否变成紫色.小明的理由是
-
19、小明怀疑自家菜地因施用硫酸铵出现了较为严重的土壤酸化问题,于是和化学兴趣小组的同学对此进行了探究.(1)、【查阅产品说明】小明同学根据图1所示产品说明书中的和硫酸铵的组成,推测硫酸铵受热可能会分解生成氨气,使肥效降低.(2)、【探究1】土壤的酸碱性
实验1:按图2所示溶解土样,玻璃棒搅拌的目的是;用pH试纸测量土样浸出液的pH约为4,说明土壤呈酸性.
(3)、【探究2】硫酸铵具有哪些性质?实验2:25℃时,将30g硫酸铵加入50g水中,完全溶解,此时所得溶液对应图3中(选填序号)点的状态,测得其pH约为5.
实验3:为证明硫酸铵受热分解生成了氨气,小组同学进行了图4所示的实验,观察到的实验现象为:①硫酸铵固体减少;②用酚酞溶液浸湿的滤纸;③小气球变大.
小明依据现象①和②,小红只依据③,都得出了“硫酸铵受热分解”的结论.小组同学认为小红的依据不合理,小气球胀大可能是装置中的空气受热膨胀所致.
若要通过小气球的变化得出“硫酸铵受热分解”的结论,还需继续进行观察,若 , 才能得出这一结论.
实验4:按图5所示进行实验,闻到刺激性气味,说明硫酸铵能与熟石灰发生反应.
(4)、【拓展应用】为保证铵态氮肥的肥效,不能高温暴晒,不能.
 (5)、硫酸铵中氮元素被植物吸收后,剩余的硫酸铵使得土壤酸化,可用熟石灰进行改良,反应的化学方程式为.
(5)、硫酸铵中氮元素被植物吸收后,剩余的硫酸铵使得土壤酸化,可用熟石灰进行改良,反应的化学方程式为. -
20、“比较归纳法”是学习化学的一种重要方法(“一”表示相连的两种物质能发生反应,“→”表示某种物质可通过一步反应转化为另一种物质).(1)、请以下表中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
项目
序号
举例
物质类别间的相互反应
物质类别间的转化
I
CaCl2+Na2CO3══CaCO3↓+2NaCl
盐 1—盐2
盐→新盐
Ⅱ
写出硫酸与氯化钡反应的化学方程式
酸一盐
酸→
Ⅲ
写出氢氧化钠转变成另一种碱的化学方程式
碱—
碱→新碱
(2)、室温下,氯化镁与下列物质的变化关系,正确的是(填标号).A
B
C
D