相关试卷
-
1、水是生存之本,火是文明之源。请根据下列叙述回答问题。(1)、古代人民逐水而居,智慧的劳动人民曾用漉水囊(如图)除去河水中的泥沙等杂质,漉水囊似圈形网兜,骨架用生铜制成,其原理类似于水的净化中的操作。“饮水洁净,不得瘟病。”古人常用木炭除去水不中的浮尘和异味,利用了木炭的性。
 (2)、汉字作为载体反映了我国古代人民对火的认识。甲骨文“
(2)、汉字作为载体反映了我国古代人民对火的认识。甲骨文“ ”(焚)的字形像是要燃火烧掉树林。上方的“林”相当于燃烧条件中的。引火方式与用具的演变也反映了人类技术的不断进步。古代的“木遂”取火,方法是通过摩擦引燃木屑,再小心吹气引燃外面包裹着的干草,若吹气太猛,原燃着的木屑反而会熄灭的原因是。现在人们普遍使用的打火机燃料为加压后的液态丁烷(C4H10),为了在气体泄漏时及时提醒人们,丁烷里都会加入少量有臭味乙硫醇。从分子角度解释在气体泄漏时人们能闻到臭味的原因。
”(焚)的字形像是要燃火烧掉树林。上方的“林”相当于燃烧条件中的。引火方式与用具的演变也反映了人类技术的不断进步。古代的“木遂”取火,方法是通过摩擦引燃木屑,再小心吹气引燃外面包裹着的干草,若吹气太猛,原燃着的木屑反而会熄灭的原因是。现在人们普遍使用的打火机燃料为加压后的液态丁烷(C4H10),为了在气体泄漏时及时提醒人们,丁烷里都会加入少量有臭味乙硫醇。从分子角度解释在气体泄漏时人们能闻到臭味的原因。 -
2、化学使我们的生活变得绚丽多彩,学习化学要与我们的日常生活联系起来。(1)、在超市经常看到“高钙牛奶”“加碘精制盐”等商品,这里的“钙”和“碘”是指(填“分子”、“离子”或“元素”)(2)、水烧开后把壶盖顶起,请从微观的角度解释:。倒开水时,要把水瓶的软木塞(填“正放”或“倒放”)在桌面上,其操作与化学实验室中取用液体试剂的操作相似。柯柯同学想从下边的试剂瓶中量取6mL的稀盐酸,他必须要用到的仪器有。(填仪器名称)
 (3)、某化妆品广告宣称自然护肤,为了标榜其成分纯天然,高喊“我们恨化学”,受到了舆论的讨伐。你认为下列选项中对化学的认识正确的是。(填序号)
(3)、某化妆品广告宣称自然护肤,为了标榜其成分纯天然,高喊“我们恨化学”,受到了舆论的讨伐。你认为下列选项中对化学的认识正确的是。(填序号)①纯天然的物质不含任何化学物质 ②化学是推动社会发展的重要力量
③化学对保障人体健康毫无作用 ④化工生产有百利而无一害
-
3、用符号表示或说出符号的意义:(1)、2个氢原子;(2)、氯元素;(3)、3Mg2+;(4)、铁单质;(5)、地壳中含量最多的金属元素是。
-
4、某兴趣小组利用图甲所示的装置,进行测定空气中氧气含量的实验,测得的相关数据如图乙、图丙、图丁所示。下列说法不正确的是
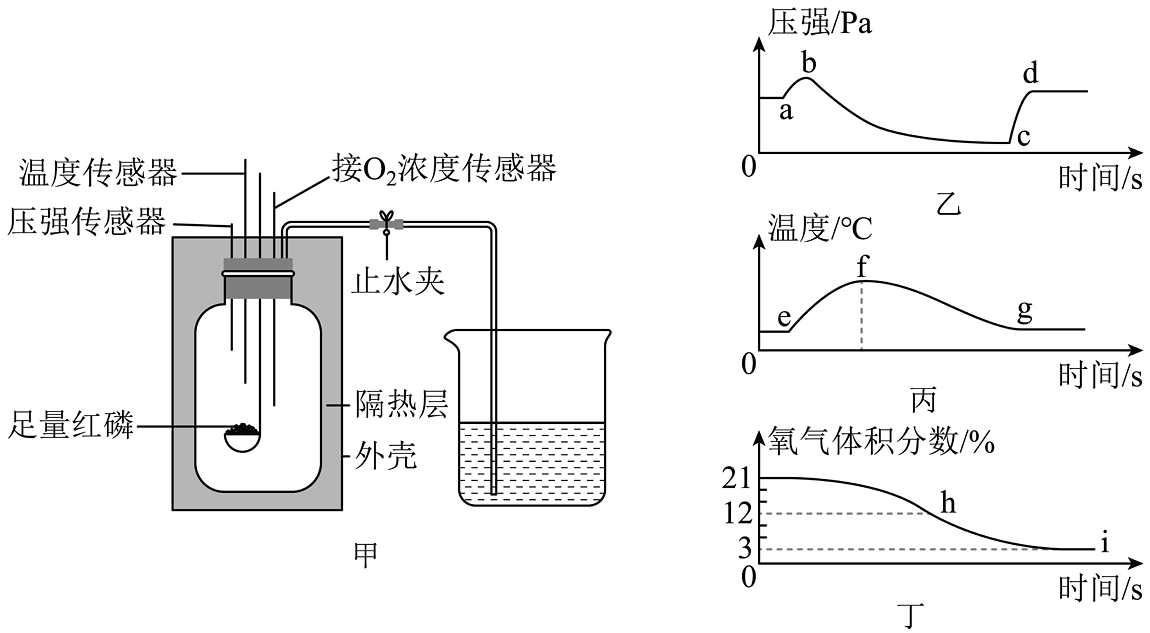 A、图甲装置加外壳、隔热层的主要目的是防止热量散失 B、打开止水夹的时刻对应图乙中的点b C、图乙中点c时装置内的温度等于图丙中点g时装置内的温度 D、由图丁可知红磷熄灭后氧气有剩余,说明物质燃烧时氧气必须达到一定的浓度
A、图甲装置加外壳、隔热层的主要目的是防止热量散失 B、打开止水夹的时刻对应图乙中的点b C、图乙中点c时装置内的温度等于图丙中点g时装置内的温度 D、由图丁可知红磷熄灭后氧气有剩余,说明物质燃烧时氧气必须达到一定的浓度 -
5、推理是一种重要的化学思维方法。下列推理合理的是A、催化剂可以加快化学反应速率,所以任何化学反应都需要催化剂 B、单质只含有一种元素,所以只含有一种元素的纯净物一定是单质 C、离子是带电的粒子,所以带电的粒子一定是离子 D、燃烧都伴随着发光、发热现象,所以有发光、发热现象的一定是燃烧
-
6、下列宏观现象和微观解释不一致的是A、液氧和氧气都支持燃烧——同种分子化学性质相同 B、6000L氧气通过加压可装在40L的钢瓶中——分子间有间隔 C、一滴水中大约有1.67×1021个水分子——分子的质量和体积都很小 D、给压瘪的篮球打气——分子的体积变大
-
7、9月3日某市下了一场大雨,下表是该市连续两天的空气质量报告。下列说法错误的是
日期
污染物及污染指数
质量级别
一氧化碳
二氧化硫
二氧化氮
PM2.5
9月3日
21
84
31
25
二级
9月4日
20
23
12
11
一级
A、工厂通过加高烟囱直接排放废气能减少空气污染 B、造成该市空气污染的首要污染物是二氧化硫 C、9月4日的空气质量比9月3日好 D、雨后一氧化碳含量变化不大,说明一氧化碳难溶于水 -
8、许多化学概念在逻辑上存在着包含、并列或交叉的关系,如图所示。下列有关概念间的关系的说法正确的是( )
 A、氧化反应和缓慢氧化属于并列关系 B、化合反应和分解反应属于并列关系 C、纯净物和混合物属于交叉关系 D、化合反应和氧化反应属于包含关系
A、氧化反应和缓慢氧化属于并列关系 B、化合反应和分解反应属于并列关系 C、纯净物和混合物属于交叉关系 D、化合反应和氧化反应属于包含关系 -
9、黑匣子是飞机专用电子记录设备之一,能经受飞机爆炸解体、剧烈燃烧、入水浸泡等情况破坏的考验。选择制作黑匣子的材料时,不需要考虑的是A、熔点高 B、耐腐蚀 C、耐高温 D、颜色必须是黑色
-
10、已知M2+离子核外有n个电子,则该元素的原子核内质子数为A、n B、n+2 C、 D、
-
11、鉴别装在不同集气瓶中的空气和氧气,最简便的方法是A、闻气体的气味 B、伸入带火星的木条 C、加入澄清石灰水 D、观察气体的颜色
-
12、关于过氧化氢(H2O2)、氧气(O2)、二氧化碳(CO2)、氧化钠(Na2O)四种物质的说法正确的是A、均由分子构成 B、都是化合物 C、都是氧化物 D、都含氧元素
-
13、安全意识大于天,风险防控在身边。下列实验室安全标志表示“戴好防护眼镜”的是A、
 B、
B、 C、
C、 D、
D、
-
14、下列反应属于缓慢氧化的是A、汽油燃烧 B、光合作用 C、呼吸作用 D、火药爆炸
-
15、下列关于“物质~用途~性质”的说法不正确的是A、氧气~火箭发射~支持燃烧 B、氖气~霓虹灯填充气~通电能发光 C、氮气~灯泡填充气~化学性质稳定 D、金刚石~制作钻石~硬度大
-
16、掌握规范的仪器使用方法是实验成功的保证。下列实验操作中,正确的A、
 液体加热
B、
液体加热
B、 倾倒液体
C、
倾倒液体
C、 滴加试剂
D、
滴加试剂
D、 加入块状固体
加入块状固体
-
17、学习任何一门学科,首要了解它研究的主要内容。化学研究的主要内容是
①物质的性质 ②物质的组成与结构 ③物质的转化及应用 ④生物体生命活动规律
A、①②③ B、③④ C、①③ D、②④ -
18、
天然气是一种重要的燃料,其主要成分是甲烷 , 某校化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,参与探究。
【提出问题】
甲烷燃烧后生成哪些物质?
【查阅资料】
①含碳元素的物质完全燃烧生成 , 不完全燃烧生成CO;②无水遇水变蓝。
③浓硫酸能够吸收水;④
【猜想假设】
(1)猜想甲:;猜想乙:;猜想丙:。
【实验探究】
为了验证上述猜想与假设,将甲烷在一定量的中燃烧的产物依次通过如图所示装置:

【实验现象】
(2)实验中观察到甲中无水变蓝,乙、戊中澄清石灰水变浑浊,丁中红色粉末变成黑色。其中澄清石灰水变浑浊的化学方程式为。
【实验结论】
(3)由此推断同学猜想成立。
【实验拓展】
(4)实验结束,对相关装置进行称量(忽略空气成分对实验的干扰):甲装置增重3.6g,那么燃烧甲烷的质量为g。
(5)甲、乙装置不能颠倒的原因。
-
19、如图是实验室制取气体的常用装置,请回答下列问题:
 (1)、仪器a的名称为。(2)、实验室用过氧化氢制取氧气时,为收集到纯净的氧气,收集装置应选(填字母)。反应的化学方程式。装入药品前必须进行的一步操作是。(3)、用排空气法收集氧气,如何验满?(4)、如用D装置收集 , 则气体应从导管端通入(填“b”或“c”)。
(1)、仪器a的名称为。(2)、实验室用过氧化氢制取氧气时,为收集到纯净的氧气,收集装置应选(填字母)。反应的化学方程式。装入药品前必须进行的一步操作是。(3)、用排空气法收集氧气,如何验满?(4)、如用D装置收集 , 则气体应从导管端通入(填“b”或“c”)。 -
20、酥油茶色泽淡黄,味道鲜美,香气扑鼻,既能止渴,又能充饥,还能暖身,确是高原佳饮。酥油茶制作流程如图,请完成下列问题。
 (1)、操作①在化学实验操作中的名称:。(2)、酥油茶属于(填“纯净物”或“混合物”)。
(1)、操作①在化学实验操作中的名称:。(2)、酥油茶属于(填“纯净物”或“混合物”)。