相关试卷
-
1、在容积不变的密闭容器中,一定量的SO2与O2发生反应:2SO2(g)+O2(g) 2SO3(g)。温度分别为t1和t2时,SO3的体积分数随时间的变化如图所示,下列关系式不正确的是( )
 A、t1<t2 B、K1>K2 C、ΔH>0 D、ΔH<0
A、t1<t2 B、K1>K2 C、ΔH>0 D、ΔH<0 -
2、向10mL 0.1mol/L的CH3COOH溶液中加入蒸馏水,将其稀释到1L后,下列说法中不正确的是( )A、CH3COOH的电离程度增大 B、c(CH3COOH)增大 C、CH3COO-的数目增多 D、增大
-
3、某温度下,将2mol H2和2mol I2充入密闭的刚性容器中发生反应H2 (g) + I2(g) 2HI(g) ,该反应的图像如图所示,t1时刻测定容器内的物质的量为1mol,t2时刻保持等温等容,抽走。下列有关叙述正确的是( )
 A、该温度下的平衡常数 B、反应过程中,可以利用气体的总压强保持不变来判断反应是否达到平衡 C、时刻,抽取HI的瞬间,v (逆)在图像上的变化应该是点 D、时刻,抽取后再次达到平衡,的百分含量减少
A、该温度下的平衡常数 B、反应过程中,可以利用气体的总压强保持不变来判断反应是否达到平衡 C、时刻,抽取HI的瞬间,v (逆)在图像上的变化应该是点 D、时刻,抽取后再次达到平衡,的百分含量减少 -
4、在恒容密闭容器中充入等物质的量的和 , 在催化下发生可逆反应:。某温度下测得浓度与时间的关系如下表所示:
0
2
4
6
8
10
2.0
1.5
1.2
1.1
1.0
1.0
下列说法正确的是( )
A、第时,的正反应速率大于逆反应速率 B、前 , 的平均反应速率 C、在该条件下,的平衡转化率为50% D、若平衡后保持温度不变,向容器中充入 , 平衡正向移动,K值增大 -
5、在载人航天器中,可以利用CO2与H2的反应,将航天员呼出的CO2转化为H2O等,然后通过电解H2O得到O2 , 从而实现O2的再生。已知:
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H1 =-252.9 kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H2 =+571.6 kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) 的ΔH为( )
A、-890.3kJ/mol B、+890.3kJ/mol C、-445.15kJ/mol D、+445.15kJ/mol -
6、下列关于工业合成氨的叙述正确的是( )A、合成氨工业温度选择为450℃左右,主要是为了提高NH3产率 B、使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响 C、合成氨生产过程中将NH3液化分离,不能提高反应物的转化率 D、合成氨工业中为了提高氢气的转化率,可适当增加氮气浓度
-
7、在一定条件下的密闭容器中发生反应:C2H4(g) + H2(g) C2H6(g) △H<0。当达到平衡时,下列各项措施中,能够提高乙烯转化率的是( )A、升高反应的温度 B、增大容器的容积 C、再加入一定量的氢气 D、等容下通入稀有气体
-
8、在一定温度下的容积不变的密闭容器中发生反应:X(g) + 2Y(g) 3Z(g)。下列叙述中,能说明反应达到化学平衡状态的是( )A、单位时间内,消耗3a mol Z,同时生成2a mol Y B、Y的浓度不再发生变化 C、混合气体的密度不再变化 D、容器内的压强不再变化
-
9、下列对化学反应速率增大原因的分析错误的是( )A、升高温度,使反应物分子中活化分子百分数增大 B、加入适宜的催化剂,使反应物分子中活化分子百分数增大 C、向反应体系中加入相同浓度的反应物,使活化分子百分数增大 D、对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多
-
10、以下判断正确的是( )A、2Mg(s)+O2(g)=2MgO(s) △H<0,该反应高温才能自发 B、C(s)+CO2(g)=2CO(g) △H>0,该反应常温下不能自发 C、自发反应的熵一定增大,非自发反应的熵一定减小 D、放热反应都可以自发进行,而吸热反应不能自发进行
-
11、下列物质在水溶液中的电离方程式正确的是( )A、NaClONa++ClO- B、KClO3=K++Cl-+3O2- C、H2CO32H++CO32- D、
-
12、在相同条件下,质量相等的两份硫单质分别与足量的O2充分反应,如果S(g)与O2(g)反应生成SO2(g)(为反应①),S(s)与O2(g)反应生成SO2(g)(为反应②)。则下列说法正确的是( )A、反应①放出的热量多 B、反应②放出的热量多 C、反应①、②放出的热量一样多 D、无法比较反应①、②放出的热量
-
13、科学家利用CO2和H2合成CH3OH有利于实现碳中和。主要反应有:
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
III.CO(g)+2H2(g)CH3OH(g),ΔH3=-90.6kJ·mol-1
回答下列问题:
(1)、ΔH2=kJ·mol-1 , 反应III在(填“高温”或“低温”)易自发进行。(2)、若将反应I看成由反应II和反应III两步进行,反应II为慢反应,画出由反应原料经两步生成产物的反应过程能量示意图。 (3)、一定条件下,在体积为1L的密闭容器中发生反应I,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率mol·L-1·min-1。若平衡时压强为P0 , 该反应条件的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)、一定条件下,在体积为1L的密闭容器中发生反应I,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率mol·L-1·min-1。若平衡时压强为P0 , 该反应条件的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)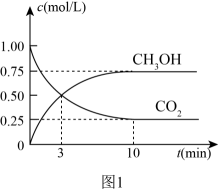 (4)、反应II中,为提高H2的转化率,可采取的措施有(任意答一条)。(5)、图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为。当甲装置中消耗11.2LO2(标准状况),理论上乙装置中通过导线的电子数目为。
(4)、反应II中,为提高H2的转化率,可采取的措施有(任意答一条)。(5)、图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为。当甲装置中消耗11.2LO2(标准状况),理论上乙装置中通过导线的电子数目为。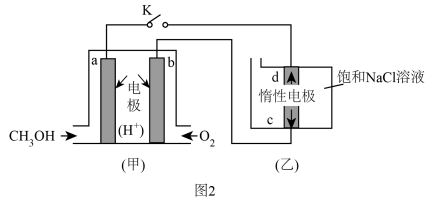
-
14、 25℃时,常见的弱电解质电离平衡常数如下:
化学式
电离平衡常数K
(1)、写出碳酸在水中的第一步电离方程式。(2)、25℃时,浓度均为的四种溶液:① ② ③NaCN ④ , 溶液pH从小到大排序(用序号排序)。(3)、25℃时,向溶液中加入一定量的 , 所得混合液 , 则混合液中。(4)、足量的溶液与稀充分反应,写出最可能发生反应的离子方程式:。(5)、向中加少量水稀释,下列关系式变小的是____。A、 B、 C、 D、(6)、向和混合溶液中加固体,恢复到室温后溶液均为中性,且溶液体积仍为 , 则(填>、<、=)(7)、气体与溶液充分反应得到溶液A,溶液A的pH7(填>、<、=)。 -
15、(1)、汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一、已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成2molNO时,应(填“释放”或“吸收”) kJ能量。
 (2)、用氮化硅()陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:。
(2)、用氮化硅()陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:。①写出的电子式:。
②在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率 。
③写出该反应的平衡常数表达式:K=
④一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是。
A.
B. 容器内压强保持不变
C. 混合气体密度保持不变
D.
(3)、CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。 研究 HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
放电过程中需补充的物质A为(填化学式)。
-
16、某同学欲测定市售小苏打中(含少量)的的质量分数,用的标准溶液滴定,甲基橙作指示剂。回答下列问题:(1)、配制待测溶液:准确称取样品于烧杯中,用蒸馏水溶解,冷却至室温后,转移至中,洗涤烧杯和玻璃棒2-3次,一并转移至容器中,定容。(2)、若定容时俯视刻度线,则所配溶液浓度(填偏大、偏小或不变);若定容时视线与凹液面最低处相平,塞好瓶塞,倒转均匀后,发现液面有所下降,此时不再定容至刻度线,则所配溶液的浓度(填偏大、偏小或不变)。(3)、用量取样品溶液至锥形瓶中,加入2滴甲基橙,用的标准溶液滴定,终点现象为。(4)、若滴定开始和结束时,酸式滴定管的液面如图所示,所用溶液的体积为mL。
 (5)、下列操作中可能使所测样品的质量分数偏高的是( )(填字母)。A、酸式滴定管未用待测液润洗就直接注入溶液 B、读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 C、酸式滴定管在滴定前有气泡,滴定后气泡消失 D、锥形瓶用蒸馏水洗涤后,留有少量水(6)、某同学4次实验有关数据如下表:则样品中的质量分数为(保留四位有效数字)。
(5)、下列操作中可能使所测样品的质量分数偏高的是( )(填字母)。A、酸式滴定管未用待测液润洗就直接注入溶液 B、读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 C、酸式滴定管在滴定前有气泡,滴定后气泡消失 D、锥形瓶用蒸馏水洗涤后,留有少量水(6)、某同学4次实验有关数据如下表:则样品中的质量分数为(保留四位有效数字)。实验序号
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
20.00
0.00
23.13
2
20.00
1.68
26.18
3
20.00
0.22
23.31
4
20.00
0.70
23.78
-
17、《本草纲目》中记载:“火药乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”黑火药爆炸时反应的化学方程式为2KNO3+S+3CK2S+N2↑+3CO2↑。下列说法正确的是( )A、黑火药属于纯净物 B、生成2.24LCO2时被氧化的碳元素的质量为1.2g C、该反应中只有硫元素被还原 D、生成5.6g氮气时转移电子的物质的量为2.4mol
-
18、反应mX(g)nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是( )
 A、该反应的ΔH>0 B、m<n+p C、C两点化学平衡常数:KB>KC D、A、C两点的反应速率v(A)<v(C)
A、该反应的ΔH>0 B、m<n+p C、C两点化学平衡常数:KB>KC D、A、C两点的反应速率v(A)<v(C) -
19、根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
事实
推测
A
可以和NaBr溶液反应生成
可以和NaCl溶液反应生成
B
Si与高温时反应,S与加热能反应
P与在高温时能反应
C
与水反应缓慢,与水反应较快
(ⅡA族)与水反应会更快
D
HCl在时分解,HI在时分解
HBr的分解温度介于二者之间
A、A B、B C、C D、D -
20、室温下,向10 mL pH=3的溶液中加入10 mL pH=11的NaOH溶液,所得溶液中与的大小关系是( )A、 B、 C、 D、无法判断