相关试卷
-
1、下列物质间的转化能通过一步反应实现的有( )
① ② ③ ④
A、1个 B、2个 C、3个 D、4个 -
2、下列离子方程式中正确的是( )A、铜片插入硫酸锌溶液中: B、钠与水的反应: C、用食醋除水垢的反应: D、溶液与少量溶液反应:
-
3、某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有、、、、、、、、中的若干种离子。该小组同学取部分水样进行实验。
①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;
②再滴加足量稀盐酸,沉淀部分溶解;
③最后滴加硝酸银溶液,又产生白色沉淀。
则下列说法错误的是( )
A、溶液中一定有 B、溶液中一定有 C、溶液中一定有 D、溶液中一定有 -
4、实验小组的同学使用如图装置(搅拌装置略)将试剂a逐渐滴加到试剂b中,探究溶液离子浓度变化,灯光变化可能出现 “亮→暗(或灭)→亮”现象的是( )
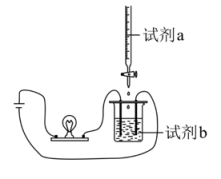
选项
试剂a
试剂b
A
HCl
Ca(OH)2
B
H2SO4
NaOH
C
Na2SO4
Ba(OH)2
D
H2SO4
Ba(OH)2
A、A B、B C、C D、D -
5、绿色化学又称环境友好化学,其宗旨是通过化学方法在生产过程中减少有害物质的使用和产生,从源头上降低或消除污染,下列行为不属于绿色化学的是( )A、使用低毒性的电镀稳定剂来取代剧毒的 B、在街道两侧规模种植某种可大量吸收的植物 C、寻找高效工业催化剂加快生产,减少需要的能耗 D、研发可回收、可被微生物分解的新型塑料
-
6、下列离子可以在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
7、根据特征对物质进行分类是一种重要的科学方法,下列说法中错误的是( )A、盐酸、氯水都是溶液,云、雾、有色玻璃都是胶体 B、金属氧化物不一定都是碱性氧化物,所有非金属氧化物都是酸性氧化物 C、燃料电池使用的氢氧化钾、甲烷、空气依次属于碱、有机物、混合物 D、氯化钠、硫酸钡、水都是电解质,二氧化碳、葡萄糖都不是电解质
-
8、下列关于金属元素焰色试验的说法中错误的是( )A、只有金属元素的单质可以进行焰色试验 B、部分金属单质在灼烧时可以产生特定的焰色 C、实验室无铂丝时可以用洁净的铁丝代替 D、钾元素的焰色试验中需要用到蓝色钴玻璃
-
9、下列物质与其用途对应错误的是( )A、煤油——保存钠单质 B、氢氧化钠——治疗胃酸过多 C、酒精——杀菌消毒 D、活性炭——吸附水中杂质
-
10、下列操作符合实验室安全规则的是( )A、实验结束后,将试管中剩余的硝酸钾粉末带出实验室 B、使用一盏正在燃烧的酒精灯去点燃其他酒精灯 C、用排空气法收集一瓶氯气,并把鼻子凑到瓶口闻其气味 D、在点燃导管中的氢气前先用一支试管收集并检验其纯度
-
11、《天工开物》中记载“凡石灰经火焚炼为用”,这一过程中发生了( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应
-
12、(1)、Ⅰ.次氯酸钠溶液和二氯异氰尿酸钠都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
NaClO溶液可由低温下将Cl₂缓慢通入NaOH溶液中而制得。制备NaClO的离子反应方程式为;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是。(2)、有研究显示,南极臭氧空洞中的污染物硝酸氯与次氯酸钠在结构上有类似之处。下列推测有一项不合理 , 该选项是____。A、具有强氧化性 B、与NaOH溶液反应可生成两种钠盐 C、与盐酸作用能产生氯气 D、水解生成盐酸和硝酸(3)、Ⅱ.二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为:;
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗溶液20.00mL。
如何判断滴定达到了终点?。
(4)、通过计算判断该样品是否为优质品。(写出计算过程)该样品的有效氯=(5)、若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值(填“偏高”或“偏低”)。 -
13、叠氮化钠(NaN₃)是一种防腐剂和分析试剂,在有机合成和汽车行业也有重要应用。学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
I.氨基钠熔点为易潮解和氧化;有强氧化性,不与酸、碱反应;易溶于水,叠氮酸(HN₃)不稳定,易分解爆炸;+2价锡具有较强的还原性。
II.
回答下列问题:
(1)、制备
①按气流方向,上述装置合理的连接顺序为(填仪器接口字母)。
②D的作用为。
③C处充分反应后,停止加热,为防止倒吸,需继续进行的操作为;E中溶液的作用是。
(2)、用如图所示装置测定产品纯度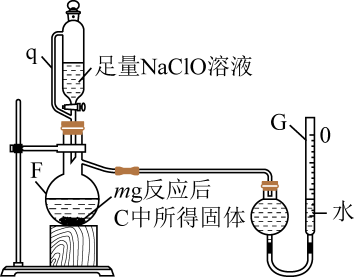
①仪器F中发生反应的离子方程式为。
②管q
 作用为。
作用为。③若G的初始读数为末读数为V₂mL,本实验条件下气体摩尔体积为Vmol·L-1 , 则产品中的质量分数为。
-
14、硫酸镍是一种重要的化工原料,无机工业常用其生产硫酸镍铵、氧化镍、碳酸镍等。粗硫酸镍晶体中含有Cu2+、Fe2+、Fe3+、Ca2+等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
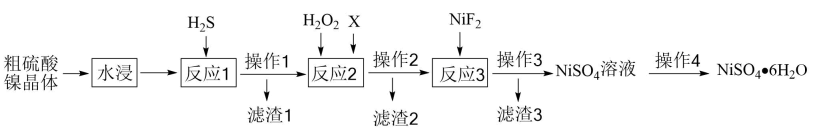
已知:室温下,
(1)、Ni在周期表中的位置为。(2)、通入气体发生反应的离子方程式为、。(3)、加入的主要目的是。(4)、试剂X可以是NiO或等,目的是。(5)、反应3加入的目的是。(6)、由溶液得到的操作为。 -
15、完成下列填空。(1)、已知A、B、C、D为气体,其中A、B为单质,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
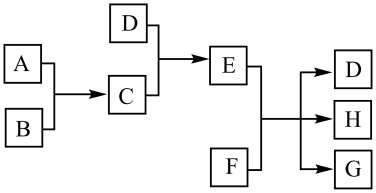
请回答下列问题:
①C的化学式是 , D的电子式为。
②如何检验E溶液中阳离子?。
(2)、在高压下,NO在下分解生成两种化合物,体系中各组分的物质的量随时间变化曲线如图甲所示。NO分解的化学方程式为。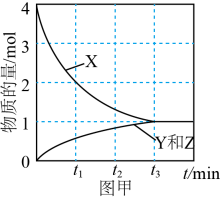 (3)、有色金属提取工艺中会产生大量含氰(CN·)废水,对环境造成了极大的负担。在碱性条件下可用ClO-将其氧化成和写出反应的离子方程式:。(4)、向酸性废水中加入NaClO,消除污染。写出相应的离子方程式为。(5)、将软锰矿与硫铁矿粉碎混合,用硫酸浸取。研究发现,酸浸时,和颗粒构成两个原电池反应,其原理如图所示(部分产物未标出)。
(3)、有色金属提取工艺中会产生大量含氰(CN·)废水,对环境造成了极大的负担。在碱性条件下可用ClO-将其氧化成和写出反应的离子方程式:。(4)、向酸性废水中加入NaClO,消除污染。写出相应的离子方程式为。(5)、将软锰矿与硫铁矿粉碎混合,用硫酸浸取。研究发现,酸浸时,和颗粒构成两个原电池反应,其原理如图所示(部分产物未标出)。
若原电池中生成单质S,其反应的离子方程式为。
-
16、将由三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
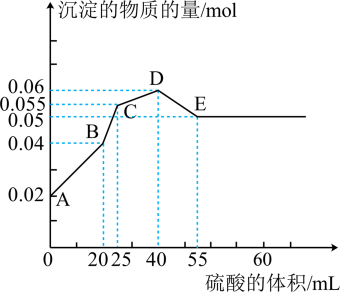 A、AB段发生反应的离子方程式为: B、D点表示的溶液呈酸性 C、混合物中FeSO4和AlCl3的物质的量相等 D、BC段发生反应的离子方程式为:
A、AB段发生反应的离子方程式为: B、D点表示的溶液呈酸性 C、混合物中FeSO4和AlCl3的物质的量相等 D、BC段发生反应的离子方程式为: -
17、2.48 g铁铜合金完全溶解于80 mL 4.0 mol·L-1稀硝酸中,得到标准状况下672 mL NO气体(假设此时无其他气体产生),下列说法正确的是( )A、取反应后溶液,滴入几滴KSCN溶液,无血红色出现 B、该合金中铁与铜的物质的量之比是1∶2 C、反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol·L-1 D、向反应后的溶液中加入2.0 mol·L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL
-
18、如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是( )
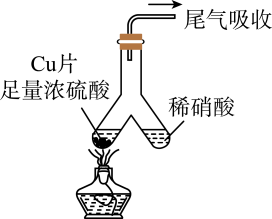 A、白色固体为CuSO4 B、NO为还原产物,b为氧化产物 C、NO与b的物质的量之和可能为0.2 mol D、参加反应的浓硫酸中,表现氧化性的占25%
A、白色固体为CuSO4 B、NO为还原产物,b为氧化产物 C、NO与b的物质的量之和可能为0.2 mol D、参加反应的浓硫酸中,表现氧化性的占25% -
19、某NaAlO2、Na2CO3的混合溶液中逐滴加入 1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。(已知:H2CO3的电离平衡常数K1=4.3×10-7 , K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)则下列说法正确的是( )
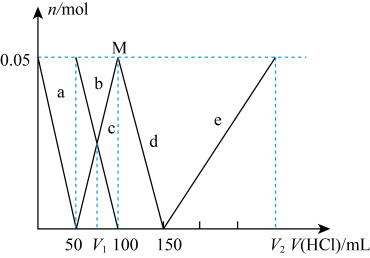 A、V1:V2=1:4 B、M点时生成的CO2为0.05mol C、原混合溶液中的CO32-与AlO2-的物质的量之比为1:3 D、a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O
A、V1:V2=1:4 B、M点时生成的CO2为0.05mol C、原混合溶液中的CO32-与AlO2-的物质的量之比为1:3 D、a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O -
20、由一种金属阳离子(包括NH)与两种酸根阴离子组成的盐称为混盐,如Ca(NO3)Cl可看成CaCl2和Ca(NO3)2。向混盐Na4S2O3中加入足量稀硫酸,发生如下反应:2Na4S2O3+4H2SO4=4Na2SO4+3S↓+SO2↑+4H2O。下列说法正确的是( )A、Na4S2O3溶液与AlCl3溶液混合可生成Al2S3沉淀 B、向混盐CaOCl2中加入足量稀硫酸会有Cl2产生 C、该反应每产生3molS,转移电子的物质的量为6mol D、1molNa4S2O3固体中含离子的物质的量为5mol