相关试卷
-
1、实验室进行含硫化合物性质探究的装置(夹持装置省略)如图所示,分液漏斗①中盛有浓硫酸,将其逐滴加入到试管②的固体中。下列说法正确的是( )
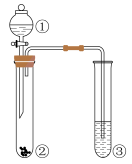 A、若②中为固体,③中盛石蕊溶液,则③中溶液先变红后褪色 B、若②中为蔗糖,③中盛有溴水,能说明浓硫酸具有脱水性和氧化性 C、若②中为固体,③中盛有氯化钡溶液,则③中生成白色沉淀 D、若②中为铜单质,③中盛有硫化氢水溶液,则③中生成黄色沉淀
A、若②中为固体,③中盛石蕊溶液,则③中溶液先变红后褪色 B、若②中为蔗糖,③中盛有溴水,能说明浓硫酸具有脱水性和氧化性 C、若②中为固体,③中盛有氯化钡溶液,则③中生成白色沉淀 D、若②中为铜单质,③中盛有硫化氢水溶液,则③中生成黄色沉淀 -
2、NA为阿伏加德罗常数的值,下列说法正确的是( )A、12 g 金刚石中含有的C-C键数目为4NA B、标准状况下,11.2LNO与11.2LO2混合后的分子数目为0.75NA C、23gNa与78gNa2O2分别与足量水反应生成的气体体积相同 D、100g质量分数为46%的乙醇溶液中含有氢原子数为12NA
-
3、某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液,下列物质组合不符合要求的是( )

气体
液体
固体粉末
A
CO2
饱和Na2CO3溶液
CaCO3
B
Cl2
FeCl2溶液
Fe
C
HCl
Cu(NO3)2溶液
Cu
D
NH3
H2O
Al(OH)3
A、A B、B C、C D、D -
4、SO2是引发酸雨的主要污染物,将工业废气中的吸收能有效减少对大气的污染、并实现资源化利用。下列离子方程式正确的是( )
已知常温下亚硫酸的电离平衡常数碳酸的电离平衡常数
A、硫酸型酸雨露置于空气中一段时间后溶液酸性增强: B、用过量溶液吸收废气中的 C、用过量氨水吸收废气中的 D、用过量溶液吸收废气中的 -
5、在标准状况下,将NO2、NO、O2混合气体充满一圆底烧瓶,倒置水中,进行喷泉实验,最后无气体剩余,若所得产物不扩散,则所得溶液的物质的量浓度的数值大小范围为( )A、 B、 C、 D、
-
6、下列实验中的颜色变化与氧化还原反应无关的是( )
选项
A
B
C
D
实验
溶液滴入溶液中
通入溶液中
溶液滴入浊液中
石蕊溶液滴入氯水中
现象
产生白色沉淀,最终变为红褐色
产生淡黄色沉淀
沉淀由白色逐渐变为黄色
溶液变红,随后迅速褪色
A、A B、B C、C D、D -
7、下列有关物质的性质和用途说法不正确的是( )A、利用高纯单质硅的半导体性能,可以制成光电池 B、石灰石在高温下的分解产物可与SO2反应,可用于减少燃煤烟气中的SO2 C、Na2O2与CO2反应放出氧气,可用于制作呼吸面具 D、二氧化硅导电能力强,可用于制造光导纤维
-
8、唐代著名诗人白居易曾写过著名诗句:“绿蚁新醅酒,红泥小火炉”、“酥暖薤白酒,乳和地黄粥”。下列关于诗句中所提及物质的说法正确的是( )A、酿酒原料高粱、谷物等主要成分为纤维素 B、红泥的颜色主要来自氧化铁 C、乳和粥的分散质是蛋白质 D、纯酒精比乙醇溶液杀菌效果更佳
-
9、阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)
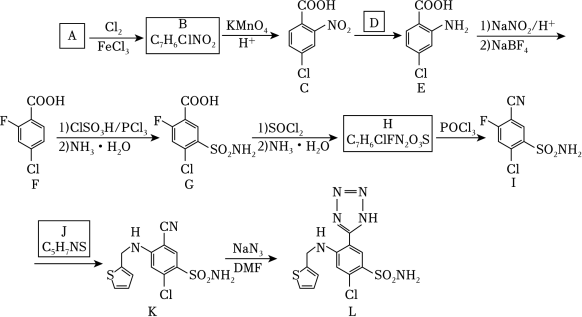
已知:R﹣COOHR﹣COClR﹣CONH2
回答下列问题:
(1)、A的化学名称是 。(2)、由A生成B的化学方程式为 。(3)、反应条件D应选择 (填标号)。a.HNO3/H2SO4 b.Fe/HCl c.NaOH/C2H5OH d.AgNO3/NH3
(4)、C中官能团的名称是 。(5)、H生成I的反应类型为 。(6)、化合物J的结构简式为 。(7)、具有相同官能团的B的芳香同分异构体还有种(不考虑立体异构)。其中,核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构为 。
-
10、钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。回答下列问题:(1)、钛和锆的价层电子结构相似,基态锆原子的价电子排布式为。(2)、Ti(BH4)2是一种储氢材料。BH4- 的空间构型是 , H、B、Ti的电负性由大到小的顺序为。(3)、ZrCl4可以与乙二胺形成配合物[ZrCl4(H2NCH2CH2NH2)],其中Zr原子配位数为6。
①1mol [ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为mol。
②H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H-N-H键角将(填“变大”“变小”或“不变”),原因是。
(4)、已知TiO2晶胞中Ti4+位于O2−所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2−所构成的立方体的体心,其晶胞结构如图所示:
①TiO2晶胞中O2−的配位数是。
②已知ZrO2晶胞的密度为ρ g·cm−3 , 则晶体中Zr原子和O原子之间的最短距离pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
-
11、一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
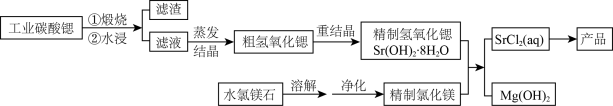 (1)、锶与钙元素同主族。金属锶应保存在中(填“水”、“乙醇”或“煤油”)。(2)、天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为。(3)、工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是。(4)、“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为 , 当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是。
(1)、锶与钙元素同主族。金属锶应保存在中(填“水”、“乙醇”或“煤油”)。(2)、天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为。(3)、工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是。(4)、“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为 , 当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是。质量mH2O:mSrO
4:1
5:1
6:1
7:1
8:1
9:1
10:1
Sr(OH)2·8H2O纯度%
98.64
98.68
98.65
98.64
98.63
98.63
98.65
Sr(OH)2·8H2O产率%
17.91
53.36
63.50
72.66
92.17
89.65
88.93
(5)、水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式。(6)、将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是____(填标号)。A、反应器中沉淀量不再增加 B、测定不同时间反应液pH C、测定Sr2+浓度变化 D、向反应器中滴加AgNO3溶液观察是否有沉淀(7)、若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为。 -
12、某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:(已知:K3[Fe(CN)6]可检验亚铁离子,生成蓝色沉淀)
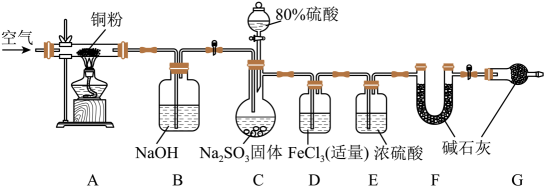 (1)、C中发生反应的化学方程式是 , 关于该套装置说法正确的是(填标号)。
(1)、C中发生反应的化学方程式是 , 关于该套装置说法正确的是(填标号)。a.组装仪器、加入药品后检查气密性
b.实验开始和最后时均需要通入空气
c.利用A、B装置是为了减小实验误差
d.F、G中的碱石灰可以换为无水CaCl2
(2)、甲同学认为很快可以看到D装置的现象,他的依据是(用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:第一步:Fe3++SO2+H2O = Fe(HSO3)2+(棕红色)+H+ (快反应)
第二步:Fe3++ Fe(HSO3)2+ +H2O=SO42-+2Fe2++3H+ (慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴试剂,相应的实验现象是。
(3)、学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为L。 -
13、固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
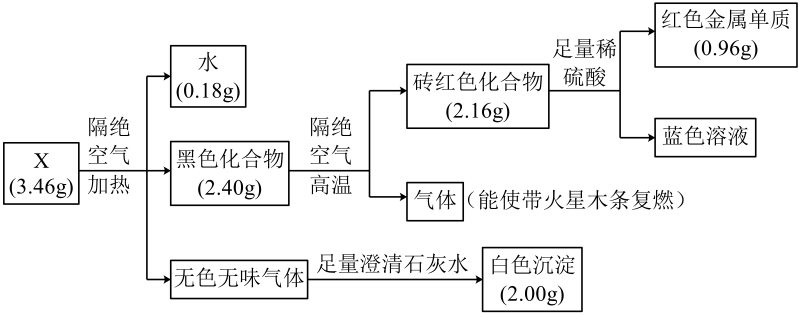 A、固体化合物X中的金属元素位于周期表第四周期第ⅠB族 B、固体化合物X为Cu2(OH)2CO3 C、黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 D、蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体
A、固体化合物X中的金属元素位于周期表第四周期第ⅠB族 B、固体化合物X为Cu2(OH)2CO3 C、黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 D、蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 -
14、“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如图所示。
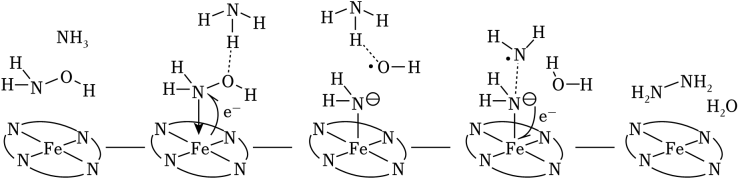
下列说法错误的是( )
A、NH2OH、NH3和H2O均为极性分子 B、反应涉及N﹣H、N﹣O键断裂和N﹣N键生成 C、催化中心的Fe2+被氧化为Fe3+ , 后又被还原为Fe2+ D、将NH2OH替换为ND2OD,反应可得ND2ND2 -
15、W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+ (WZ4)- 。下列说法正确的是( )A、分子的极性:WZ3<XZ3 B、第一电离能:X<Y<Z C、氧化性:X2Y3<W2Y3 D、键能:X2<Y2<Z2
-
16、冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别K+ , 其合成方法如图。下列说法错误的是( )
 A、该反应为取代反应 B、a、b均可与NaOH溶液反应 C、c核磁共振氢谱有3组峰 D、c可增加KI在苯中的溶解度
A、该反应为取代反应 B、a、b均可与NaOH溶液反应 C、c核磁共振氢谱有3组峰 D、c可增加KI在苯中的溶解度 -
17、工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
 A、过程I中的TBA替代了侯德榜制碱法中的氨气 B、在过程Ⅱ中实现了TBA、CuCl2的再生 C、理论上每生成1molNaHCO3 , 可得到1molC2H4Cl2 D、过程Ⅲ中的反应是
A、过程I中的TBA替代了侯德榜制碱法中的氨气 B、在过程Ⅱ中实现了TBA、CuCl2的再生 C、理论上每生成1molNaHCO3 , 可得到1molC2H4Cl2 D、过程Ⅲ中的反应是 -
18、设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、3.6 g D2O和3.6 g H2O中含有的质子数均为2NA B、含 2 mol H2SO4的浓硫酸和足量Cu在加热的条件下反应可生成NA个SO2分子 C、常温常压下,22.4 L甲醛(HCHO)含有的原子数目为 4NA D、过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为 0.2NA
-
19、向饱和氯水中加入少量Na2SO3固体,下列说法正确的是( )A、溶液颜色变深 B、溶液pH减小 C、溶液漂白性增强 D、溶液导电性减弱
-
20、(1)、Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。(2)、Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若 , 说明装置不漏气。
(3)、装置A中的试剂为 , 装置C中的试剂为。装置E的作用是。(4)、实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为(保留一位小数);若缺少E装置,会使测定结果(填“偏高”或“偏低”)。