相关试卷
-
1、下列说法正确的是( )A、将1mL pH=3的盐酸和醋酸分别稀释100倍后,醋酸的pH大于盐酸 B、中和等体积、等pH的盐酸和醋酸,醋酸所需NaOH的物质的量多于盐酸 C、25℃时,向醋酸溶液中加入一定量的盐酸,的电离常数减小 D、分别向等体积、等物质的量浓度的盐酸和醋酸中滴加NaOH溶液至溶液呈中性,反应后的溶液中
-
2、我国古代四大发明之一黑火药的爆炸反应为。设为阿伏加德罗常数的值,下列说法不正确的是( )A、标准状况下,11.2L 含π键数目为 B、1L 0.1mol/L 溶液中含数目为0.1 C、每生成2.8g 转移电子数目为1.2 D、0.1mol 晶体中含离子数目为0.2
-
3、W、X、Y、Z为原子序数依次增大的短周期主族元素,W是原子半径最小的短周期元素,X的s轨道电子数是p轨道电子数的2倍,W和X的最外层电子数之和等于Y的M层电子数,基态Z原子只有1个未成对电子。下列说法正确的是( )A、第一电离能:Z>Y B、最高价氧化物对应水化物的酸性:X>Z C、W与Z形成的化学键是σ键 D、W与X形成的化合物一定为非极性分子
-
4、某种具有菠萝气味的香料N的合成路线如下:

下列说法不正确的是( )
A、试剂X可能为溶液 B、用红外光谱(IR)可检测到M中含有酯基 C、Y的结构简式为 D、N可以发生取代、加成、氧化等反应 -
5、下列实验装置或操作能达到实验目的的是( )
 A、利用图①装置测定锌与稀硫酸反应生成氢气的速率 B、利用图②装置制备氢氧化铁胶体 C、利用图③装置验证牺牲阳极法可使铁钉不易被腐蚀 D、利用图④装置验证乙炔可使酸性溶液褪色
A、利用图①装置测定锌与稀硫酸反应生成氢气的速率 B、利用图②装置制备氢氧化铁胶体 C、利用图③装置验证牺牲阳极法可使铁钉不易被腐蚀 D、利用图④装置验证乙炔可使酸性溶液褪色 -
6、下列化学用语不正确的是( )A、碳酸氢钠水解的离子方程式: B、合成聚对苯二甲酸乙二酯的化学方程式:
C、向氯化银悬浊液中加入氨水的化学方程式: D、向乙酰胺中加入盐酸并加热的离子方程式:
-
7、下列关于热化学反应的描述正确的是( )A、 , 则含1mol 的溶液与含1mol NaOH的稀溶液混合,放出热量为57.3kJ B、甲烷的燃烧热 , 则 C、500℃、30MPa下, , 将1.5mol 和过量的在此条件下充分反应,放出热量46.2kJ D、同温同压下,在光照或点燃条件下的的数值相同
-
8、下列说法不正确的是( )A、可用浓溴水鉴别乙酸、乙醛、苯酚三种溶液 B、攀登高山时需要防晒护目,是为了防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤 C、核酸是由多种氨基酸通过肽键形成的一类生物大分子 D、聚丙烯酸钠()中含有强亲水基团,可作高吸水性树脂
-
9、下列有机反应中,键没有发生断裂的是( )A、溴乙烷与NaOH溶液混合加热 B、乙醇与浓硫酸共热至170℃ C、甲苯硝化生成TNT D、光照下三氯甲烷与氯气反应
-
10、工业上电解熔融和冰晶石()的混合物可制得铝。下列说法正确的是( )A、O、F、Na、Al四种元素都位于p区 B、属于分子晶体 C、中的配位体是F D、离子半径:
-
11、下列各组比较不正确的是( )A、丙烯中键长: B、键角: C、沸点: D、水中溶解度:
-
12、下列说法正确的是( )A、基态价层电子的轨道表示式:
 B、
B、 的名称:2-乙基丁烷
C、的VSEPR模型:
的名称:2-乙基丁烷
C、的VSEPR模型: D、的电子式:
D、的电子式:
-
13、下列物质对应的水溶液因水解而呈酸性的是( )A、 B、 C、 D、
-
14、下列物质属于弱电解质的是( )A、KOH B、 C、 D、
-
15、下列物质不属于合成高分子材料的是( )A、石墨烯 B、顺丁橡胶 C、涤纶 D、酚醛树脂
-
16、已知有机物烃A是一种重要的化工原料,A的密度是同温同压下氢气密度的14倍。物质间的转化关系如下:

回答下列问题:
(1)、丙烯酸中官能团的名称为:。(2)、反应①的化学方程式为:。(3)、聚丙烯酸的结构简式为:。(4)、下列说法错误的是____(填标号)。A、物质B能和钠反应产生氢气,反应速率比水缓慢 B、丙烯酸与互为同分异构体 C、聚丙烯酸发生的反应有加成、氧化、取代 D、可以用饱和碳酸钠溶液鉴别丙烯酸、B、D三种物质(5)、下列有机物能使溴水因化学反应而褪色的有____(填标号)。① ②丙烯酸 ③聚氯乙烯 ④ ⑤
A、1种 B、2种 C、3种 D、4种(6)、某含C、H、O三种元素的有机物E,经燃烧实验测得其碳的质量分数为64.86%,氢的质量分数为13.51%,则其分子式是 , 写出满足下列条件的有机物E的结构简式为。①与B互为同系物
②核磁共振氢谱呈现2组峰
-
17、Ⅰ.回答下列问题:(1)、
 用系统命名法命名其名称为 (2)、3-甲基-2-戊烯的结构简式为(3)、Ⅱ.乙炔是重要的化工原料。某同学在实验室以乙炔和等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示。(已知:四溴化乙炔的熔点为1℃,沸点为244℃,密度为 , 难溶于水。)
用系统命名法命名其名称为 (2)、3-甲基-2-戊烯的结构简式为(3)、Ⅱ.乙炔是重要的化工原料。某同学在实验室以乙炔和等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示。(已知:四溴化乙炔的熔点为1℃,沸点为244℃,密度为 , 难溶于水。)
装置A中橡皮管的作用是。
(4)、制备乙炔的化学方程式是 , 除杂装置B中所盛放的试剂是。(5)、装置C表明已反应完成的现象是;反应后的体系含有多种物质,依次用稀的碳酸钠溶液和水洗涤反应后的混合液静置分液,干燥有机相,通过(填操作名称),可获得纯净四溴化乙炔。(6)、乙炔可以用于合成聚氯乙烯,流程为:乙炔口有机物聚氯乙烯,①的反应类型为 , ②的化学方程式为。 -
18、铁、铝、铜都是日常生活中常见的金属。请回答以下问题:(1)、某学生向溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出晶体。
①按照核外电子排布,把元素周期表划分5个区,铜元素位于周期表区;的基态价电子轨道表示式为。
②请写出蓝色沉淀溶解的离子反应方程式:。
(2)、熔点比熔点高,其原因是。(3)、能与形成CuSCN沉淀。对应的酸有硫氰酸()和异硫氰酸(),这两种酸熔点更高的是(填名称),原因是。(4)、如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。
说明:Fe原子位于顶点、面心、棱心、大立方体的体心,以及四个互不相邻的小立方体的体心;
Al原子位于四个互不相邻的小立方体体心。
①若晶胞中1,2号原子的坐标分别为、 , 则晶胞中3号原子的坐标。
②该立方晶胞参数为a nm,表示阿伏加德罗常数,计算晶胞的密度为g/。(只要求列出算式)
-
19、EDTA(乙二胺四乙酸根离子,结构如图1)是化学中一种良好的配合剂,钛与EDTA形成的配位离子如图2所示。回答下列问题:
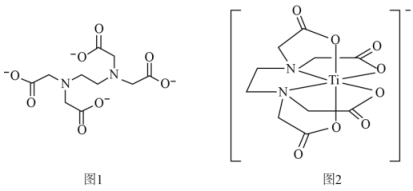 (1)、基态N原子,核外电子占据的最高能级的符号是 , 电子云轮廓图形状为。(2)、基态Ti原子的电子排布式为。(3)、如图1,EDTA中所含元素的电负性从大到小的顺序为(填化学符号);所含碳原子采用的杂化轨道方式有;键角∠NCC(填“>”、“<”或“=”)∠CNC,原因是。(4)、如图2,钛与EDTA形成的配位离子中,配位数为 , 化学键的类型有(填序号)。
(1)、基态N原子,核外电子占据的最高能级的符号是 , 电子云轮廓图形状为。(2)、基态Ti原子的电子排布式为。(3)、如图1,EDTA中所含元素的电负性从大到小的顺序为(填化学符号);所含碳原子采用的杂化轨道方式有;键角∠NCC(填“>”、“<”或“=”)∠CNC,原因是。(4)、如图2,钛与EDTA形成的配位离子中,配位数为 , 化学键的类型有(填序号)。A.离子键 B.非极性键 C.配位键 D.金属键
-
20、下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A.
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度较大
B.
分离汽油和四氯化碳
分液
四氯化碳和汽油的密度不同
C.
除去固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
A、A B、B C、C D、D