相关试卷
-
1、工业上合成
 的反应为
的反应为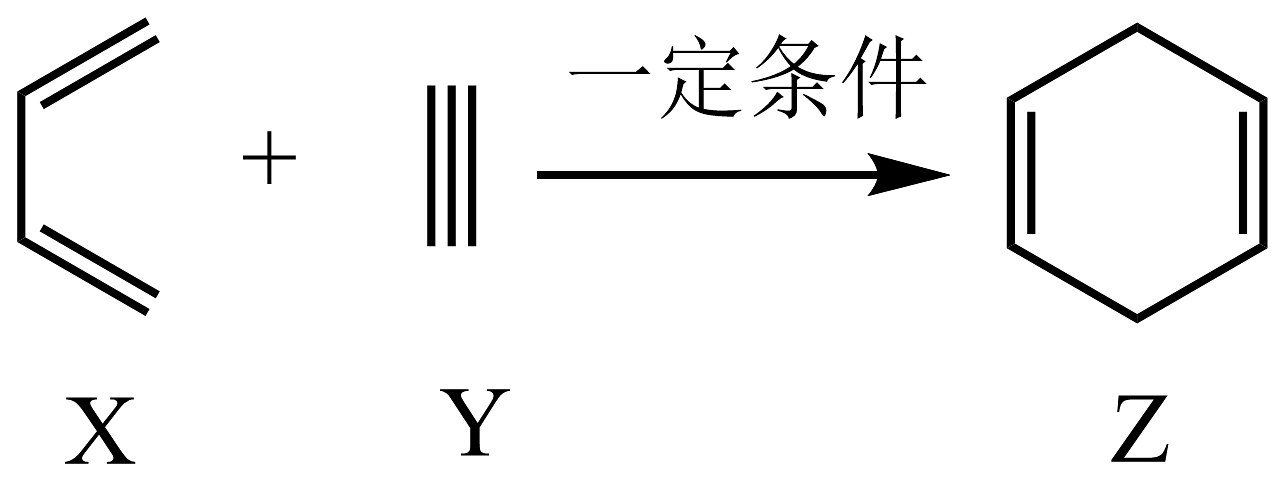 , 下列有关说法不正确的是 A、、、三种有机物均易发生加成反应 B、、、三种有机物分子中所有原子均有可能共平面 C、、、三种有机物使酸性高锰酸钾溶液褪色的原理相同 D、的二氯代物有种不考虑立体异构
, 下列有关说法不正确的是 A、、、三种有机物均易发生加成反应 B、、、三种有机物分子中所有原子均有可能共平面 C、、、三种有机物使酸性高锰酸钾溶液褪色的原理相同 D、的二氯代物有种不考虑立体异构 -
2、下列关于有机化合物的说法正确的是A、乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 B、葡萄糖和果糖的分子式都是 , 二者互为同分异构体 C、不含其他杂质的油脂属于纯净物 D、石油裂解和油脂皂化都是化学变化,而石油的分馏和煤的干馏都是物理变化
-
3、下列反应属于氧化还原反应的是A、 B、 C、 D、
-
4、下列物质中,工业上常用电解法冶炼的是A、Fe B、Na C、Cu D、Ag
-
5、下列各项叙述中,正确的是A、、、的电负性随原子序数的增大而增大 B、价电子排布为的元素位于第周期第Ⅴ族,是区元素 C、和轨道形状均为哑铃形,能量也相等 D、原子的价电子表示式不符合洪特规则
-
6、能源可划分为一次能源和二次能源,直接来自于自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。下列叙述正确的是( )A、水煤气是二次能源 B、水力是二次能源 C、天然气是二次能源 D、电能是一次能源
-
7、下列关于常见有机物的说法正确的是A、乙烯和苯都能和溴水发生化学反应而使溴水褪色 B、乙烷可使酸性高锰酸钾溶液褪色 C、糖类和蛋白质都是高分子化合物 D、乙酸和油脂都能与氢氧化钠溶液反应
-
8、浓盐酸是一种化学实验室常用的试剂。实验用浓盐酸一般质量分数为37.0%。(1)、用浓盐酸配制100mL浓度为0.100 mol/L的稀盐酸,下列操作错误的有
________。




A.浓盐酸稀释
B.上下颠倒摇匀
C.定容
D.用蒸馏水洗涤烧杯和玻璃棒
A、A B、B C、C D、D(2)、写出浓盐酸与MnO2混合加热生成MnCl2和Cl2的离子反应方程式。
(3)、在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物中仍存在盐酸和MnO2。①关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ.随着反应进行,c(H+)降低,Cl-的还原性减弱,不能被MnO2氧化
猜想ⅱ.随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi.随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能被MnO2氧化。
猜想iv.随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
该小组设计原电池装置验证上述猜想。
恒温装置未画出。每组实验前都将电池装置放电至无明显现象且电流表归零为止。

组别
实验步骤
实验现象
实验结论
实验反思与评价
i
向右侧烧杯中滴入几滴浓盐酸
该操作不能验证猜想i,理由是①。
ii
将实验步骤补充完整:②。
预测现象:③。
猜想ii成立
正极的电极反应方程式为④。
……
iv
在验证了猜想i不成立、猜想ii和iii均成立以后,向左侧烧杯中加入⑤ , (填化学式)向右侧烧杯中加入⑥。(填化学式)
电流表几乎无示数
猜想iv成立
-
9、LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
 A、a极为电源的负极,Y极上发生氧化反应 B、X极的电极反应式为2H2O-4e-=4H++O2↑ C、膜1为阳离子交换膜,膜2为阴离子交换膜 D、每转移2mol电子,理论上生成24g LiOH
A、a极为电源的负极,Y极上发生氧化反应 B、X极的电极反应式为2H2O-4e-=4H++O2↑ C、膜1为阳离子交换膜,膜2为阴离子交换膜 D、每转移2mol电子,理论上生成24g LiOH -
10、关于化合物M:
 下列说法正确的是 A、M分子中处于同一直线上的原子数最多为9个 B、M分子中仅含有1个手性碳原子 C、1mol M可以消耗1mol NaOH D、M不能使酸性KMnO4稀溶液褪色
下列说法正确的是 A、M分子中处于同一直线上的原子数最多为9个 B、M分子中仅含有1个手性碳原子 C、1mol M可以消耗1mol NaOH D、M不能使酸性KMnO4稀溶液褪色 -
11、下列实验装置或操作不正确的是


A.测定锌与稀硫酸反应速率
B.测定中和反应的反应热


C.制备乙烯
D.探究铁的吸氧腐蚀
A、A B、B C、C D、D -
12、下列过程中,颜色变化与氧化还原反应无关的是A、湿润的淀粉KI试纸遇氯气变蓝色 B、放置时间较长的苯酚固体变为粉红色 C、氯化铁溶液滴入KSCN溶液变红色 D、酸性K2Cr2O7溶液滴入乙醇变绿色
-
13、下列各组离子中能大量共存的是A、Cl-、OH-、SO、NH B、H+、Fe2+、SO、Cl- C、K+、Ba2+、NO、SO D、H+、Cl-、MnO、Fe2+
-
14、维生素C是重要的营养素,其分子结构如图。下列关于维生素C的叙述不正确的是
 A、维生素C的分子式为C6H8O6 B、分子中含有3种官能团 C、1mol该物质最多能与2mol H2加成 D、该物质能发生氧化反应、取代反应、消去反应
A、维生素C的分子式为C6H8O6 B、分子中含有3种官能团 C、1mol该物质最多能与2mol H2加成 D、该物质能发生氧化反应、取代反应、消去反应 -
15、实验室为配制0.10mol/L的稀硫酸,不需要用到的仪器是A、
 B、
B、 C、
C、 D、
D、
-
16、下列仪器与名称对应不正确的是A、坩埚
 B、圆底烧瓶
B、圆底烧瓶 C、长颈漏斗
C、长颈漏斗 D、容量瓶
D、容量瓶
-
17、下列说法中不正确的是




A.该实验用于观察Fe(OH)2
的颜色
B.比较Na2CO3和NaHCO3稳定性,甲物质为Na2CO3
C.光照过程中氯水中氯离子的浓度变化的主要原因是HClO见光分解
D.实验员看到钾元素的焰色为紫色
A、A B、B C、C D、D -
18、设NA为阿伏加德罗常数,下列说法正确的是A、0.1 mol Na2O2中阴离子的数目为0.2 NA B、0.1 mol Na2O2与足量的水反应,转移电子的数目为0.2 NA C、0.1 mol Fe和0.1 mol Cl2在点燃条件下反应时转移电子数目为0.2 NA D、1 L 0.4 mol·L-1的浓盐酸与足量的MnO2加热充分反应,产生Cl2的数目等于0.1 NA
-
19、某容器中发生一个化学反应,反应过程中存在Fe2+、、Fe3+、、H+和水六种粒子,在反应过程中测得Fe3+、的含量随时间变化的曲线如图所示,下列判断错误的是
 A、被还原,发生还原反应 B、还原性:Fe2+> C、该反应中Fe2+被氧化为Fe3+ D、还原剂与氧化剂的个数之比为6∶1
A、被还原,发生还原反应 B、还原性:Fe2+> C、该反应中Fe2+被氧化为Fe3+ D、还原剂与氧化剂的个数之比为6∶1 -
20、下列有关钠的化合物说法正确的是A、将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 B、将过氧化钠加入到硫酸亚铁溶液中,可以观察到有红褐色沉淀生成 C、过氧化钠与水反应生成NaOH,过氧化钠属于碱性氧化物 D、大量的Na2O2粉末加入到酚酞溶液中,可以观察到酚酞最终变红